Содержание
- 2. Основные нормативные документы - Федеральный закон РФ № 61-ФЗ «Об обращении лекарственных средств» от 12 апреля
- 3. Федеральный Закон РФ № 157-ФЗ «Об иммунопрофилактике инфекционных болезней» от 17.09.98г. (с изменениями и дополнениями). СП
- 4. Вакцины и анатоксины, создающие активный иммунитет Иммунные сыворотки и иммуноглобулины, обеспечивающие пассивную защиту Диагностикумы (аллергены) Цитокины
- 5. препараты, содержащие живые ослабленные или убитые микроорганизмы, которые при введении в организм человека вызывают выработку специфических
- 6. это изучение испытуемой вакцины с привлечением здоровых добровольцев с целью получения новых или подтверждения уже известных
- 7. Эпидемиологическая обоснованность применения вакцины на конкретной территории. Потребность медицинских учреждений в новом вакцинном препарате. Положительные результаты
- 8. регистрация вновь разработанной отечественной или зарубежной вакцин; изменение возрастной дозировки, схемы или метода иммунизации, и/или формы
- 9. государственная регистрация препарата; изучение возможности расширения показаний для медицинского применения в пострегистрационном периоде; выявление ранее неизвестных
- 10. определение безопасности и реактогенности; изучение иммуногенных свойств с последующим подбором оптимальных дозировок и схемы иммунизации; установление
- 11. Заявление о выдаче разрешения Отчет о ДИ и отчет о проведении ранее КИ (при наличии) Проект
- 12. Требования к организации клинического исследования аккредитация медицинского учреждения; разрешение на проведение клинического исследования; ответственный исследователь должен
- 13. Требования к организации проведения клинического исследования исследователи должны владеть: -результатами доклинического исследования; -методикой отбора добровольцев для
- 14. группы участников одинаковые по возрасту и полу (основные и сравнительные); одна и та же серия вакцины;
- 15. - видом вакцинного препарата; - схемой вакцинации и ревакцинации; -соблюдением интервала между введениями изучаемой вакцины и
- 16. Отбор контингентов для участия в клиническом исследовании Критерии включения: - возраст, пол; - схема иммунизации в
- 17. Критерии не включения: - дети-сироты и оставшиеся без родителей; - женщины в период беременности и в
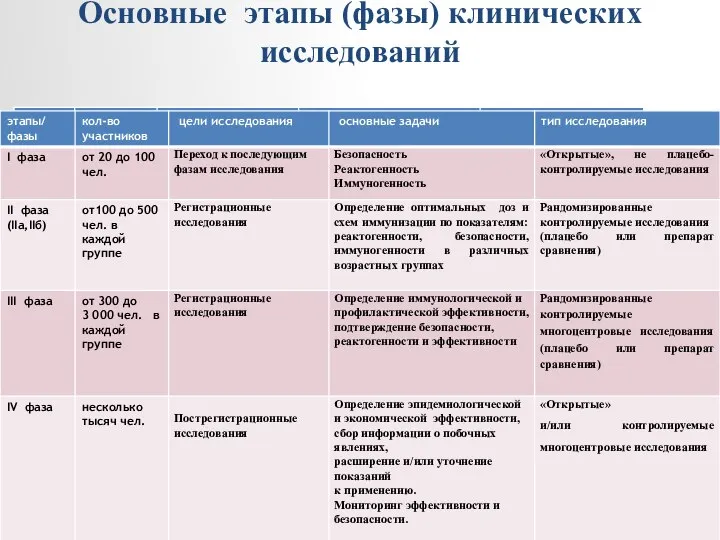
- 18. Основные этапы (фазы) клинических исследований
- 19. Оценка показателей безопасности новых препаратов начинается при проведении доклинических исследований. Безопасность оценивается на всех этапах, начиная
- 20. 1. оценка иммунного статуса (определение клеточного состава крови, Ig основных классов). 2. выявление изменений уровня иммунологической
- 21. Реактогенность - свойство препарата вызывать местные или общие реакции организма. Реактогенность препарата зависит от : -
- 22. Любое неблагоприятное изменение в состоянии здоровья субъекта клинического исследования, получающего вакцинный препарат независимо от причинной связи
- 23. Летальный исход. Состояние, угрожающее жизни. Состояние, требующее госпитализации. Стойкая или значительная утрата трудоспособности. Появление дефекта развития.
- 24. Ничтожный – менее 1/1 млн. привитых; Минимальный – от 1/1млн. до 1/100 тыс. привитых; Очень низкий
- 25. Достоверная – клинические проявления не могут быть объяснены наличием существующих заболеваний или других факторов, регрессируют после
- 26. Сомнительная – клинические проявления не имеют четкой временной связи с применением препарата, присутствуют другие факторы. Условная
- 27. характеристика степени положительного влияния препарата на течение, продолжительность заболевания или его предотвращение при конкретной инфекции. ЭФФЕКТИВНОСТЬ
- 28. Определяется показателями : Сероконверсии - нарастание значения титров специфических антител после вакцинации по сравнению с результатами
- 29. Индекс эффективности (ИЭ) – отражает соотношение заболеваемости в группе привитых и не привитых, что указывает, во
- 30. оценка эффективности иммунизации при применении вакцины в практическом здравоохранении путем проведения сравнительного эпидемиологического анализа до и
- 31. параметрические и непараметрические: - для количественных признаков – критерий Стьюдента , дисперсионный анализ; - для качественных
- 32. достоверность объема выполненных клинических исследований оценивается на основании коэффициента достоверности при его значении р достаточность размера
- 33. Пример. Сравнительное клиническое исследование вакцины Х и вакцины сравнения У. Предполагаем, что разница в эффективности вакцин
- 34. Схема иммунизации изучаемых вакцинных препаратов не согласуется со сроками Национального календаря профилактических прививок, принятого в Российской
- 35. Взятие крови на определение специфических антител у добровольцев после введения изучаемого препарата осуществляется в разные сроки
- 36. Не проводится детальный клинический анализ нежелательных явлений, что влияет на объективную оценку причинно-следственной связи. Имеют место
- 38. Скачать презентацию


































 Творчество душевнобольных
Творчество душевнобольных Диагностикалық алгритмі
Диагностикалық алгритмі Хирургические инструменты
Хирургические инструменты Учебная практика 11.12.15 – 19.12.15 гг
Учебная практика 11.12.15 – 19.12.15 гг Ультразвуковое исследование при патологии вен нижних конечностей
Ультразвуковое исследование при патологии вен нижних конечностей Аллергические осложнения вакцинации и их профилактика
Аллергические осложнения вакцинации и их профилактика Простагландины. Функции, используемые для терапии
Простагландины. Функции, используемые для терапии Некроз ткани
Некроз ткани Шизофрения
Шизофрения Особенности течения и распространения болезней печени и желчных путей. Гепатиты разных видов животных (лекция № 15)
Особенности течения и распространения болезней печени и желчных путей. Гепатиты разных видов животных (лекция № 15) Зубочелюстная система как единое целое
Зубочелюстная система как единое целое Анатомия лимфатической системы
Анатомия лимфатической системы Асептика и антисептика
Асептика и антисептика Как сохранить зрение
Как сохранить зрение Дезинфекция и стерилизация инструментов
Дезинфекция и стерилизация инструментов Киеңкі (қарақаптал, трипаносомоз)
Киеңкі (қарақаптал, трипаносомоз)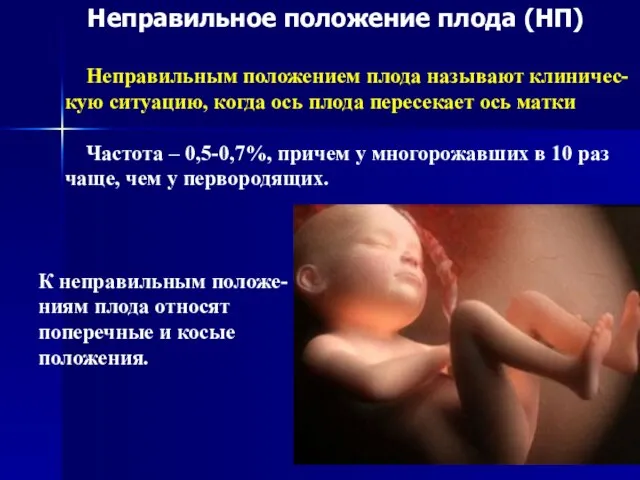 Неправильное положение плода (НП)
Неправильное положение плода (НП) Интубация трахеи
Интубация трахеи ВОЗ/ЮНИСЕФ Охрана, поощрение и поддержка практики грудного вскармливания
ВОЗ/ЮНИСЕФ Охрана, поощрение и поддержка практики грудного вскармливания Обструктивная патология нижних мочевыводящих путей
Обструктивная патология нижних мочевыводящих путей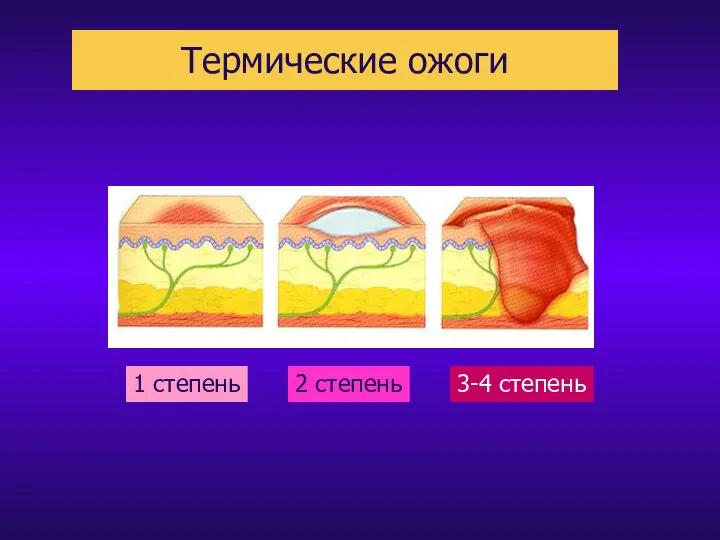 Термические ожоги
Термические ожоги Инфекционные заболевания, их классификация и профилактика
Инфекционные заболевания, их классификация и профилактика Судорожный синдром
Судорожный синдром Технология, делающая реабилитацию доступной
Технология, делающая реабилитацию доступной CCK1R у жителей Москвы. Исследования полиморфизма гена, кодирующего рецептор холецистокинина 1-го типа у жителей Москвы
CCK1R у жителей Москвы. Исследования полиморфизма гена, кодирующего рецептор холецистокинина 1-го типа у жителей Москвы Первая медицинская помощь
Первая медицинская помощь Прием и регистрация проб для микробиологического исследования
Прием и регистрация проб для микробиологического исследования Молекулярные механизмы нейроэндокринной регуляции
Молекулярные механизмы нейроэндокринной регуляции