Содержание
- 2. Система уведомляет об обнаружении «положительных» культур несколькими способами: Загорается индикатор POSITIVE (ПОЛОЖИТЕЛЬНО) на передней панели секции
- 3. Нажмите клавишу ОТКЛ. СИГНАЛА ТРЕВОГИ для отключения звукового сигнала. Откройте нужную секцию. Нажмите программную клавишу «remove
- 4. Извлечение «положительных» пробирок Включится сканер штрихкода, и в основной области экрана появится значок штрихкода - это
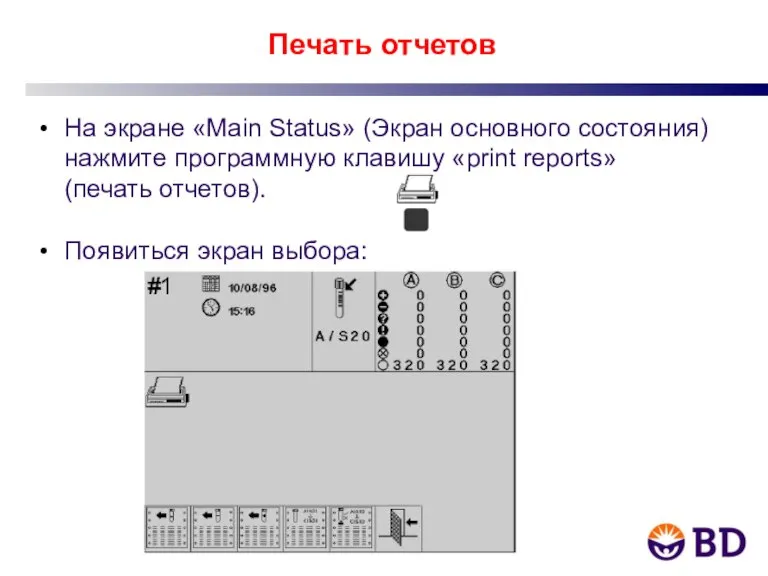
- 5. Печать отчетов На экране «Main Status» (Экран основного состояния) нажмите программную клавишу «print reports» (печать отчетов).
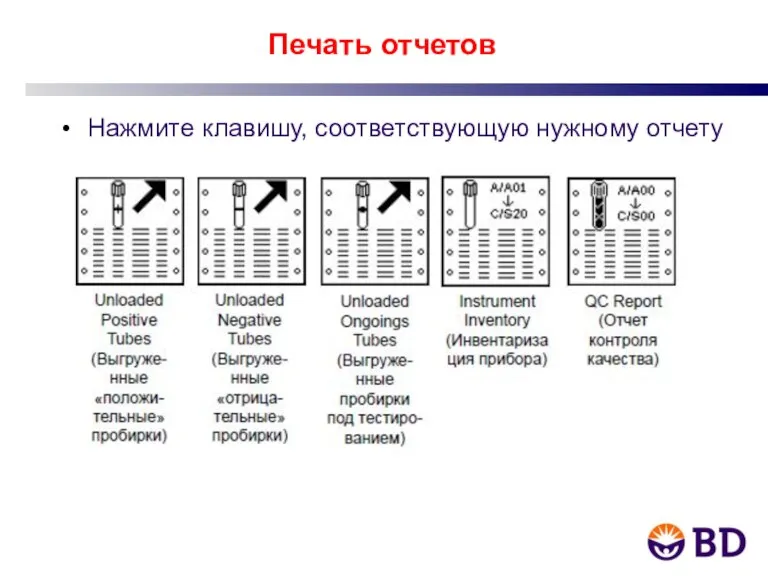
- 6. Печать отчетов Нажмите клавишу, соответствующую нужному отчету
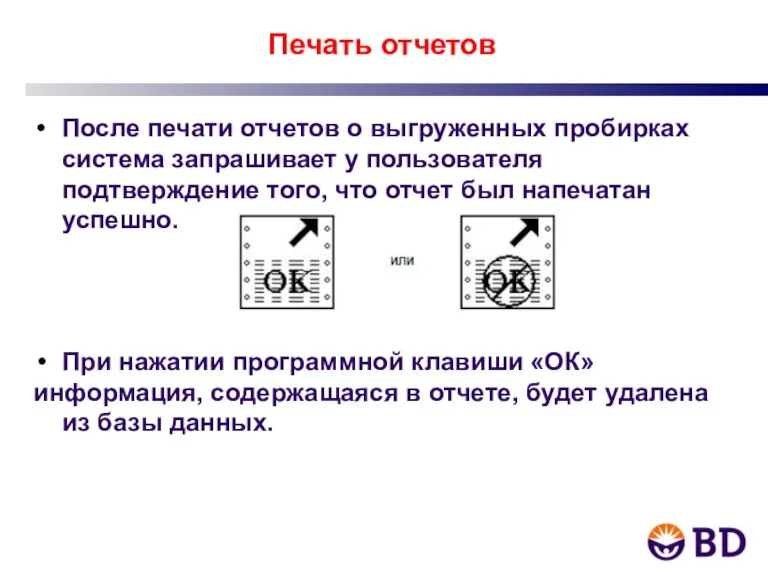
- 7. Печать отчетов После печати отчетов о выгруженных пробирках система запрашивает у пользователя подтверждение того, что отчет
- 8. Следует просмотреть пробирку и визуально определить наличие роста микобактерий. Обычно в жидкой среде микобактерии растут в
- 9. Содержимое из «положительной» пробирки должно быть использовано (в указанном порядке) для: посева на кровяной агар для
- 10. Идентификационный тест BD MGIT™TBcID представляет собой экспресс-метод иммунохроматографического анализа для качественного определения антигена (МРТ64) комплекса Mycobacterium
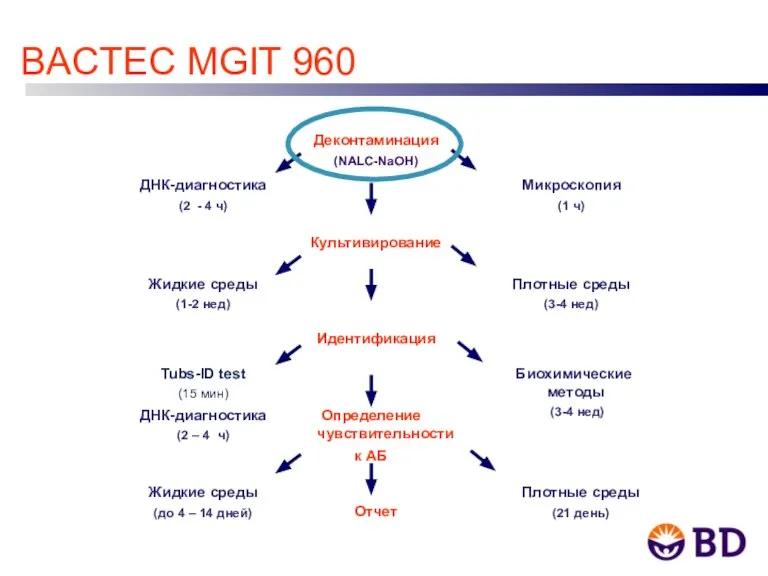
- 11. BACTEC MGIT 960 Деконтаминация (NALC-NaOH) ДНК-диагностика (2 - 4 ч) Микроскопия (1 ч) Культивирование Жидкие среды
- 12. Детекция отрицательного роста Максимальное время инкубации пробирок в приборе MGIT – 6 недель. Пробирки, в которых
- 13. Детекция отрицательного роста Для того, чтобы извлечь «отрицательные» пробирки, необходимо открыть соответствующий ящик и нажать клавишу
- 14. Бактериальная контаминация Для жидкой среды допустимый уровень контаминации до – 4-7%. Слишком низкий уровень контаминации (менее
- 15. Причины высокой контаминации • неправильная или недостаточная деконтаминация проб, особенно, если пробы имеют повышенную мукоидную консистенцию;
- 16. Контаминацию можно подтвердить следующим образом: 1. Необходимо окрасить мазок по методу Циль–Нильсена. Присутствие некислотоустойчивых бактерий в
- 17. Если сохраняется высокий уровень контаминации (крайние меры): 1. Увеличить концентрацию NaOH, но не более 1,5% конечной
- 19. Скачать презентацию












 Антибактериальная активность лекарственных растений в отношении антибиотикочувствительных и антибиотикоустойчивых бактерий
Антибактериальная активность лекарственных растений в отношении антибиотикочувствительных и антибиотикоустойчивых бактерий Отличия Хондроитина сульфата и Глюкозамина сульфата
Отличия Хондроитина сульфата и Глюкозамина сульфата Травматический шок
Травматический шок Нарушение кровообращения
Нарушение кровообращения Выделение. Мочевыделительная система
Выделение. Мочевыделительная система Если хочешь быть здоровым. Раздел: Здоровое питание. Урок: Полезные продукты и их значение для организма
Если хочешь быть здоровым. Раздел: Здоровое питание. Урок: Полезные продукты и их значение для организма Бүйректің инкреторлық қызметтері; ренин-ангиотензиндік жүйе, эритропоэтин және т.б. Жасанды бүйрек
Бүйректің инкреторлық қызметтері; ренин-ангиотензиндік жүйе, эритропоэтин және т.б. Жасанды бүйрек Летние отравления
Летние отравления Фейсфитнес. Групповые семинары
Фейсфитнес. Групповые семинары Доброкачественные и предраковые заболевания шейки матки
Доброкачественные и предраковые заболевания шейки матки Переливание крови
Переливание крови Antibiotiki (3)
Antibiotiki (3) Трансперинеальная биопсия и Fusion-биопсия
Трансперинеальная биопсия и Fusion-биопсия Общий анализ мочи (ОАМ). Автоматическая мочевая станция FUS-100 + H-800, Dirui
Общий анализ мочи (ОАМ). Автоматическая мочевая станция FUS-100 + H-800, Dirui Алиментарные лимфомы собак
Алиментарные лимфомы собак Лекарство против скуки. Электронная викторина посвященная году медицинского работника
Лекарство против скуки. Электронная викторина посвященная году медицинского работника Ультрадыбыстық суреттерді интерпретациялау
Ультрадыбыстық суреттерді интерпретациялау Какие существуют марки по уходу в СПА за ногами
Какие существуют марки по уходу в СПА за ногами Анатомия и физиология системы пищеварения
Анатомия и физиология системы пищеварения Пам’ятка щодо запобіганню z захворювання covid 19. Порядок дій у разі захворювання!
Пам’ятка щодо запобіганню z захворювання covid 19. Порядок дій у разі захворювання! Цитомегаловирусная инфекция
Цитомегаловирусная инфекция Отделение терапии и восстановительного лечения ТОО РДЦ
Отделение терапии и восстановительного лечения ТОО РДЦ Хламидийная пневмония
Хламидийная пневмония Молодёжь за безопасный секс
Молодёжь за безопасный секс Влияние наркотических веществ на здоровье человека
Влияние наркотических веществ на здоровье человека Патофизиология опухолевого роста
Патофизиология опухолевого роста Хирургические операции. Виды операций
Хирургические операции. Виды операций Эффекты и механизмы действия вакуума на ткани раны
Эффекты и механизмы действия вакуума на ткани раны