Содержание
- 2. План: Почему их так назвали? Чем опасны? Чем они занимаются? Они непобедимы? Список литературы
- 3. Расшифровка Protein «белок» + infection «инфекция» Стенли Прузинер
- 4. Сейчас наукой принято следующее: 1.Возбудитель прионных болезней — это мутантная (инфекционная) форма обычного, особенно активно синтезируемого
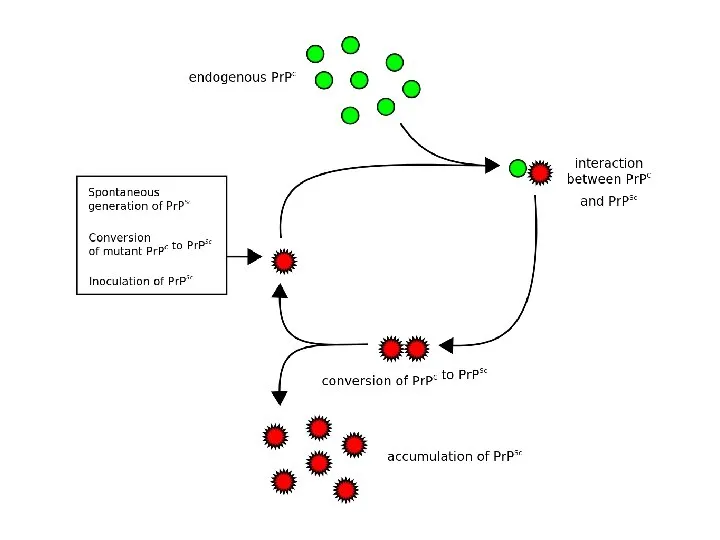
- 5. Продолжение: 2. Приобретение ифекционных свойств белком связано с конформационным переходом (PrPc PrPSc) А. Спонтанно спорадическая форма
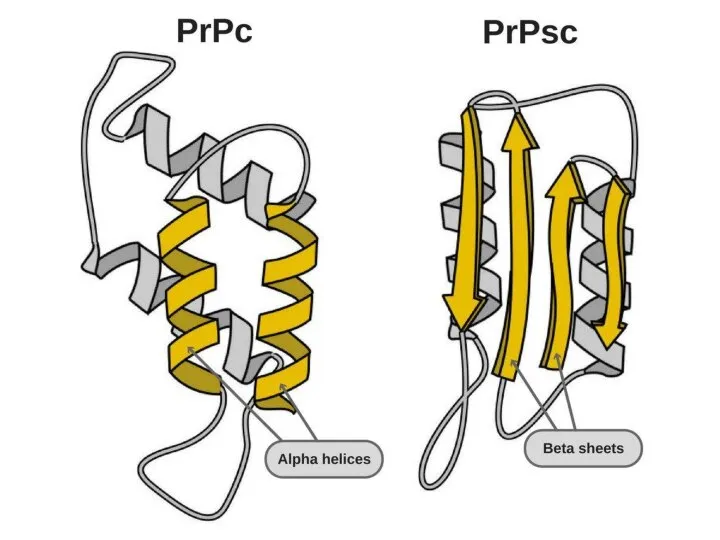
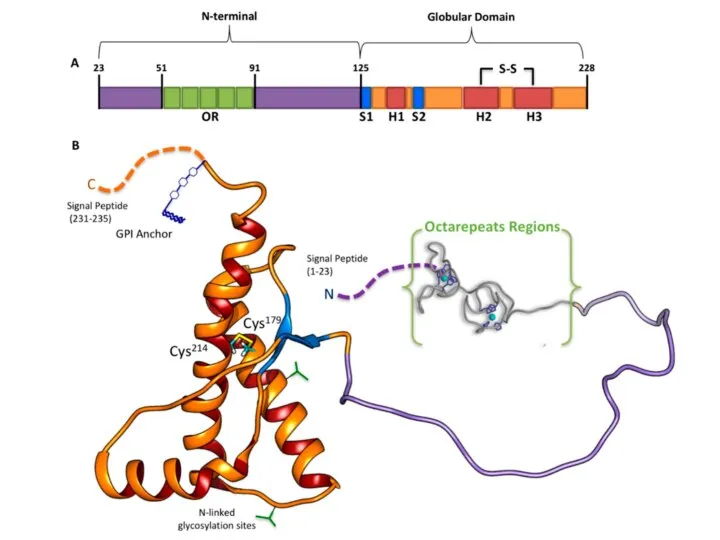
- 6. Продолжение 3.PrPc содержит больше альфа-спиралей (42 %)и меньше бета-структур (3%), тогда как у его инфекционной формы
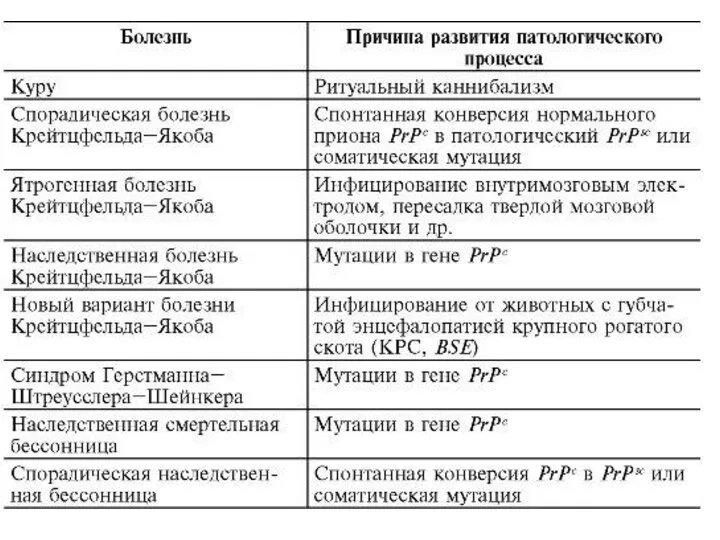
- 7. Какие болезни вызывают прионы?
- 10. Как происходит переход на «темную сторону» нормального белка? Как этот белок потом распространяется в организме? The
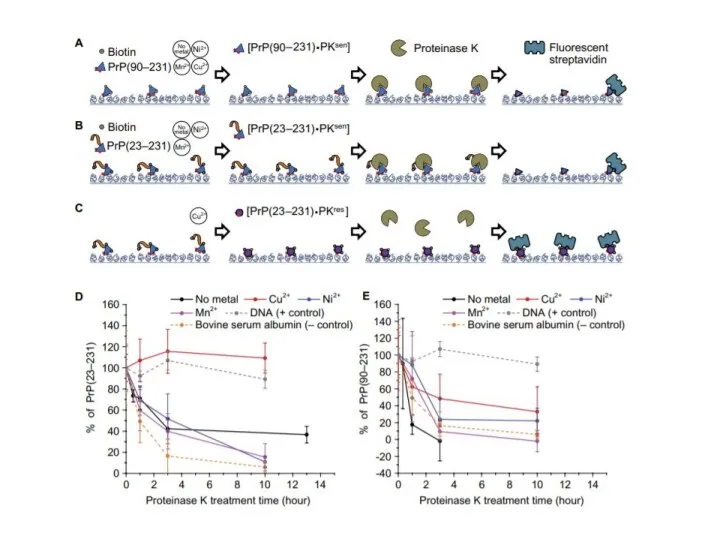
- 14. Иммобилизованные мономеры PrP инкубировали в течение ночи либо в присутствии, либо в отсутствии 1 мм Ионов
- 16. Если биотинилированный PrP превращается в конформацию PrPres, он не переваривается PK и поэтому может связываться с
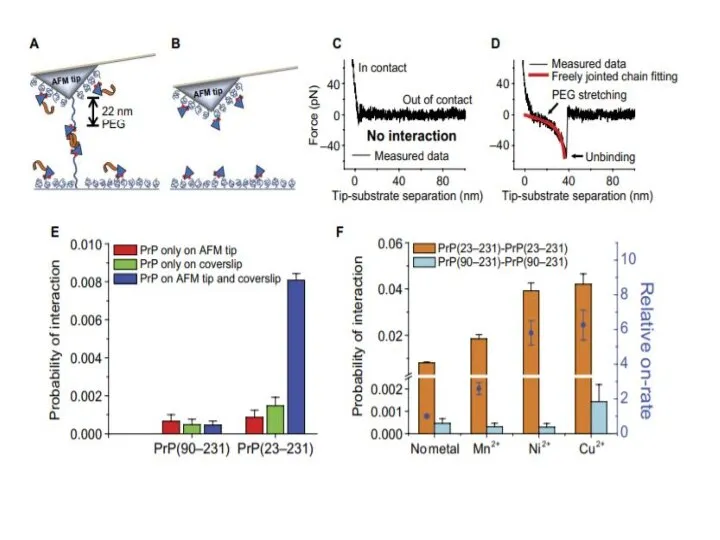
- 17. Наши данные показали, что только полноразмерный PrP [PrP(23-231)], инкубированный в Cu2+, превращается в стабильную конформацию PrPres.
- 18. Эти результаты показывают, что мономерное образование PrPres требует как внутренне неупорядоченной N-концевой области, так и ионов
- 20. Итоги эксперимента: N-концевой участок в присутствии ионов меди приводит к образованию резистентоного прионного белка Резистентные прионные
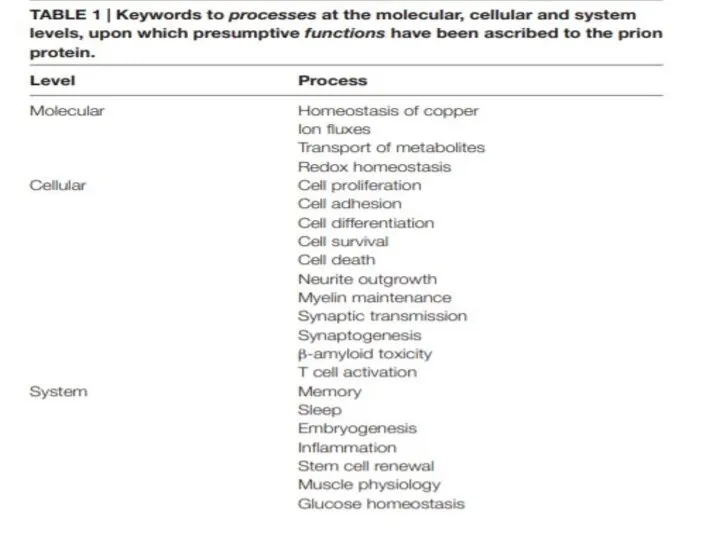
- 21. В чем заключается биологическая функция приона?
- 23. Экспериментальные исследования показывают, что PrPC может связывать олигомеры β-пептида и опосредовать трансдукцию сигнала, индуцированную последним
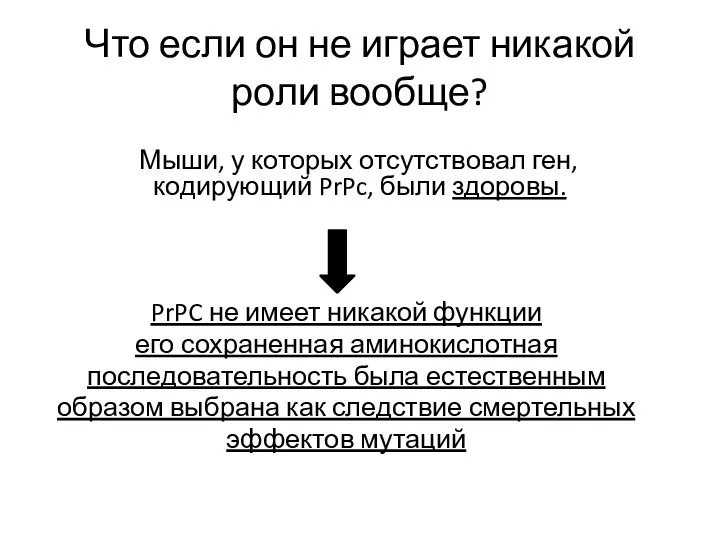
- 24. Что если он не играет никакой роли вообще? Мыши, у которых отсутствовал ген, кодирующий PrPc, были
- 25. Неясность в научном сообществе Передает амилоидный сигнал или все-таки нет? Участвует в продукции стволовых клеток или
- 26. Поиск Протеина Х
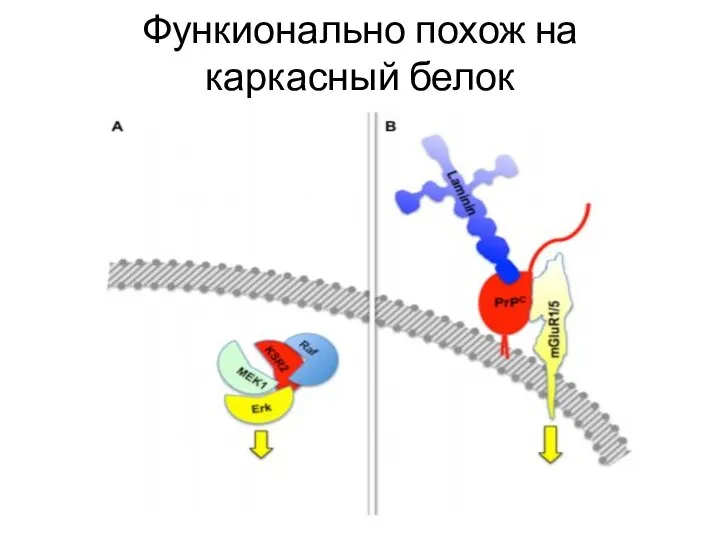
- 27. Функионально похож на каркасный белок
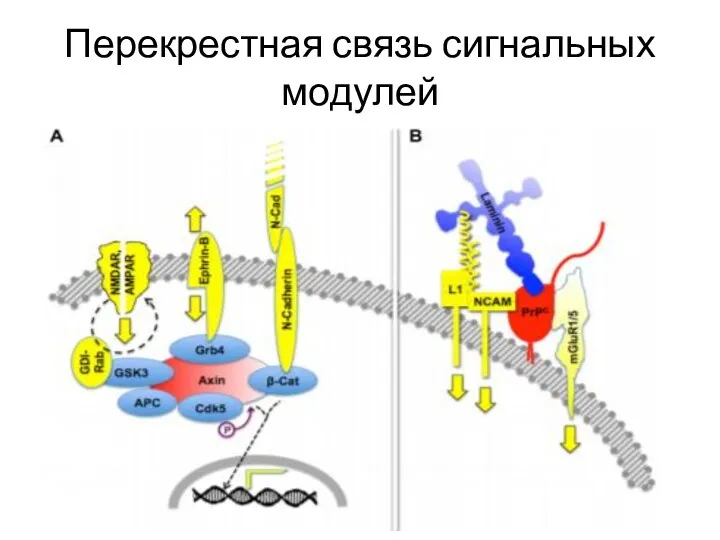
- 28. Перекрестная связь сигнальных модулей
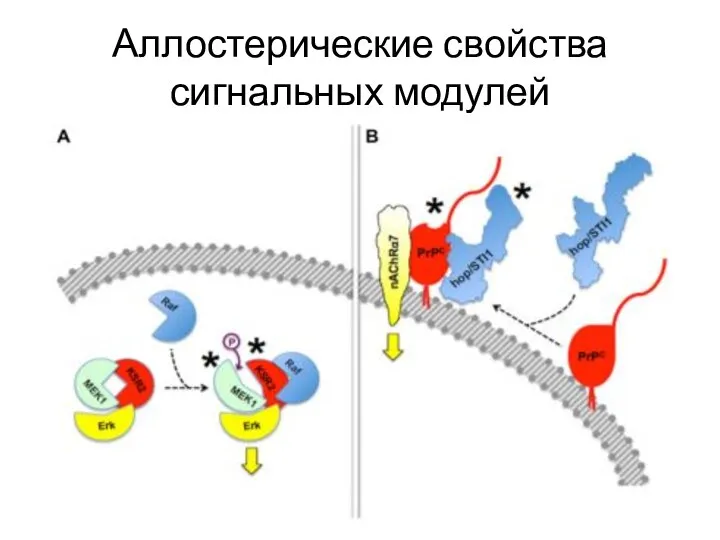
- 29. Аллостерические свойства сигнальных модулей
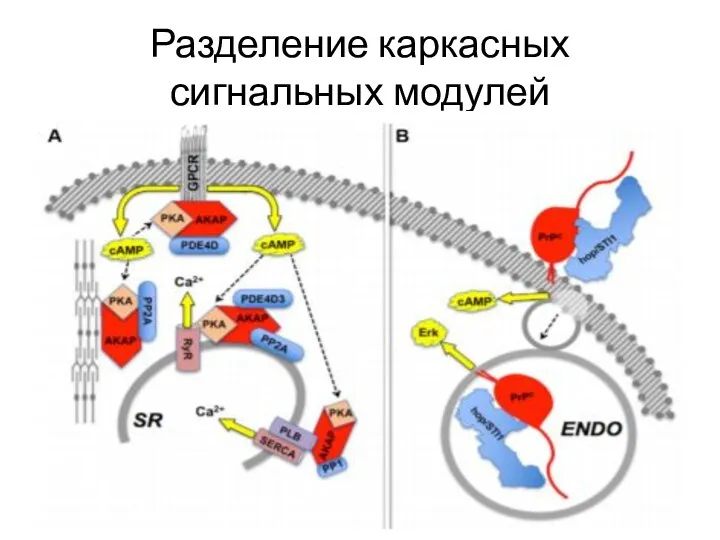
- 30. Разделение каркасных сигнальных модулей
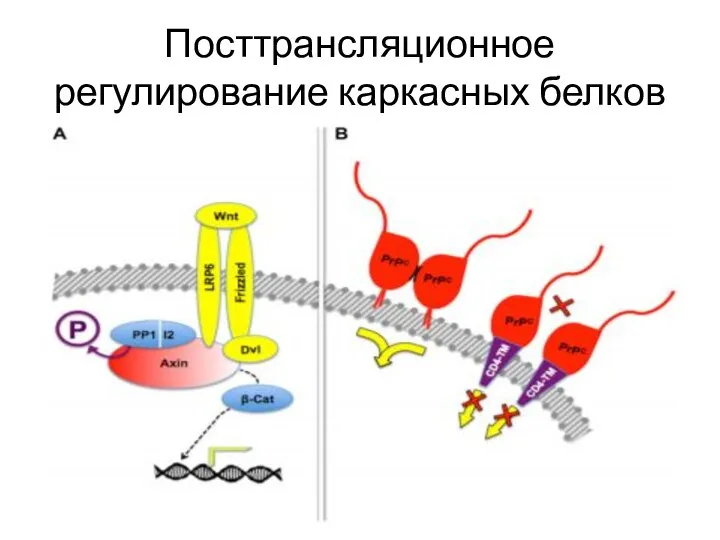
- 31. Посттрансляционное регулирование каркасных белков
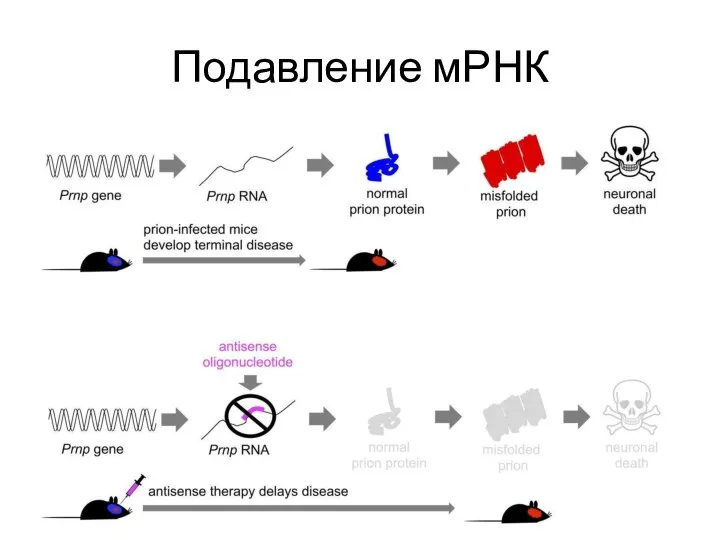
- 32. Прионные заболевания на данный момент неизлечимы. Однако уже на сегодняшний день разработана Антисмысловая терапия, замедляющая на
- 33. Подавление мРНК
- 34. Прионы будут побеждены!
- 36. Скачать презентацию









![Наши данные показали, что только полноразмерный PrP [PrP(23-231)], инкубированный в Cu2+, превращается](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1048226/slide-16.jpg)







 Регуляция осмотического давления
Регуляция осмотического давления Внутриутробное развитие плода (8-16 неделя)
Внутриутробное развитие плода (8-16 неделя) Травмобезопасность коленей, поясничного и шейного отдела позвоночника при выполнении асан
Травмобезопасность коленей, поясничного и шейного отдела позвоночника при выполнении асан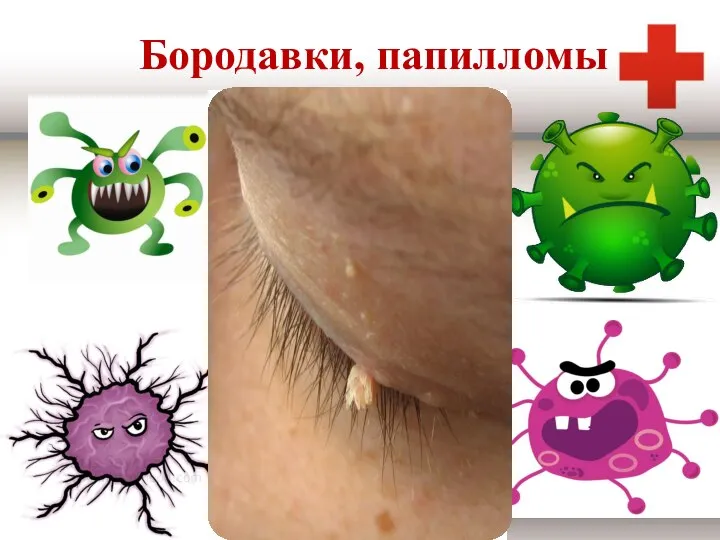 Бородавки, папилломы
Бородавки, папилломы Сакроилеит. Факторы
Сакроилеит. Факторы Медициналық бикенің жеке бас гигиенасы. Қорғаныс киімдерін қолдану ережелері
Медициналық бикенің жеке бас гигиенасы. Қорғаныс киімдерін қолдану ережелері Здоровье России. Достояние России AltaiSPB
Здоровье России. Достояние России AltaiSPB Гипогонадотропная аменорея
Гипогонадотропная аменорея Кома. Диагностика и неотложная помощь
Кома. Диагностика и неотложная помощь Гигиена. Личная гигиена
Гигиена. Личная гигиена Общие нарушения жизнедеятельности хирургического больного. Лекция 6
Общие нарушения жизнедеятельности хирургического больного. Лекция 6 Оценка суточного ритма артериального давления у детей и подростков
Оценка суточного ритма артериального давления у детей и подростков Аномалии положения зубов
Аномалии положения зубов Основные формы иммунного реагирования. Лекция 9
Основные формы иммунного реагирования. Лекция 9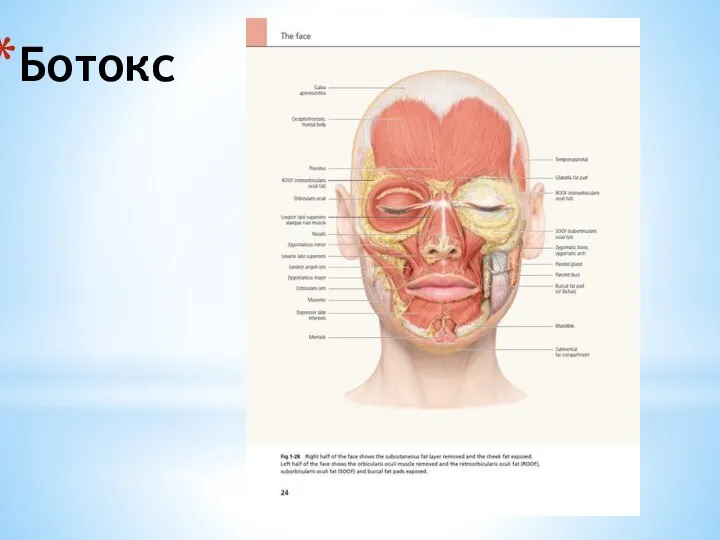 Ботокс. Терапия гипертонуса мышц. Коррекция гипергидроза
Ботокс. Терапия гипертонуса мышц. Коррекция гипергидроза Изменение кариотипа
Изменение кариотипа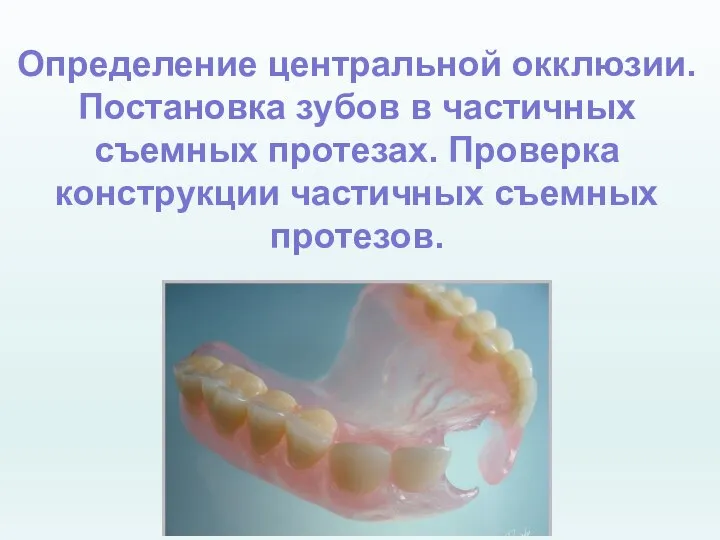 2019_Lektsia_Ts_O (1)
2019_Lektsia_Ts_O (1) Федеральный фонд обязательного медицинского страхования
Федеральный фонд обязательного медицинского страхования Осложнения, возникающие до и после удаления зуба
Осложнения, возникающие до и после удаления зуба Неодонтогенные воспалительные заболевания челюстно-лицевой области
Неодонтогенные воспалительные заболевания челюстно-лицевой области Мята. Химический состав
Мята. Химический состав Медикаментозное прерывание беременности
Медикаментозное прерывание беременности Prezentatsia_Microsoft_Office_PowerPoint
Prezentatsia_Microsoft_Office_PowerPoint Мочеполовой аппарат
Мочеполовой аппарат Кровотечение
Кровотечение Влияние факторов внешней среды на эмбриогенез человека
Влияние факторов внешней среды на эмбриогенез человека Психопатологическая семиотика. Психопатологическая синдромология. Первая помощь при эпилепсии
Психопатологическая семиотика. Психопатологическая синдромология. Первая помощь при эпилепсии Миома матки
Миома матки