Слайд 2Количественной оценкой биологических эффектов, развивающихся под влиянием поступивших в организм радиоактивных химических

эффектов (радионуклидов), занимается самостоятельная научно-практическая дисциплина – радиотоксикология.
Слайд 4ПУТИ ПОСТУПЛЕНИЯ РАДИОНУКЛИДОВ В ОРГАНИЗМ

Слайд 5КРИТИЧЕСКИЙ ОРГАН
Орган является критическим, если он:
Получает наибольшую дозу или наибольшее количество радионуклидов;
Играет

наиболее важную роль (или необходим) для нормального функционирования всего организма;
Обладает наибольшей радиочувствительностью, т.е. повреждается самой низкой дозой излучения по сравнению с другими органами.
Слайд 7ФАРМАКОХИМИЧЕСКАЯ ПРОТИВОЛУЧЕВАЯ ЗАЩИТА ОРГАНИЗМА
Реальная возможность повышения радиорезистентности организма состоит в применении средств

противолучевой защиты, под которыми понимают специальные фармакологические препараты – радиопротекторы, или создание гипоксического состояния кратковременным вдыханием обедненных кислородом газовых смесей.
Под фармакологической защитой (в строгом смысле слова) понимают повышение выживаемости животных с помощью того или иного протектора, применяемого в разные сроки перед облучением.
Слайд 8ОСНОВНЫЕ КЛАССЫ ХИМИЧЕСКИХ РАДИОПРОТЕКТОРОВ
Цианистый натрий – одно из двух соединений, о котором

в 1949 г. А. Эрв и З. Бак сообщили как о протекторе; введение его мышам в количестве 5 мг/кг непосредственно перед облучением в летальных дозах повышало из выживаемость по сравнению с контролем.
Цианид натрия очень токсичен. При попадании в организм он ингибирует ферменты тканевого дыхания, и ткани теряют способность усваивать кислород из крови.
Слайд 9ЦИСТЕИН
Цистеин – второе соединение, с которым связано открытие явление фармакологической противолучевой защиты.
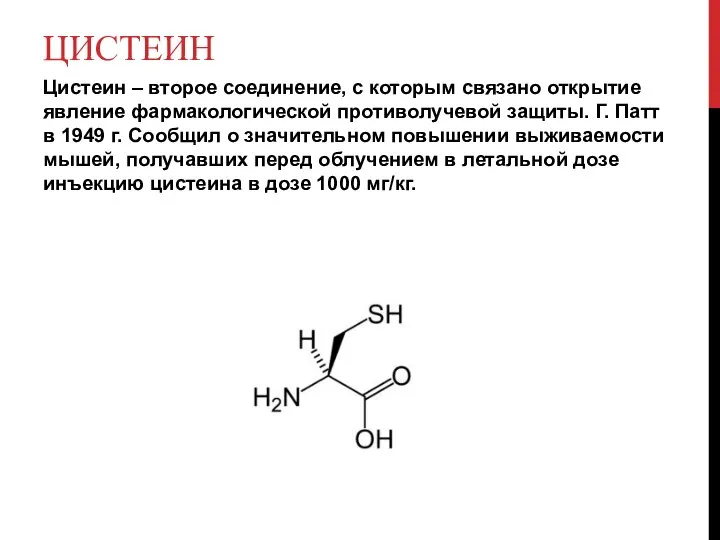
Г. Патт в 1949 г. Сообщил о значительном повышении выживаемости мышей, получавших перед облучением в летальной дозе инъекцию цистеина в дозе 1000 мг/кг.
Слайд 10Несмотря на обилие испытанных средств, наиболее перспективные и высокоэффективные из них относятся

к двум большим классам соединений: индолилалкиламинам и меркаптоалкиламинам.
Слайд 12МЕХАНИЗМЫ ПРОТИВО-ЛУЧЕВОЙ ЗАЩИТЫ

Слайд 13ПЕРЕХВАТ И ИНАКТИВАЦИЯ СВОБОДНЫХ РАДИКАЛОВ
Начиная с первых работ П. Александера и З.

Бака (1955), установивших для соединений различных классов корреляцию между их радиозащитной активностью in vivo и in vitro, широкое распространение получила точка зрения об общем механизме действия радиопротекторов, состоящем в уменьшении косвенного действия радиации путем перехвата и инактивации свободных радикалов и других активных продуктов радиолиза воды.
Слайд 14Противоречит противорадикальному механизму тот факт, что локальное внутриклеточное содержание протекторов значительно ниже,

чем эффективные концентрации в облучаемых растворах, а способность реагировать с радикалами едва ли выше, чем у различных клеточных метаболитов. Серьезное возражение, наконец, состоит в том, что радиочувствительность ферментов, нуклеиновых кислот и других биологически важных соединений резко снижается при переходе от растворов к клетке и организму.
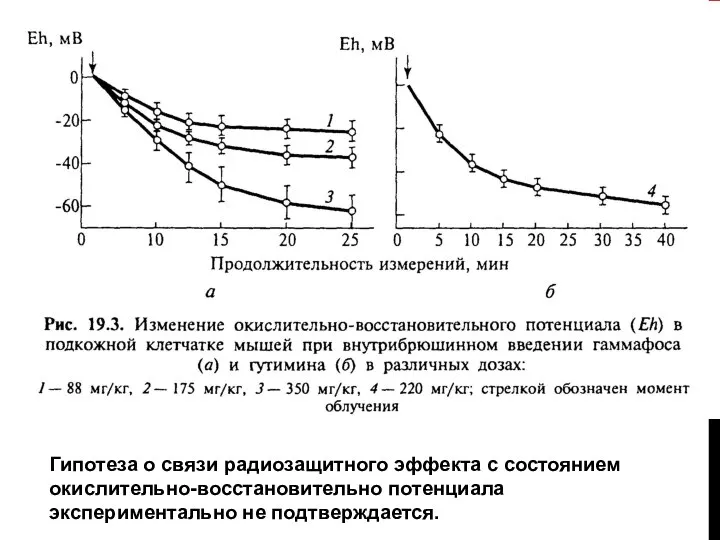
Слайд 15ИЗМЕНЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ПОТЕНЦИАЛА
Радиозащитный эффект гаммафоса при дозе 350 мг/кг, оцениваемый по выживаемости

мышей, максимален через 15 мин (ФИД=2,7) и стается практически на этом уровне довольно долго (через 75 мин ФИД=2,5), а значение Eh за то же время значительно снижается (кривая 3), что казалось бы, должно сопровождаться усилением защиты. С другой стороны, при минимальной дозе препарата (88 мг/кг) слабый защитный эффект (ФИД<1,2) обнаруживается при 15-минутном интервале и отсутствует через 30 мин,тогда как в эти сроки значения Eh одинаковы (кривая 1.)
Слайд 16Гипотеза о связи радиозащитного эффекта с состоянием окислительно-восстановительно потенциала экспериментально не подтверждается.
Слайд 19МЕХАНИЗМ ДЕЙСТВИЯ СЕРОАЗОТСОДЕРЖАЩИХ РАДИОПРОТЕКТОРОВ:
непосредственно воздействуют на возбужденные молекулы биосубстрата, в момент воздействия

ионизирующего излучения и нормализуют их физическое состояние путем восстановления электронного слоя;
временно, обратимо угнетают активные молекулы биосубстрата «защищая» их от поражения;
инактивируют образующиеся жирокислотные радикалы на стадии образования гидроперекисей, чем блокируют цепные реакции и существенно снижают количество радиотоксинов в лимфе;
связывают двухвалентные металлы – катализаторы окисления, что способствует обрыву реакций перекисного окисления;
усиливают дренажно-детоксицирующую функцию лимфатической системы, что проявляется в увеличении лимфовыделения.

















 Значение v. facialis при возникновении гнойно-воспалительного процесса в мягких тканях лица
Значение v. facialis при возникновении гнойно-воспалительного процесса в мягких тканях лица Лекарственные растения содержащие флавоноиды. Onosis arvensis (стальник полевой)
Лекарственные растения содержащие флавоноиды. Onosis arvensis (стальник полевой) Подготовка преподавателей для обучения медицинских работников организации борьбы с туберкулезом в ПМСП
Подготовка преподавателей для обучения медицинских работников организации борьбы с туберкулезом в ПМСП Обморожения. Первая помощь
Обморожения. Первая помощь Основы здорового образа жизни
Основы здорового образа жизни Абсцессы и флегмоны ЧЛО
Абсцессы и флегмоны ЧЛО Ми бөлімдері олардың құрылысы мен қызыметі: сопақша ми, көпірі, және аралық ми, мишық, улкенн ми сыналары
Ми бөлімдері олардың құрылысы мен қызыметі: сопақша ми, көпірі, және аралық ми, мишық, улкенн ми сыналары Мышечная система
Мышечная система Зубной порошок
Зубной порошок Особо презентация Егорова Полина
Особо презентация Егорова Полина Профилактика заболеваний, передающихся половым путём (ЗППП) и вопросы консультирования
Профилактика заболеваний, передающихся половым путём (ЗППП) и вопросы консультирования Презентация6
Презентация6 Клиникалық диагноз
Клиникалық диагноз Сальмонеллез. Эпидемиология. Клиническая классификация сальмонеллезов
Сальмонеллез. Эпидемиология. Клиническая классификация сальмонеллезов Стан надання спеціалізованої медичної допомоги хворим нефрологічного профілю в Одеській області
Стан надання спеціалізованої медичної допомоги хворим нефрологічного профілю в Одеській області Раны. Формы ран
Раны. Формы ран Що таке дискордантна пара
Що таке дискордантна пара Редкая причина гепатомегалии
Редкая причина гепатомегалии Спирулина - лучшая оздоровительная продукция XXI века (ВОЗ)
Спирулина - лучшая оздоровительная продукция XXI века (ВОЗ) Заболеваемость туберкулёзом в России
Заболеваемость туберкулёзом в России Профилактика и лечение вирусной инфекции человека
Профилактика и лечение вирусной инфекции человека Лекарственный формуляр детского инфекционного отделения
Лекарственный формуляр детского инфекционного отделения Recipe. Basic prescription rules
Recipe. Basic prescription rules Ауырсыну кезіндегі фармацевтикалық қамқорлық
Ауырсыну кезіндегі фармацевтикалық қамқорлық Приёмка товаров в аптеке и её документальное оформление
Приёмка товаров в аптеке и её документальное оформление Туберкулез. Причины туберкулеза. Характеристика возбудителя. Профилактика и лечение
Туберкулез. Причины туберкулеза. Характеристика возбудителя. Профилактика и лечение Организация работы участковой медицинской сестры педиатрического участка
Организация работы участковой медицинской сестры педиатрического участка Гипомнезия и ее виды
Гипомнезия и ее виды