Слайд 2
Сучасні страндарти надання медичної допомоги містять комплекс високоточних методів діагностики - радіонуклідну діагностику.
Радіонуклідна

діагностика – це розділ медичної радіології, який вивчає методи дослідження функції і морфології органів і систем людини за допомогою радіфармацевтичних препаратів (РФП).
Слайд 3В основі радіонуклідного методу діагностики лежить явище природної радіоактивності, відкрите в кінці

ХІХ століття французьким фізиком Анрі Беккерелем. А.Беккерель експериментував з речовинами, що мають здатність до флуоресценції під впливом світла видимого спектру.
Він припускав отримати засвічування фотоплівки, загорнутої в чорний папір при впливі на неї променями, що випускаються флуоресцируючими мінералами. Одним з таких мінералів була руда, що містить солі урану.
Слайд 4 Однак вчений виявив, що фотоплівка засвічувалася при впливі на неї сполук

урану не тільки в моменти, коли вони випускали видиме світло, але і в повній темряві, коли світіння уранових солей не спостерігалося.
Таким чином, А. Беккерель встановив, що уран здатний випускати невидимі промені, які викликають засвічування рентгенівської пластини, тобто за властивостями нагадують ті, що були відкриті В. Рентгеном. 24 лютого 1896 р.
Слайд 5Вільгельм Конрад Рентген
Антуан Анрі Беккерель

Слайд 6Що таке РПФ?
РФП – це радіонукліди або мічені хімічні сполуки, в яких частина

нейтральних атомів заміщена радіоактивними. Хімічні властивості радіонуклідів тотожні властивостям стабільних тих же хімічних елементів і тому їх метаболізм в організмі однаковий, що дозволяє робити висновки про метаболізм відповідних стабільних речовин.
Слайд 7В клінічній практиці все більшого значення набувають малотравматичні засоби діагностики захворювань внутрішніх

органів та систем. Як показав досвід останніх років, ці дослідження найбільш інформативні при використанні різних методик променевої діагностики, в тому числі методик РНД.
Ці методики дозволяють вивчати стан обміну речовин, функції органів і систем, швидкість руху крові і лімфи, перебіг секреторно-екскреторних процесів, а також отримувати анатомо-топографічне зображення органів.
Унікальність методик РНД обумовлена можливістю дослідження всього комплексу біохімічних та анатомо-функціональних порушень, які мають місце при різних патологічних станах
Слайд 8Всі радіонуклідні дослідження поділяють на дві великі групи:
дослідження, при котрих радіофармацевтичний

препарат (РФП) вводять в організм пацієнта ("in vivo") та
дослідження біологічної рідини ("in vitro").
Останні є перспективним методом РНД і, в свою чергу, бувають двох типів.
Перший - це реєстрація радіоактивності крові, сечі та інше, забраних у хворого, в організм якого був попередньо введений РФП.
Другий - вивчення реакції крові хворого, який не отримував РФП, зі стандартними радіофармацевтичними реактивами (тест-системами).
Слайд 9Радіонуклідні дослідження “in vivo”
Більшість методик потребує інєкції РФП переважно в вену, значно

менше в артерію, в паренхіму органу, в інші тканини або шляхом вдихання чи перорально.
Показання до радіонуклідного дослідження визначає лікар, що лікує після консультації з радіологом. Частіше воно проводиться після клінічних, лабораторних та інших променевих досліджень, коли необхідні радіонуклідні дані про функцію та морфологію того чи іншого органу чи системи.
Протипоказань до РНД немає, маються лише обмеження, які передбачені НОРМАМИ РАДІАЦІЙНОЇ БЕЗПЕКИ УКРАЇНИ (НРБУ).
Слайд 10
Радіонукліди отримують за допомогою ядерних реакторів або за допомогою циклотронів і після

їх очищення і визначення питомої активності (вміст радіонукліда в одиниці маси основної речовини), їх в герметично зачинених ампулах в спеціальних захисних контейнерах направляють в радіологічні лабораторії.
Слайд 11Для медичних цілей використовуються не лише "чисті" ізотопи, але і їх хімічні

сполуки з різними речовинами. Тому правомірно називати ці сполуки радіофармацевтичними препаратами (РФП), в молекулі яких міститься радіонуклід і хімічна речовина, які дозволено вводити в організм людини з діагностичною або лікувальною метою.
Радіонуклід повинен випромінювати певний спектр енергії, обумовлювати мінімальне опромінення і відображати стан досліджуваного органу.
Слайд 12Радіонуклідне сканування — метод візуалізації органів і тканин за допомогою введення в організм

РФП. Гамма-випромінювання розподіленого в тілі людини радіонукліда реєструють за допомогою сцинтиляційного детектора, що рухається над тілом. Прилад для радіонуклідного сканування називається сканер.
Слайд 13Залежно від періоду напіврозпаду РФП поліляють на:
- довгоживучі (Т1/2 більше двох тижнів), наприклад 75Se - Т1/2 120 доби.
- короткоживучі (Т1/2 від

однієї години до двох тижнів), наприклад 99mТс - Т1/2 = 6 годин, 32Р - Т1/2 =14,3 доби).
- ультракороткоживущі (Т1/2 від декількох хвилин до декількох годин, наприклад - 15О - Т1/2 =2,03 хв., 11C - Т1/2 = 20,1 хв.).
Слайд 14Фармацевтичні вимоги до рфп:
Хімічна чистота РФП не повинна містити домішок нерадіоактивних речовин

або важких металів, які можуть привести до зміни фармакокінетики РФП або небажаного (шкідливого) впливу на організм.
Радіохімічна чистота - частина радіонукліда в РФП в певній хімічній формі. Наприклад, якщо радіохімічна чистота гіппурана складає 98%, то це означає, що в препараті 98% 131І, зв'язаного з гіппураном. Недостатня радіохімічна чистота РФП може істотно впливати на достовірність отриманих результатів досліджень.
Радіонуклідна чистота – це частина загальної радіоактивності РФП, обумовлена необхідним радіонуклідом. Радіонуклідні домішки можуть бути причиною недостовірності результатів досліджень
Слайд 15Фармацевтичні вимоги до рфп:
Апірогенність (не викликає гарячку) досягають використанням апірогенних технологій при виготовленні

РФП.
Стерильність забезпечується одним із існуючих методів стерилізації РФП: фільтрацією, сухим теплом, парою або радіаційною стерилізацією (опромінюванням)
Радіотоксичність – це ступінь променевої (пошкоджуючої) дії РФП на організм. По ступеню радіаційної безпеки радіонукліди поліляють на 4 групи:
Слайд 16 Група А - особливо високої радіотоксичності (у діагностиці не використовують);
• Група Б

- високої радіотоксичності (131І; 89Sr);
• Група В - середньої радіотоксичності (75Se; 198Au);
• Група Г - низької радіотоксичності (51Cr; 67Ga; 64Cu).
Слайд 17Шляхи введення РФП в організм:
ентеральный
інгаляційний
внутрішньовенний
внутрішньоартеріальний,
в лімфатичні

судини
внутрішньошкірний
підшкірний
в спинномозковий канал.
Слайд 18РФП поділяються на:
Специфічні - з певною вибірковістю накопичення.
Безселективні - без певної вибірковості

накопичення.
Органотропні – що вибірково накопичуються в певному органі.
Туморотропні – що вибірково накопичуються в пухлині (переважно в
злоякісній).
Слайд 19РФП поділяються:
За здатністю проникати або не проникати крізь гематотканинні й мембранні бар'єри:
дифундуючі
недифундуючі

Слайд 20В залежності від характеру накопичення в патологічних осередках радіофармпрепарати поділяються на:
РФП для

позитивної візуалізації патологічних процесів: відбувається патологічна поява або підвищення інтенсивності гамма-випромінювання понад органами, в яких у нормі ці РФП не акумулюються (наприклад, фосфатні комплекси, мічені технецієм (99mTc), депонуються в зоні інфаркту міокарда або мічені аутологічні лейкоцити у вогнищі запалення).
РФП для негативної візуалізації патологічних процесів: ці РФП в нормі активно накопичуються в досліджуваному органі, тому відсутність або зниження їх акумуляції в цьому органі розцінюється як патологія (наприклад, при порушенні коронарного кровотоку на сцінтиграмах міокарда утворюється ділянка відсутності акумуляції 201TI-хлориду, який в нормі активно акумулюється в міокарді завдяки інтенсивній гемоперфузії
Слайд 21Основою радіонуклідної діагностики є вимірювання радіоактивності всього тіла або окремих ділянок, тобто

органів, тканин та біологічного матеріалу, який ми беремо у пацієнта. При цьому вивчаються:
1. Розбавлення РФП. Частіше відбувається в рідких середовищах організму людини. Наприклад, за допомогою принципу розбавлення вимірюється об'єм циркулюючої крові (ОЦК). Чим більший об'єм циркулюючої крові, тим менша буде концентрація в ній РФП.
2. Швидкість переміщення. Наприклад, визначення швидкості венозного кровообігу нижніх кінцівок.
3. Накопичення і виведення. Якщо ми вводимо тропний до органу препарат, то чим кращий кровообіг в ньому, чим краще функціонує орган, тим швидше він захопить цей препарат із крові.
Слайд 224. Розподілення РФП. Цей принцип дає можливість за допомогою
органотропного препарату отримати гамма-топограму

(сканограму, статичну сцинтиграму, емісійну томограму), вивчити топографію органу (місце розташування, розміри, форму, обриси), виявити вогнищеві і дифузні патологічні зміни завдяки нерівномірному розподіленню РФП в ньому.
5. Взаємодія. Принцип використовується частіше при in vitro
діагностиці, який базується на взаємодії (конкурентному сполученні)
шуканих стабільних і аналогічних їм мічених сполук (антигенів) із
специфічною сприймаючою системою - з антитілом.
Слайд 23Види радіонуклідних досліджень:
Динамічні:
з метою вивчення динаміки розподілу РФП в органі
Статичні:
для оцінки просторового

розподілу РФП в тілі або органі хворого
Слайд 241. Статичні дослідження: розраховується ступінь накопичення РФП в тканинах, порівнюються показники ступеня

накопичення в різних ділянках органів, оцінюється рівномірність накопичення всередині органу.
2. Динамічні дослідження: досліджується зміна рівня радіоактивності над досліджуваним органом з наступною побудовою кривих розподілу РФП в залежності від часу (від моменту внутрішньовенної ін'єкції РФП протягом певного часу). Використовуються при дослідженні функції органів: нирок, печінки, жовчовивідних шляхів, щитовидної залози
Слайд 25Показаннями
до динамічного
дослідження є:
Клініко-лабораторні дані про можливе захворювання.
Визначення ступеню порушення функції

органу до початку лікування, в процесі лікування та в катамнезі захворювання.
Вивчення збереженої функції органу, що досліджується.
Частіше для динамічних радіонуклідних досліджень використовується РАДІОГРАФІЯ та ДИНАМІЧНА СЦИНТИГРАФІЯ. Ці дослідження виконують на багатоканальних радіографах (КПРДІ-1, КПРДІ-3, NP-356) або на гамма-камерах з клінічними комп’ютерами.
Слайд 26Показаннями
до статичного
дослідження є:
Зясування топографії внутрішніх органів (діагностика вад або аномалій розвитку).
Діагностика

пухлин та кіст.
Визначення обєму та ступеню ушкодження органу або системи.
Ці дослідження виконують на сканерах або гамма-камерах.
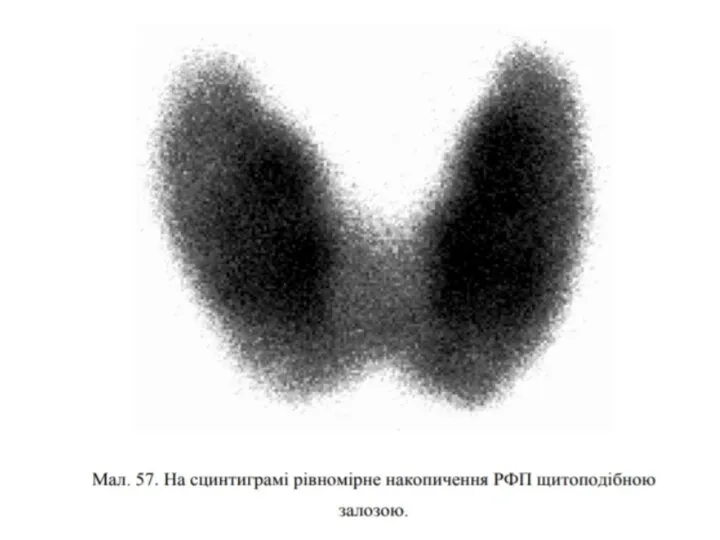
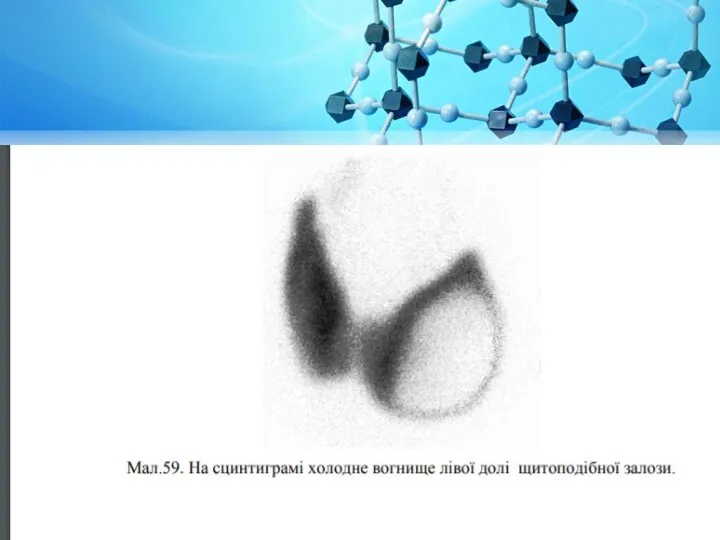
Слайд 27Сцинтиграфія - спосіб радіонуклідної діагностики, що забезпечує отримання зображення органів і тканин

за допомогою реєстрації випромінювання на гамма-камері, що випускається інкорпорованим радіонуклідом. Дає інформацію про топографо-анатомічні характеристики і характер розподілу в досліджуваному біологічному об'єкті РФП.
Слайд 30Однофотонна емісійна комп'ютерна томографія (ОЕКТ).
Ця методика дозволяє отримувати зображення аксіальних зрізів досліджуваного

органу завдяки обертанню детектора гамма-камери навколо досліджуваного об'єкта. Таким чином усувається сумаційний ефект (недолік сцинтиграфії).
При необхідності аксіальні зрізи реконструюються в зображення в інших площинах. Ще однією перевагою ОЕКТ, в порівнянні з планарною сцинтиграфією, є велика роздільна здатність, тобто, є можливість більш детального вивчення особливостей досліджуваного органу.
Слайд 31Показання до ОФЕКТ:
Сумнівне підвищення накопичення РФП, яке недостатнє для інтерпретації природи даної

ділянки (доброякісної або злоякісної) і вимагає уточнення його локалізації.
Розташування ділянки підвищеного накопичення РФП в області суперпозиції кісткових структур.
Велика кількість ділянок ураження кісткової тканини, виявлених на КТ або МРТ.
Необхідність порівняння (зіставлення) з іншими методами візуалізації.
Слайд 32Показання до ОФЕКТ/КТ:
Диференційна діагностика підозрілих невизначених ділянок підвищеного накопичення РФП при стандартній

планарной остеосцинтиграфії в режимі «все тіло» або ОФЕКТ.
Диференційна діагностика доброякісних і злоякісних ділянок підвищеного накопичення РФП в залежності від їх локалізації в структурах кістково-суглобового апарату.
Підозра на наявність м’якотканного компонента при ураженні кісткової тканини.
Підозра на наявність супутніх ускладнень, зокрема патологічних переломів або компресії спинного мозку, які можуть бути виявлені при одному суміщеному дослідженні.
Необхідність проведення біопсії ураженої кісткової тканини.
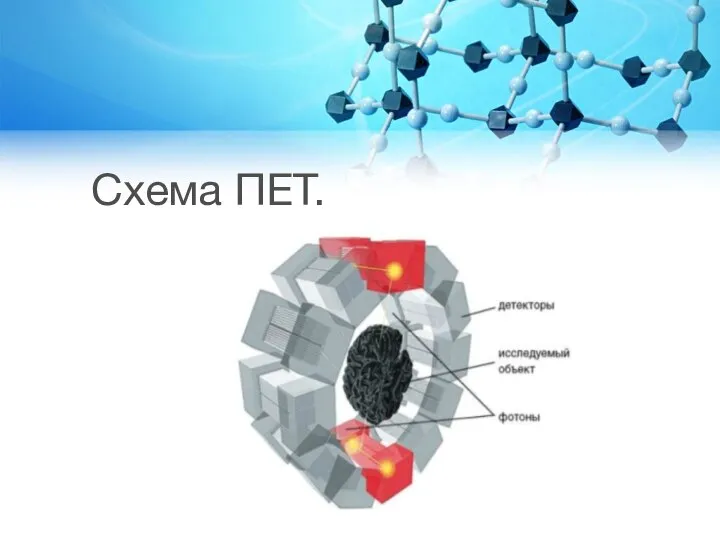
Слайд 33Позитронно-емісійна томографія (ПЕТ)
методика, що передбачає введення в організм людини РФП, які випускають

випромінювання, або позитрони. Кожен РФП-позитрон, що випускається, в організмі людини починає взаємодіяти з найближчим електроном. Позитрони та електрони мають однакову масу, але протилежні електричні заряди, тому виникає їх взаємознищення - анігіляція. При анігіляції відбувається виділення анігіляційних гамма-квантів, що розповсюджуються в протилежних напрямках і уловлюються детекторами.
Слайд 35ПЕТ дозволяє проводити точну кількісну оцінку концентрації радіонуклідів у досліджуваному органі і

може використовуватися для тонкого вивчення метаболічних процесів, що протікають в ньому.
ПЕТ актуальна в діагностиці злоякісних пухлин: в пухлинних клітинах з високим рівнем вуглеводного обміну, які активно метаболізуються, дуже інтенсивно акумулюється 18F-дезоксиглюкоза (метаболічний аналог звичайної глюкози).
Активно застосовується ПЕТ і в кардіології: 18F-дезоксиглюкоза добре включається у вуглеводний обмін міокарда та дозволяє визначити ступінь його життєздатності.
Слайд 36Переваги радіонуклідної діагностики.
В основі рентгенологічного методу, КТ, УЗД, МРТ лежить візуалізація морфологічних

характеристик досліджуваного органу або системи.
Головна перевага радіонуклідних методів у порівнянні з іншими засобами променевої діагностики - можливість отримувати діагностичну інформацію про функціональний стан досліджуваного органа чи біологічної системи.
Ще одна важлива перевага - можливість одномоментного дослідження всього тіла (наприклад, візуалізація всіх метастазів певної пухлини в усіх органах та системах).
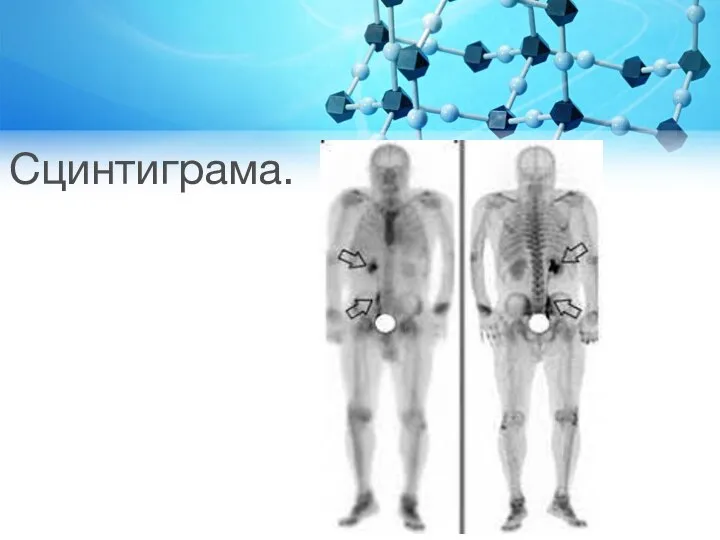
Слайд 40Остеосцинтиграфія
Остеосцинтиграфія – метод радіонуклідної візуалізації кістково-суглобового апарату з використанням остеотропних радіофармпрепаратів (РФП),

призначений для виявлення ділянок патологічного порушення метаболізму кісткової тканини внаслідок деструктивно-репаративних процесів різної етіології.
Метод дозволяє оцінити характер розподілу РФП у кістках скелету і суглобах, виявити ділянки патологічного порушення метаболізму, їх точну локалізацію та природу виникнення
Слайд 41Показання до остеосцинтиграфії
Первинне ураження кісток.
Вторинне (метастатичне) ураження кісток.
Запальні захворювання кісток і суглобів

(остеомієліт, артрити, дисметаболічні артропатії).
Травматичні пошкодження кісткової системи (у тому числі приховані і стрес-переломи)
Болі в хребті, сакроілеїти, диференційна діагностика доброякісного (остеохондроз, патологія міжхребцевих дисків, спондилолістез) і вторинного (злоякісного) ураження.
Слайд 42Показання до остеосцинтиграфії
Оцінка ефективності хіміотерапевтичного, променевого та радіонуклідного лікування.
Наявність больового синдрому невідомої

природи, ймовірно пов’язаного з кістково-суглобовим апаратом.
Визначення життєздатності кісткових трансплантатів.
Виявлення неспроможності та наявності запального процесу (інфікування) в ділянці суглобових протезів
Слайд 43Показання до трьохфазної сцинтиграфії:
1. Запальні захворювання кісток і суглобів (остеомієліт, артрити, дисметаболічні

артропатії).
2. Травматичні пошкодження кісткової системи (в тому числі приховані і стрес-переломи).
3. Визначення життєздатності кісткових трансплантатів.
4. Виявлення неспроможності та наявності запального процесу (інфікування) в ділянці суглобових протезів.






































 Рак молочной железы в Курской области: что изменилось
Рак молочной железы в Курской области: что изменилось Интеллект и интеллектуальная недостаточность
Интеллект и интеллектуальная недостаточность Заболевания органов зрения
Заболевания органов зрения Острые отравления баклофеном
Острые отравления баклофеном Основы учения о лекарствах
Основы учения о лекарствах Анонимные Наркоманы о.САХАЛИН
Анонимные Наркоманы о.САХАЛИН Планирование в деятельности медсестры –руководителя. Распределение ресурсов
Планирование в деятельности медсестры –руководителя. Распределение ресурсов Тканевая гипоксия. Антигипоксанты
Тканевая гипоксия. Антигипоксанты Мобильное приложение “Сопровождение мам”
Мобильное приложение “Сопровождение мам” Гепатит. Факторы риска хронических гепатитов
Гепатит. Факторы риска хронических гепатитов Қатері ісіктердің I-IV кезеңі және TNM бойынша жіктелуі
Қатері ісіктердің I-IV кезеңі және TNM бойынша жіктелуі Современные технологии в косметологии. Редермализация
Современные технологии в косметологии. Редермализация Подводные камни в диагностике легкой ЧМТ. Инновационная технология диагностики травмы головы
Подводные камни в диагностике легкой ЧМТ. Инновационная технология диагностики травмы головы Пародонтоз. Клинический случай
Пародонтоз. Клинический случай Заболевания сердечно-сосудистой системы. Атеросклероз
Заболевания сердечно-сосудистой системы. Атеросклероз Дифференциальная диагностика геморрагических лихорадок КГЛ, Эбола, Денге, Западного Нила, Зика
Дифференциальная диагностика геморрагических лихорадок КГЛ, Эбола, Денге, Западного Нила, Зика Новая коронавирусная инфекция COVID-19
Новая коронавирусная инфекция COVID-19 Массаж головы
Массаж головы Основы шва нерва
Основы шва нерва Польза и вред вакцинации
Польза и вред вакцинации ДЕТСКИЙ КОНСУЛЬТАТИВНО-ДИАГНОСТИЧЕСКИЙ ЦЕНТР ФГУ НМХЦ ИМ. Н.И.ПИРОГОВА РОСЗДРАВА КАФЕДРА СОЦИАЛЬНОЙ ПЕДИАТРИИ института усоверш
ДЕТСКИЙ КОНСУЛЬТАТИВНО-ДИАГНОСТИЧЕСКИЙ ЦЕНТР ФГУ НМХЦ ИМ. Н.И.ПИРОГОВА РОСЗДРАВА КАФЕДРА СОЦИАЛЬНОЙ ПЕДИАТРИИ института усоверш виды медицинских осмотров их организация и проведение
виды медицинских осмотров их организация и проведение Физиология сердечного сокращения
Физиология сердечного сокращения Биохимическая роль витамина В12. Вопросы обеспеченности организма
Биохимическая роль витамина В12. Вопросы обеспеченности организма Эпидемиология,профилактика и эпидемиологический надзор полиомиелита
Эпидемиология,профилактика и эпидемиологический надзор полиомиелита Биологически активные добавки (БАД) к пище Vital Fucoidan
Биологически активные добавки (БАД) к пище Vital Fucoidan Физиологические и патологические изгибы позвоночного столба
Физиологические и патологические изгибы позвоночного столба Основні принципи натуропатичної медицини. Використання продукції “VIVASAN”
Основні принципи натуропатичної медицини. Використання продукції “VIVASAN”