Содержание
- 2. Фармаконадзор (англ. Pharmacovigilance) вид деятельности, направленный на: 2020 Выявление Оценку Понимание Предотвращение нежелательных последствий применения лекарственных
- 3. ИСТОРИЯ ФАРМАКОНАДЗОРА
- 4. История фармаконадзора-1 2020 ХЛОРОФОРМ Пятнадцатилетняя девушка (Ханна Гринер) умерла после применения анестетика (хлороформа) перед удалением ногтя
- 5. История фармаконадзора - 2 2020 1938 1964 1967 1968 2001 2019 МЕТОД «ЖЕЛТОЙ КАРТЫ» «Желтая карта»
- 6. ЗАКОНОДАТЕЛЬНАЯ БАЗА
- 7. Фармаконадзор. Законодательная база - 1. 2020 1848 197 1938 1938 1961 GVP EAЭC Решение № 87
- 8. Фармаконадзор. Законодательная база - 2. 2020 1848 Что должна делать фармкомпания в соответствии с законодательством (выдержки
- 9. Ответственность за безопасность лекарственных средств несет держатель регистрационного удостоверения! Минздрав? Пациент? Врач? Как вы думаете, кто
- 10. ФАРМАКОНАДЗОР в ФАРМКОМПАНИИ
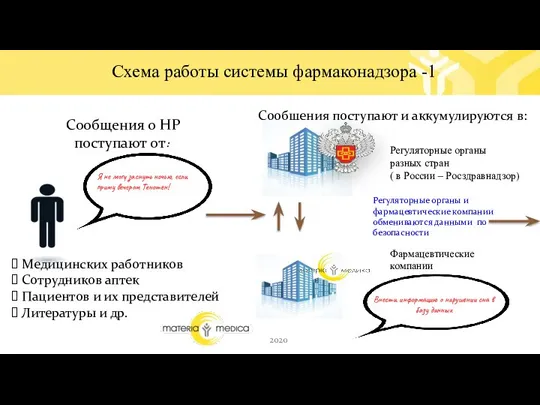
- 11. Сообщения о НР поступают от: Медицинских работников Сотрудников аптек Пациентов и их представителей Литературы и др.
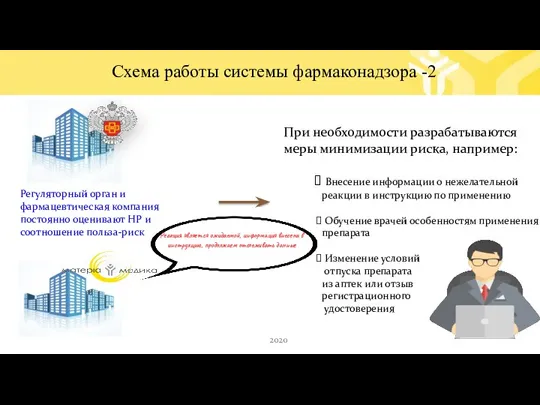
- 12. Регуляторный орган и фармацевтическая компания постоянно оценивают НР и соотношение польза-риск При необходимости разрабатываются меры минимизации
- 13. -Обеспечение рационального и безопасного использования лекарственных средств -Оценка соотношения риска и пользы применения лекарственных средств -Обучение
- 14. 2018 ФАРМАКОНАДЗОР СЕГОДНЯ
- 15. Фармаконадзор сегодня 2020 Глобальные электронные базы данных, содержащие сообщения из разных стран и непрерывно анализирующие данные,
- 16. Примеры переоценки соотношения польза/риск с течением времени 2020 1848 197 1938 1938 1961 Биопарокс (МНН-фузафунгин, Лаборатория
- 17. Последствия ненадлежащей работы системы фармаконадзора для компании (примеры) Истец Николас Мюррей в своей исковой жалобе сообщал,
- 18. Последствия ненадлежащей работы системы фармаконадзора для компании (примеры) Росздравнадзор информирует о приостановлении применения лекарственных средств производства
- 19. Последствия работы системы фармаконадзора для компании (пример) Испытание вакцины от COVID-19: испытания вакцины производства компании AstraZeneca
- 20. Последствия работы системы фармаконадзора регуляторных органов для компании (пример) FDA потребовала изменить маркировку нестероидных противовоспалительных препаратов
- 21. ОСНОВНЫЕ ПОЛОЖЕНИЯ ФН (ЧТО НУЖНО ЗНАТЬ)
- 22. Какие события надо передавать в службу ФН? Неблагоприятные симптомы (нежелательные реакции) Клинически значимые отклонения в лабораторных
- 23. Минимальная объективная информация о НР должна включать следующие данные (4 минимальные критерия): 1. Название подозреваемого ЛС
- 24. Ожидаемые и неожидаемые НР 2020 1848 197 1938 1938 1961 Нежелательные реакции Ожидаемые Указаны в инструкции
- 25. Серьезные и несерьезные НР 2019 1848 197 1938 1938 1961 Нежелательные реакции Серьезные 1. Смерть или
- 26. Извещение о нежелательной реакции/другой проблеме безопасности 2020
- 27. Сообщение о НР должно быть отправлено в службу фармаконадзора компании ММХ В ТЕЧЕНИЕ 24 ЧАСОВ (НЕ
- 28. Не забудьте! Сообщайте не только о НР, произошедших у людей, но и у животных (при приеме
- 29. Куда передавать? Контактная информация службы фармаконадзора : Адрес: Россия, 129272 Москва, ул. Трифоновская, д.47, стр.1 E-mail:
- 30. Чем занимается Служба фармаконадзора ММХ
- 31. Координация работы Уполномоченных лиц по фармаконадору всех стран маркетирования препаратов ММХ 2018 ММХ РФ Украина Армения
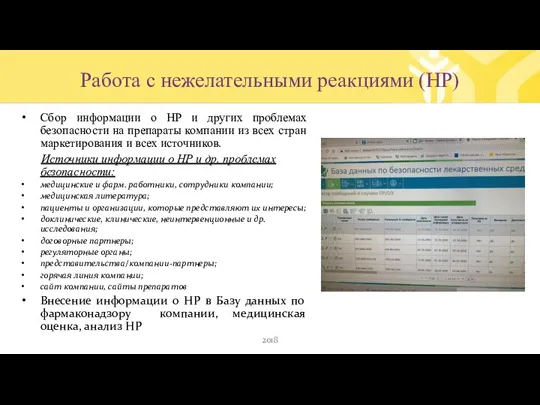
- 32. Работа с нежелательными реакциями (НР) Сбор информации о НР и других проблемах безопасности на препараты компании
- 33. Поддержка препаратов компании на рынках стран маркетирования после регистрации Разработка документов, содержащих ключевую информацию по эффективности
- 34. Развитие компании – развитие СФН 1. Новые препараты 2. Новые страны Ветеринарные препараты 4. Воспроизведенные ЛС
- 36. Скачать презентацию






























 Патологии курения
Патологии курения Биохимия хрящевой и костной тканей
Биохимия хрящевой и костной тканей Хронический панкреатит
Хронический панкреатит Обучение слушателей по программе Оказание первой доврачебной помощи на кафедре семейной медицины и поликлинической терапии
Обучение слушателей по программе Оказание первой доврачебной помощи на кафедре семейной медицины и поликлинической терапии Атеросклероз. Клинические проявления атеросклероза
Атеросклероз. Клинические проявления атеросклероза МАГАТЭ
МАГАТЭ Тест по теме: Эндокринная система
Тест по теме: Эндокринная система Дельфинотерапия және Фелинотерапия
Дельфинотерапия және Фелинотерапия Тенденция развития ВИЧ-инфекции в России и Брянской области
Тенденция развития ВИЧ-инфекции в России и Брянской области Современная тройная терапия препаратом Дескови®
Современная тройная терапия препаратом Дескови® Важность покрытия имплантата в стоматологии
Важность покрытия имплантата в стоматологии ГИГИЕНА ПИТАНИЯ В МУНИЦИПАЛЬНОМ КАЗЕННОМ ДОШКОЛЬНОМ ОБРАЗОВАТЕЛЬНОМ УЧРЕЖДЕНИИ
ГИГИЕНА ПИТАНИЯ В МУНИЦИПАЛЬНОМ КАЗЕННОМ ДОШКОЛЬНОМ ОБРАЗОВАТЕЛЬНОМ УЧРЕЖДЕНИИ Лабораторная диагностика при вторичных иммунодефицитах
Лабораторная диагностика при вторичных иммунодефицитах Инструкция пользователя по работе на портале непрерывного медицинского и фармацевтического образования
Инструкция пользователя по работе на портале непрерывного медицинского и фармацевтического образования Тема №8
Тема №8 Здравоохранение Тульской области. Работа в перинатальном центре
Здравоохранение Тульской области. Работа в перинатальном центре Медициналық мекемелер 2 ге бөлінеді. Амбулаториялық. Статционарлық
Медициналық мекемелер 2 ге бөлінеді. Амбулаториялық. Статционарлық Вирус полиомиелита
Вирус полиомиелита Роль прионов в развитии нейродегенеративных заболеваний
Роль прионов в развитии нейродегенеративных заболеваний Артериальные доступы в рентгенохирургии. Методы гемостаза
Артериальные доступы в рентгенохирургии. Методы гемостаза Статистика смертности от инфаркта миокарда
Статистика смертности от инфаркта миокарда Использование тренажёра В. Ф. Базарного в образовательном процессе при работе с детьми с НОДА
Использование тренажёра В. Ф. Базарного в образовательном процессе при работе с детьми с НОДА Цистаденома и опухолевидные образования
Цистаденома и опухолевидные образования Обучение в сестринском деле, как неотъемлемая часть медико-социального ухода
Обучение в сестринском деле, как неотъемлемая часть медико-социального ухода Физиология и основные нарушения деятельности ЖВС
Физиология и основные нарушения деятельности ЖВС Хронический гнойный средний отит
Хронический гнойный средний отит Зәрдің физикалық қасиеттері бойынша статистикалық мәліметтер
Зәрдің физикалық қасиеттері бойынша статистикалық мәліметтер mestnye_anestetiki
mestnye_anestetiki