Содержание
- 2. Түзілу энтальпиясы – 1 моль күрделі зат жай заттардан түзілгенде бөлінетін немесе сіңірілетін жылу мөлшері 4Р(қ)+5О2(г)=2P2O5(қ)+3010
- 3. Гесс заңы- химиялық реакцияның жылу эффектісі оның жүру жолына тәуелсіз, өнім мен реагенттердің энергетикалық күйлерінің айырмасымен
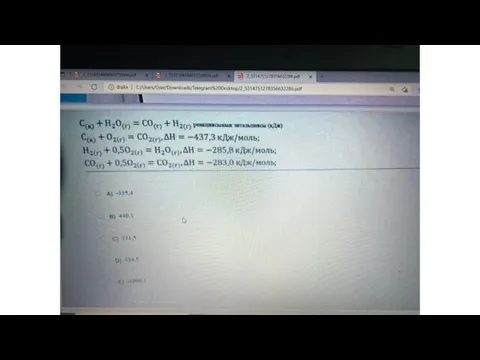
- 4. Гесс заңының 1- салдарына есеп 2С6Н6+15 О2=12СО2+6Н2О -82,9 0 -393,5 -241,8 кДж/моль ∆Н-? ∑(∆H0)=12*(-393,5)+6*(-241,8)-2*(-82,9)+15*0=(-40722-1450,8)-165,8=-6007 кДж ΔHх.р=-6007
- 6. Гесс заңының 1- салдарына №2- есеп Фосфин жанғанда фосфор ангидриді мен су түзіледі. Сонымен қатар 2452,8
- 7. Гесс заңының 3- салдары СН4+2О2=CO2+2H2O C мен С , Н2 мен Н2 қысқарады. ΔHх.р=74,85+ (-393,51+ (-483,62)=
- 8. Гесс заңының 3- салдарына мысал H2S=S+H2 ΔH4=+20,17 KДж H2+0,5O2= H2O ΔH2=-286,0 Кдж S+O2=SO2 ΔH3=-297,0 кДж H2S+1,5O2=H2O+SO2
- 10. Мысал№1 Берілгені: 1) 2H2O → 2H2+O2 ΔН1=-572 кДж 2) *(-1) 2HF → H2+F2 ΔН2=-542 кДж __________________________________
- 11. Шешуі: 2H2O → 2H2+O2 ΔН1=-572 кДж 2H2+2 F2→4HF ΔН2=1084 кДж __________________________________ 2H2O +2F2→4HF + O2 ΔHжалпы=ΔH1+ΔH2
- 12. Мысал№2 Берілгені: С (қ) + О2 (г) = СО2(г) ΔН1=-393,5 кДж СО(г) + 1/2 О2 (г)
- 13. Шешуі: С (қ) + О2 (г) = СО2(г) ΔН1=-393,5 кДж СО2(г) →СО(г) + 1/2 О2 (г)
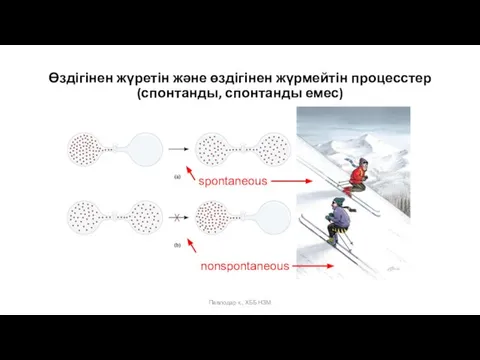
- 14. Суреттерді не байланыстырады?
- 15. Павлодар қ., ХББ НЗМ Суреттерді не байланыстырады?
- 16. «Ретсіздік»
- 17. Өздігінен жүретін және өздігінен жүре алмайтын құбылыстар бар (мысалдар келтіріңіздер). Өздігінен жүретін процесстер (спонтанды) – сыртқы
- 18. Павлодар қ., ХББ НЗМ Өздігінен жүретін және өздігінен жүрмейтін процесстер (спонтанды, спонтанды емес)
- 19. Спонтанды (өздігінен жүретін) процесстер Спонтанды емес (өздігінен жүрмейтін) процесстер 5. Электролиттердің сулы ерітіндіде иондарға ыдырауы: 4.
- 20. Процесстің спонтанды болатын/болмайтындығын қалай анықтауға болады? Ол тек энтальпиялық факторға тәуелді ме? Бертло -Томсен принципі (19
- 21. Спонтанды жүретін процесстердің кейбір мысалдары (энтальпия мәндері) Павлодар қ., ХББ НЗМ
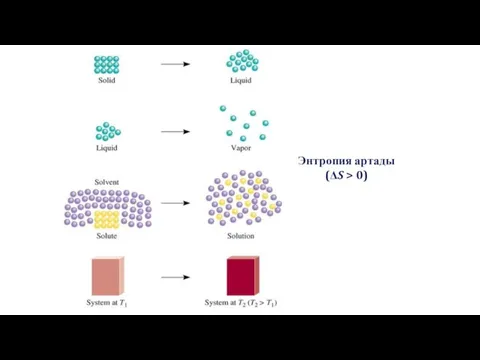
- 22. Павлодар қ., ХББ НЗМ Энтропия 1865 жылы Рудольф Клаузиус алғашқы рет осы түсінікті енгізген. Реттілігі жоғары
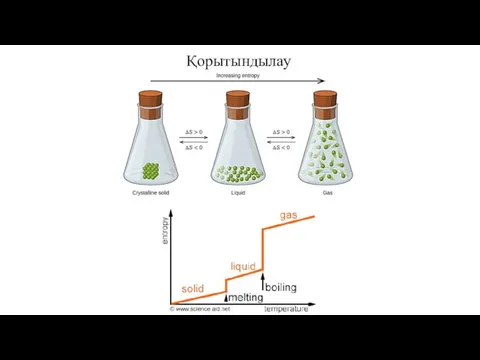
- 23. Энтропия артады (ΔS > 0)
- 24. Павлодар қ., ХББ НЗМ 1-тапсырма Әрбір жұптан энтропиясы жоғары болатын жүйені анықтаңыз. Дұрыс жауап
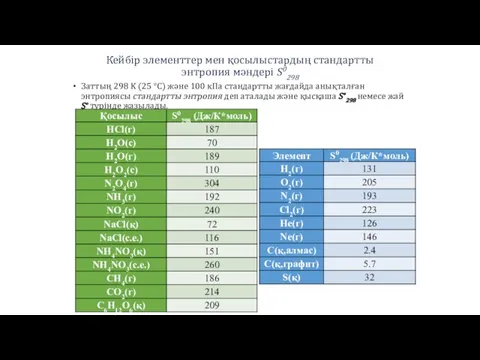
- 25. Кейбір элементтер мен қосылыстардың стандартты энтропия мәндері S0298 Заттың 298 K (25 °C) және 100 кПа
- 26. Химиялық реакцияның стандартты энтропия өзгерісін есептеу Павлодар қ., ХББ НЗМ ΔS0реак – реакцияның стандартты энтропия өзгерісі
- 27. Энтропия Термодинамикалық жабық жүйеде энтропия өздігінен жүретін процесстердің жүру бағытын сипаттайды. Клаузиус теңсіздігі Қайтымды үрдістер үшін
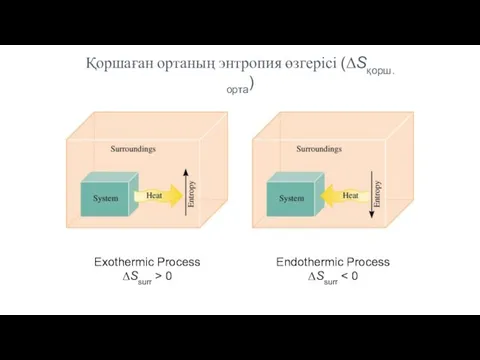
- 28. Exothermic Process ΔSsurr > 0 Endothermic Process ΔSsurr Қоршаған ортаның энтропия өзгерісі (ΔSқорш.орта)
- 29. Қоршаған ортаның энтропия өзгерісі. Жалпы энтропия өзгерісі. Павлодар қ., ХББ НЗМ Егер жүйе мен қоршаған ортаның
- 30. Жүйенің ΔH және ΔS мәндері нені білдіреді?
- 31. Қайтымды химиялық процесстер Қайтымсыз химиялық процесстер 2H2 + O2 ⇄ 2H2O; ΔН N2O4 ⇄ 2 NO2
- 32. Қорытындылау
- 33. Гиббстің еркін энергиясы-G бұл максимал жұмысты орындау үшін қолданылатын жүйенің жалпы энергиясының бір бөлігі. Ол изобаралық-изотермиялық
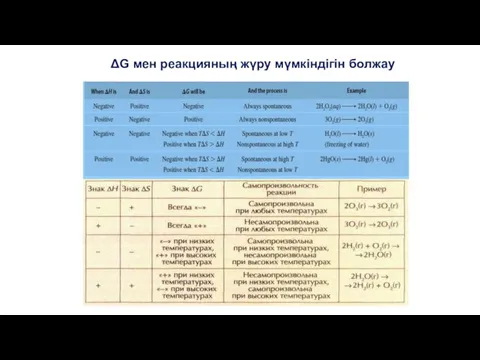
- 34. ΔG мен реакцияның жүру мүмкіндігін болжау
- 35. Гиббс энергиясын есептеу ΔG0 – күй функциясы: ΔG0реакция = Σ ni·G0түз (өнім) - Σ nj·G0түз (реагенттер)
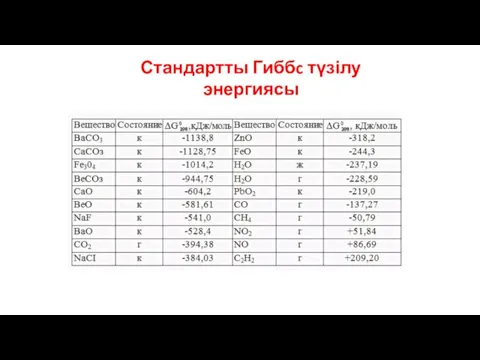
- 36. Стандартты Гиббc түзілу энергиясы Стандартты Гиббc түзілу энергиясы (?G°түз.298) - стандартты жағдайда 1 моль зат өзін
- 37. Стандартты Гиббc түзілу энергиясы
- 38. Мысал 1. Ацетиленнің жану реакциясы: С2Н2 (г) + 5/2О2 (г) = 2СО2 (г) + Н2О (ж)
- 39. Мысал 2. Берілген процесс үшін энтальпия, энтропия және Гиббс энергиясының өзгерісін есептеңіз, түсіндіріңіз : Сu2S(к) +
- 41. Скачать презентацию






























 Як взяти емоції під контроль і діяти відповідно головної мети
Як взяти емоції під контроль і діяти відповідно головної мети Искусственный интеллект в медицине
Искусственный интеллект в медицине СРС: Хламидиоз у детей
СРС: Хламидиоз у детей Гипертонические препараты
Гипертонические препараты Лекция_10
Лекция_10 Сексологія. Контрацепція
Сексологія. Контрацепція Медбикелік істе эмпатиялық қабілеттің маңызы
Медбикелік істе эмпатиялық қабілеттің маңызы Диагностика протокола и гастродуоденитного лечения
Диагностика протокола и гастродуоденитного лечения Психоэмоциональные свойства эфирных масел
Психоэмоциональные свойства эфирных масел Аномалии конституции у детей
Аномалии конституции у детей Узлы в хирургии
Узлы в хирургии Щитовидная железа. Данные исследования в патологии и их диагностическое значение
Щитовидная железа. Данные исследования в патологии и их диагностическое значение Хроническая почечная недостаточность
Хроническая почечная недостаточность Острые нарушения мозгового кровообращения
Острые нарушения мозгового кровообращения Определение интеллект
Определение интеллект Эпидемический паротит
Эпидемический паротит Энтеровирусты инфекция қоздырғыштары
Энтеровирусты инфекция қоздырғыштары Фебрильді синдроммен болатын жұқпалы ауруларды диагностикалау алгоритмі. Безгек, бруцеллез. Ку риккетсиозы
Фебрильді синдроммен болатын жұқпалы ауруларды диагностикалау алгоритмі. Безгек, бруцеллез. Ку риккетсиозы История медицины как наука
История медицины как наука Миокард инфаркты кезіндегі клиникалық
Миокард инфаркты кезіндегі клиникалық Лечение язвенной болезни
Лечение язвенной болезни Гирудотерапия – кладовая здоровья
Гирудотерапия – кладовая здоровья Назо-орбито-этмоидальные переломы
Назо-орбито-этмоидальные переломы Основы тиреоидологии. Анатомия и эмбриогенез щитовидной железы
Основы тиреоидологии. Анатомия и эмбриогенез щитовидной железы Памятка Как правильно собирать лекарственные растения
Памятка Как правильно собирать лекарственные растения Порог готовности платить
Порог готовности платить Методы определения срока беремености и предполагаемой даты родов
Методы определения срока беремености и предполагаемой даты родов Гигиена опорно-двигательной системы
Гигиена опорно-двигательной системы