Влияние ядерной ДНК на механизмы возникновения дефектов в митохондриальной днк: миделеции (точечные мутации) мтднк,
Содержание
- 2. ЦЕЛЬ, АКТУАЛЬНОСТЬ, ЗАДАЧИ Актуальность: митохондриальные болезни составляют большую группу патологических состояний, связанных с генетически детерминированными нарушениями
- 3. Строение митохондриальной ДНК СТРОЕНИЕ МИТОХОНДРИАЛЬНОЙ ДНК Митохондрии произошли от древних симбиотических бактерий, которые жили внутри примитивных
- 4. Сравнение строения митохондриальной и ядерной ДНК ПРОИСХОЖДЕНИЕ И ДЕГРАДАЦИЯ МИТОХОНДРИАЛЬНОГО ГЕНОМА В ходе коэволюции оказалось, что
- 5. СРАВНЕНИЕ МИТОХОНДРИАЛЬНОЙ И ЯДЕРНОЙ ДНК
- 6. СРАВНЕНИЕ МИТОХОНДРИАЛЬНОЙ И ЯДЕРНОЙ ДНК
- 7. МИТОХОНДРИАЛЬНАЯ ДНК ПОД КОНТРОЛЕМ ЯДЕРНОЙ Известно, что синтез мтДНК находится под контролем ядерных генов. Мутации в
- 8. КЛАССИФИКАЦИЯ ПО ПАТОГЕНЕЗУ Митохондриальные заболевания являются результатом унаследованных и/или спонтанных мутаций в митохондриальной ДНК (мтДНК) и/или
- 9. КЛАССИФИКАЦИЯ ПО ЭТИОЛОГИИ Митохондриальные болезни, обусловленные генными мутациями ядерной ДНК Митохондриальные болезни, в основе которых лежат
- 10. ФЕНОТИПЫ ЯДЕРНО-КОДИРУЕМЫХ МИТОХОНДРИАЛЬНЫХ ЗАБОЛЕВАНИЙ
- 11. МИТОХОНДРИАЛЬНЫЕ СИНДРОМЫ, КОДИРУЕМЫЕ ЯДЕРНЫМИ ГЕНАМИ
- 12. ТОЧЕЧНЫЕ МУТАЦИИ МИТОХОНДРИАЛЬНОЙ ДНК В основе патогенеза синдрома MELAS лежат точечные мутации мтДНК, преимущественно генов транспортных
- 13. Атрофия зрительного нерва ДЕЛЕЦИИ МИТОХОНДРИАЛЬНОЙ ДНК, НАСЛЕДУЕМЫЕ ПО АУТОСОМНО-РЕЦЕССИВНОМУ ТИПУ Течение заболевания в виде митохондриальной энцефаломиопатии
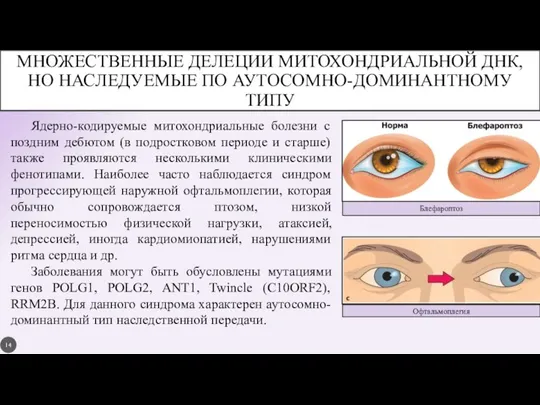
- 14. Офтальмоплегия Блефароптоз МНОЖЕСТВЕННЫЕ ДЕЛЕЦИИ МИТОХОНДРИАЛЬНОЙ ДНК, НО НАСЛЕДУЕМЫЕ ПО АУТОСОМНО-ДОМИНАНТНОМУ ТИПУ Ядерно-кодируемые митохондриальные болезни с поздним
- 15. ЗАКЛЮЧЕНИЕ Несмотря на небольшой размер, митохондриальный геном отвечает за правильное функционирование электростанций наших клеток. Этот кольцевой
- 16. СПИСОК ЛИТЕРАТУРЫ Harbauer, A.B., Zahedi, R.P., Sickmann, A., Pfanner, N., and Meisinger, C. (2014) The protein
- 18. Скачать презентацию














 Лечение заболеваний твердых тканей зуба
Лечение заболеваний твердых тканей зуба Мұнай өнімдерінің (бензол,толуол) теріге әсері
Мұнай өнімдерінің (бензол,толуол) теріге әсері Лекция – хирургия (доброкачественные заболевания щитовидной железы)
Лекция – хирургия (доброкачественные заболевания щитовидной железы) Физкультминутка для глаз
Физкультминутка для глаз Опухоль Вилмса
Опухоль Вилмса Добавочный скелет. Соединение костей
Добавочный скелет. Соединение костей Памятка по профилактике COVID-19
Памятка по профилактике COVID-19 Редкие виды расстройств пищевого поведения
Редкие виды расстройств пищевого поведения Дорсопатии
Дорсопатии Гинекологиядағы тексеру әдістері
Гинекологиядағы тексеру әдістері Фармакологія холіно- і адренотропних засобів (лекція №2)
Фармакологія холіно- і адренотропних засобів (лекція №2) Выявление информативных параметров сигналов электронной аускультации для определения характера шумов дыхания
Выявление информативных параметров сигналов электронной аускультации для определения характера шумов дыхания Железодефицитная анемия
Железодефицитная анемия Сердечная астма. Сердечные отеки
Сердечная астма. Сердечные отеки Лікарські засоби, що регулюють функції центральної нервової системи
Лікарські засоби, що регулюють функції центральної нервової системи Озоновый слой (медицинский подход)
Озоновый слой (медицинский подход) Гипергликемия. Что такое гипергликемия?
Гипергликемия. Что такое гипергликемия? Неэпителиальные опухоли ЖКТ
Неэпителиальные опухоли ЖКТ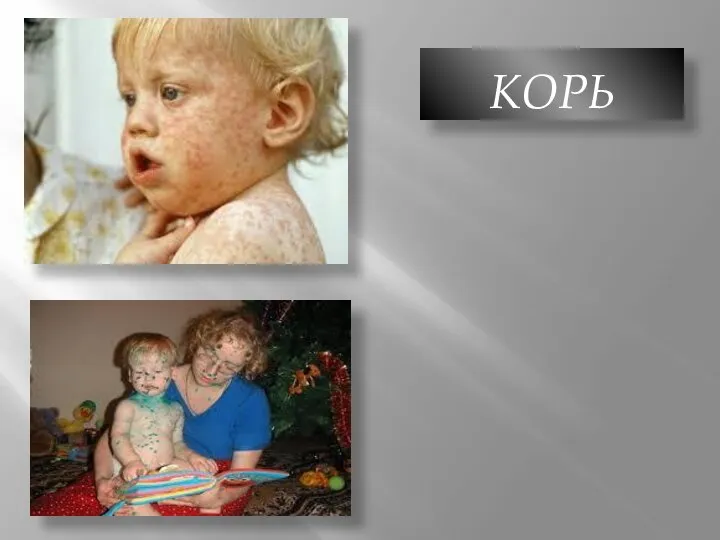 Корь. Симптомы. Инкубация
Корь. Симптомы. Инкубация СРС: Хламидиоз у детей
СРС: Хламидиоз у детей Правила остановки артериального кровотечения 2
Правила остановки артериального кровотечения 2 Правила хранения лекарственных препаратов класса А и Б
Правила хранения лекарственных препаратов класса А и Б Емдеу – алдын алу. Мекемелеріндегі инфекциялық бақылау
Емдеу – алдын алу. Мекемелеріндегі инфекциялық бақылау Висцеральный лейшманиоз
Висцеральный лейшманиоз ЗСН – застойная сердечная недостаточность
ЗСН – застойная сердечная недостаточность Род - шигеллы
Род - шигеллы Острое нарушение мозгового кровообращения
Острое нарушение мозгового кровообращения Наномедицина. Наномедицинаның қолдану аясы
Наномедицина. Наномедицинаның қолдану аясы