Слайд 2ВПС определение
Врожденный порок сердца является структурной аномалией сердца или внутригрудных отделов

магистральных сосудов, что практически и потенциально приводит к функциональным нарушениям ( S.C.Mitchel, 1971).
Врожденный порок сердца – анатомическая деформация сердца или крупных сосудов, развивающаяся внутриутробно, вне зависимости от того, когда она была обнаружена.
Слайд 3ВПС определение
Врожденные пороки сердца - это аномалии морфологического развития сердца, его клапанного

аппарата и магистральных сосудов, возникшие на 2-8-й неделе внутриутробного развития в результате нарушения процессов эмбриогенеза. Эти дефекты могут встречаться изолированно или в сочетании друг с другом (Федеральные клинические рекомендации).
Слайд 4Кодирование ВПС по МКБ-10
Q20-Q26 ВРОЖДЕННЫЕ АНОМАЛИИ [ПОРОКИ РАЗВИТИЯ] СИСТЕМЫ КРОВООБРАЩЕНИЯ
Врожденные аномалии
![Кодирование ВПС по МКБ-10 Q20-Q26 ВРОЖДЕННЫЕ АНОМАЛИИ [ПОРОКИ РАЗВИТИЯ] СИСТЕМЫ КРОВООБРАЩЕНИЯ Врожденные](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1148610/slide-3.jpg)
[пороки развития] сердечных камер и соединений (Q20) Q20.9
Врожденные аномалии [пороки развития] сердечной перегородки (Q21) Врожденные аномалии [пороки развития] легочного и трехстворчатого клапанов (Q22)
Врожденные аномалии [пороки развития] аортального и митрального клапанов (Q23)
Другие врожденные аномалии [пороки развития] сердца (Q24)
Врожденные аномалии [пороки развития] крупных артерий (Q25)
Слайд 5Распространенность впс
Распространенность ВПС и крупных сосудов по данным официальной статистики в различных

регионах РФ составляет 3,17-8,0 на 1000 новорожденных.
В структуре сердечно-сосудистой патологии у детей раннего возраста ВПС занимают одно из ведущих мест (34%).
ВПС в структуре ВПР в нашей стране занимают 1-2 место и конкурируют с пороками костно – мышечной системы и опорно - двигательного аппарата.
Слайд 6Распространенность впс
По данным Hoffman J.I.E., Kaplan S. распространенность ВПС в США

колеблется от 4 до 50 случаев на 1000 новорожденных.
Показатели распространенности ВПС у детей варьируют в связи с разницей в критериях их оценки и увеличиваются при учете детей с малыми ВПС. Так в США распространенность ВПС составляет; 19 на 1000новорожденных - при учете 2-х створчатого аортального клапана; 75 на 1000 – при учете мышечных дефектов ДМЖП.
Слайд 7Распространенность впс
Имеется тенденция роста распространенности ВПС и ВПР как в нашей стране,

так и за рубежом. Растет число тяжелых и сложных пороков в общей структуре ВПС.
25-40% ВПС сочетаются с другими аномалиями развития, 30% детей с хромосомными аномалиями имеют ВПС.
Число взрослых с ВПС в мире растет примерно на 5 % в год и в 2005 году превысило 1 миллион.
Слайд 8Наиболее часто встречающиеся впс
ДМЖП – 20-30 % всех случаев ВПС,
ДМПП- 2,5-16%,
ОАП -6-18%,
Тетрада

Фалло -5-10%,
Коарктация аорты-5%,
Стеноз аорты- 5%,
Стеноз легочной артерии-10%,
Транспозиция крупных магистральных сосудов-5%.
Слайд 9Критические периоды морфогенеза сердца
Концепция критических периодов онтогенеза, характеризующихся повышенной чувствительностью организма к

действию внешних и внутренних раздражителей, разработана Г.Светловым(1960).
Выделено 2 критических периода: I совпадает с процессом имплантации оплодотворенной яйцеклетки, II – со временем формирования плаценты. Большинство эмбриологов считает критическим возраст с 14 (20, 28) дней от овуляции до 41 (50, 60) дня конкретно для сердечно-сосудистой системы эмбриона человека.
Данные критические периоды были практически подтверждены в исследованиях Pliess (1962) и Kreipe (1967) на примере тератогенного воздействия талидомида.
Слайд 10Этиология ВПС
В этиологии ВПС имеют значение три группы факторов (факторы риска рождения

ребенка с ВПС).
1. Первичные генетические факторы: количественные и структурные хромосомные аномалии — 5% , мутации единичного гена — 2-3,5
Слайд 11Этиология ВПС
2. Тератогенные факторы внешней среды
Особенно опасно их воздействие на плод в

критические периоды от 2-3 до 8-12 недель гестации. Причина 3-5% ВПС
Внутриутробные инфекции (вирус краснухи, ЦМВ, вирусы Коксаки, вирусы гриппа и др.)
Прием беременной женщиной лекарственных препаратов (антагонисты фолиевой кислоты, препараты лития, амфетамины, прогестины и др.)
Употребление алкоголя;
Контакты с токсическими веществами (кислоты, спирты, тяжелые металлы и др.)
Неблагоприятные экологические факторы (ионизирующая радиация, загрязнение воды, почвы, воздуха мутагенными веществами и т. п.)
Дефицит питания матери на ранних сроках беременности.
Возраст родителей • заболевания и состояния самой матери (сахарный диабет, метаболические нарушения, тяжелый токсикоз первой половины беременности, заболевания сердечно-сосудистой системы).
Слайд 12Этиология ВПС
3. Взаимодействие генетических факторов и неблагоприятных факторов внешней среды (мультифакториальное наследование)

– 90 %.
Средовые факторы выступают как «провоцирующие» для «проявления» наследственной предрасположенности.
Риск мультифакториального заболевания выше у родственников первого порядка, чем у родственников второго порядка. У родственников четвертого поколения риск практически равен общепопуляционному.
Слайд 13Этиология ВПС
Возвратный риск для родственников первого поколения равен корню квадратному из показателя

популяционной частоты выявления данного заболевания. Риск повторного рождения ребенка с ВПС у родителей, уже имеющих ребенка с такой патологией составляет 1-5%. Возвратный риск ВПС при двух больных детях в семье составляет 10%.
Слайд 14Этиология ВПС
Расчет риска возникновения ВПС у детей ведется на количество беременных, подвергшихся

действию факторов риска, а не на количество новорожденных в исследуемой популяции.
При проведении оценки необходимо помнить, что риск для будущего популяции в эпидемиологическом отношении, даже если относительный риск конкретного заболевания высокий, может быть незначительным, если заболевание очень редкое.
На практике обычно используется показатель относительного риска (ОР). Он считается достоверным, если равен или превышает 2.
Слайд 15Этиология ВПС
Тератогенное воздействие на формирование ВПС оказывают: химические, физические и биологические факторы.

Известно более 100 000 токсических субстанций, которые могут оказать тератогенное воздействие на плод и нарушить эмбриогенез (кардиогенез).
Химические тератогены подразделяются на лекарственные и индустриальные.
Слайд 16Этиология ВПС
К лекарственным тератогенам с высоким ОР развития ВПС относятся:
-антиконвульсанты (вольпроевая кислота-

ОР 18,4; карбамазепин - ОР 43,4 и др);
-индометацин -ОР 73,5;
-женские половые гормоны- ОР 2,7;
-салицилаты - ОР 6,6;
- препараты лития - ОР 10,3;
-витамин А и его передозировка - ОР 34,3 и многие другие лекарственные перпараты.
К химическим индустриальным тератогенам относятся :
гербициды (ОР 58,8); мышьяк, свинец, хлорсодержащие соединения, кадмий, лаки, краски и др.
Слайд 17Этиология ВПС
Биологические факторы :
заболевания матери (эпилепсия, сахарный диабет, фенилкетонурия гипертоническая болезнь, метаболические

нарушения и др.);
возраст родителей; -
прием кокаина и курение марихуаны отцом ребенка,
злоупотребление беременной алкоголем (ОР = 47,4);
внутриутробные вирусные и бактериальные инфекции( краснуха, герпес 1 и 2 типа, ЦМВ, токсоплазмоз, сифилис и др.).
Физические факторы: радиация, шум более 82 дБ, вибрация, электромагнитное и рентгеновское излучения и др.
Слайд 18 Классификация ВПС
Существует более 90 вариантов ВПС и множество их сочетаний.

ВПС -групповое понятие, что создает трудности при их классификации.
Впервые ВОЗ была принята классификация болезней сердца у детей в 1970 году в Гронингене (Нидерланды), затем в 1976 году в Женеве была пересмотрена и дополнена. Данная классификация содержит раздел «Врожденные аномалии (пороки развития)» с рубриками «Аномалии луковицы сердца и аномалии закрытия сердечной перегородки», «Другие врожденные аномалии сердца», «Другие врожденные аномалии системы кровообращения».
Слайд 19Классификация ВПС Американской кардиологической ассоциации (AHA - American Heart Association)
I) Ацианотичные ВПС:

а) с обструкцией кровотоку (стеноз легочной артерии, стеноз аорты, коарктация аорты);
б) с лево-правым сбросом ( ДМПП, ДМЖП, ОАП, атриовентрикулярная коммуникация).
II) Цианотичные ВПС: тетрада Фалло, транспозиция магистральных артерий, атрезия трехстворчатого клапана, тотальный аномальный дренаж легочных вен, общий артериальный ствол.
Слайд 20Выделение критических пороков периода новорожденности
Понятие «критический порок сердца» применяется для обозначения

ВПС, сопровождающихся развитием критических состояний в ближайшие часы или сутки после рождения.
а) дуктус-зависимые критические пороки периода новорожденности: - дуктус-зависимое системное кровообращение (коарктация аорты, критический аортальный стеноз, СГЛС);
- дуктус-зависимое легочное кровообращение (атрезия легочной артерии, критический стеноз легочной артерии, атрезия 3-х ств. клапана, тетрада Фалло);
- дуктус-зависимое системное и легочное кровообращение (транспозиция магистральных артерий); аномальное отхождение левой коронарной артерии от легочной артерии; тотальный аномальный дренаж легочных вен (в случае рестриктивного ООО).
б) дуктус-независимые пороки сердца (ДМЖП, ДМПП, АВК, ТАДЛВ, ДОС ПЖ, ОАС, дефект аорто-легочной перегородки, ЕЖ, аномалия Эбштейна).
Слайд 21Классификация ВПС разработанная в Институте сердечно-сосудистой хирургии им. А.Н. Бакулева АМН
Классификация основана

на распределении ВПС с учетом их анатомических особенностей и гемодинамических нарушений и наиболее часто используется в клинической практике в нашей стране, выделяет 15 групп пороков. Из них наиболее часто встречаются 4 группы.
1.ВПС с повышенным лёгочным кровотоком: ДМЖП - дефект межжелудочковой перегородки ДМПП - дефект межпредсердной перегородки ОАП - открытый артериальный проток Дефект аорто-лёгочной перегородки
2.ВПС с препятствием оттока крови из желудочков: стеноз легочной артерии, стеноз аорты.
3.ВПС с аномальным отхождением магистральных сосудов и нормальным расположением желудочков Тетрада Фалло ТМС - транспозиция магистральных сосудов Общий артериальный ствол
4.Аномалии дуги аорты - КоА - коарктация аорты, двойная дуга аорты.
Слайд 22Патогенез ВПС (патогенетическая классификация)
1. Нарушение миграции мезенхимальной ткани приводит к порокам развития

выносящих трактов сердца - конотрункальным порокам сердца:
общий артериальный ствол,
транспозиция магистральных сосудов,
двойное отхождение магистральных сосудов от правого желудочка,
тетрада Фалло,
перерыв дуги аорты типа В,
дефект межжелудочковой перегородки 1 типа.
Слайд 23 Патогенез ВПС (патогенетическая классификация)
2. Нарушение сердечной гемодинамики (внутриутробно):
синдром гипоплазии левого желудочка,
коарктация

аорты,
клапанный аортальный стеноз,
двухстворчатый аортальный клапан,
вторичный дефект межпредсердной перегородки,
Открытый артериальный проток,
Клапанный стеноз легочной арртерии
Дефект межжелудочковой перегородки II типа.
Слайд 24Патогенез ВПС (патогенетическая классификация)
3. Гибель клеток
Масса миокарда может увеличиваться в результате деления

клеток, их миграции или продукции экстрацеллюлярного матрикса. Уменьшение сердечной массы происходит только путем гибели клеток. Этот процесс важен при формировании клапанов и трабекулярной части межжелудочковой пергородки.
Аномалия Эбштейна
Дефект межжелудочковой перегородки IV типа.
Слайд 25Патогенез ВПС (патогенетическая классификация)
4. Патология экстрацеллюлярного матрикса.
Экстрацеллюлярный матрикс («кардиальный гель») представляет

собой аморфный субстрат из гликозоаминогликанов , располагающийся между миокардом и эндокардом. Продукцию экстрацеллюлярного матрикса осуществляют клетки миокарда. Матрикс способствует формированию атриовентрикулярных клапанов и выносящего тракта желудочков.
Открытый атриовентрикулярный канал.
Дефекты межпредсердной перегородки.
Слайд 26Патогенез ВПС
Патогенетические изменения при ВПС многообразны и обусловлены тремя основными составляющими:

1. Характером имеющихся анатомических дефектов.
2. Степенью нарушения гемодинамики.
3. Выраженностью и темпом дистрофических процессов в организме .
Выделяют три фазы течения ВПС (по К.Ф. Ширяевой)
1. Фаза первичной адаптации: приспособление организма ребенка к имеющимся нарушениям гемодинамики.
2. Фаза относительной компенсации: временное улучшение состояния ребенка.
3. Фаза декомпенсации (терминальная): резкое снижение компенсаторных возможностей, развитие дистрофических и дегенеративных изменений в сердце и тканях организма.
Слайд 27КЛИНИЧЕСКАЯ КАРТИНА ВПС
Клинические проявления ВПС определяются
анатомией порока,
степенью нарушения гемодинамики

и
адаптационно-компенсаторных механизмов,
характером осложнений.
Слайд 28Ведущие синдромы в клинической картине ВПС
Цианоз
Кардиогенный шок (критическое состояние)
Сердечная недостаточность
Легочная гипертензия

Слайд 29Цианоз
Механизмы, приводящие к цианозу разнообразны.
Основными являются: альвеолярная гиповентиляция, нарушение вентиляционно-перфузионных

отношений, недостаточный транспорт кислорода кровью.
При ВПС в формировании артериальной гипоксемии могут играть роль три основных механизма:
внутрисердечнй сброс крови справа налево и ее поступление в аорту;
сниженный легочный кровоток и уменьшенный возврат артериальной крови к сердцу;
разобщение большого и малого кругов кровообращения(ТМС).
Наиболее часто при ВПС встречаются 2 первых механизма
Слайд 30Цианоз
Цианоз появляется тогда, когда количество восстановленного гемоглобина в крови у взрослого человека

превышает 50 г/л. Если речь идет о фетальном гемоглобине , имеющем большее сродство к кислороду, эта величина существенно ниже и составляет около 40 г/л, что соответствует PaO2 40-50 мм рт ст и насыщению гемоглобина кислородом в пределах 88-90%.
Цианоз является одним из симптомов синдрома артериальной гипоксемии, которая характеризуется снижением парциального давления кислорода (PaO2) менее 60 мм рт. ст. в артериальной крови ( у новорожденных PaO2 40-45 мм рт ст) и насыщения гемоглобина кислородом (сатурации) менее 85% (у новорожденных менее 75%).
Длительная или резко выраженная гипоксемия приводит к развитию метаболического ацидоза, изменению электролитного состава крови, оксидативному стрессу, что сопровождается повреждениями органов на уровне клеточных мембран.
Слайд 31Цианоз
При цианозе у новорожденного показано проведение гипероксического теста с вдыханием 100% кислорода

в течение 10 минут. Сохранение низкого уровня сатурации кислорода говорит о высоком риске ВПС у новорожденного.
Слайд 32Гипероксический тест
Гипероксический тест: позволяет дифференцировать причину центрального цианоза. Чувствительность теста 76,5%; специфичность

- 99%. Правила проведения теста: тест проводится по истечении первых суток жизни. В противном случае вероятность ложноположительного результата составляет 0,5% (после 24 часов жизни - 0,05%); тест должен проводиться с использованием пульсоксиметра, не зависящего от двигательной активности ребенка. Возможно применение одноразовых и многоразовых датчиков; измерение проводится на правой руке и любой ноге. Может проводиться одновременно или последовательно; тест должен проводиться обученным и квалифицированным персоналом; положительным считается тест, отвечающий одному из трех критериев:∙
Слайд 331) SaO2 менее 90%;
2) SaO2 менее 95% при трехкратном почасовом измерении

на верхних и нижних конечностях в течение 3-х часов;
3) разница между SaO2 на верхних и нижних конечностях составляет более 3% (SaO2 правой руки > SaO2 любой ноги).
Слайд 34Гипероксидный тест
На правой руке (предуктально) производится забор артериальной (лучевая артерия) или капиллярной

крови на газовый состав и КЩС. Назначается инсуффляция кислорода (100%) через маску в течение 10-15 минут, затем вновь производится контрольный забор артериальной или капиллярной крови на газовый состав и КЩС.
Признается, что гипероксидный тест не приводит к закрытию ОАП и его проведение не противопоказано при подозрении на наличие дуктусзависимой патологии.
Однако отсутствие эффективности кислородотерапии указывает на вероятность дуктус зависимого кровообращения. Поэтому после проведения гипероксидного теста у новорожденного с подозрением на дуктус зависимое кровообращение необходимо тотчас прекратить подачу кислорода. Такие дети нуждаются в незамедлительной внутривенной инфузии простагландина Е1 .
Слайд 35Критическое состояние
2) Кардиогенный шок (критическое состояние) наиболее часто развивается при пороках, сопровождающихся

обструкцией выводного отверстия ЛЖ, при дуктус-зависимых пороках и ТАДЛВ с обструкцией венозного возврата.
Критическое состояние новорожденного с ВПС характеризуется острым дефицитом сердечного выброса, быстрым прогрессированием сердечной недостаточности, кислородным голоданием тканей с развитием декомпенсированного метаболического ацидоза и нарушением функции жизненно важных органов.
Слайд 36В основном критические состояния при ВПС возникают в период перехода от пренатального

к постнатальному типу кровообращения, когда прекращается функционирование фетальных коммуникаций: открытого артериального протока (ОАП) и открытого овального окна.
К основным причинам развития критического состояния у больного с ВПС относятся: 1) закрытие ОАП при дуктус-зависимом кровообращении; 2) резкая обструкция кровотока (легочный стеноз, аортальный стеноз, коарктация аорты, синдром гипоплазии левого сердца. 3) сердечная недостаточность (ДМЖП, ОАП, АВК, ТАДЛВ, дефект аорто-легочной перегородки и другие).
Слайд 37Критическое состояние
обеспечить снижение потребностей организма в кислороде с помощью создания температурного и

физического комфорта — условия кювеза, с возвышенным положением верхней части туловища;
пеленание со свободными грудной клеткой и руками;
ограничение энергетических затрат на физиологическую нагрузку (кормление через зонд);
поддержка кровотока через артериальный проток (инфузия жидкостей, простагландина Е);
коррекция метаболических сдвигов, при необходимости — искусственная вентиляция легких (ИВЛ) без добавления кислорода во вдыхаемую смесь, в режиме, исключающем гипервентиляцию и при одновременной инфузии препарата простагландина Е.
Принимая решение о назначении ИВЛ, необходимо учитывать, что кислород оказывает вазоконстрикторное влияние на артериальный проток, что делает кислородотерапию опасной в данной группе пациентов;
при угрозе закрытия дуктус-зависимых пороков объем инфузий и кормления увеличивают до 110–120% от нормальных потребностей на фоне постоянной оценки диуреза. Установлено, что прирост массы тела у новорожденного на 5% за 1–2 суток стабилизирует функцию артериального протока.
Слайд 38Критическое состояние
1. мониторирование сатурации на правой руке и любой ноге с постоянным

датчиком; катетеризация 2-х вен;
2. лечение гипотензии раствором натрия хлорида 10-30 мл/кг;
3. при необходимости эпинефрин 0-0,5 мкг/кг/минуту;
4. при дуктусзависимых пороках препарат простагландина Е2 из расчета 5-10нг/кг/мин.Кислород противопоказан: стимулирует сокращение гладкомышечного слоя стенки артериального протока, что способствует его закрытию. Но при налаженной инфузии простагландина Е1 возможна инсуфляция кислорода (30-35%) с целью профилактики выраженной гипоксемии.
4. Регулярный контроль уровня глюкозы.
Слайд 39Сердечная недостаточность
Сердечная недостаточность - патологическое состояние, обусловленное несостоятельностью сердца как насоса, обеспечивающего

адекватное кровообращение. Это определение включает острую и хроническую сердечную недостаточность. В большинстве случаев причиной развития сердечной недостаточности у новорожденного является наличие врожденного порока сердца. Кроме этого причинами могут быть нарушения ритма сердца, асфиксия, сепсис, элетролитные нарушения, миокардиты, гипо- или гипертиреоз.
Слайд 40Сердечная недостаточность
Основными симптомами СН в период новорожденности являются тахикардия, одышка, признаки застоя

по малому кругу кровообращения( хрипы в легких) и большому кругу кровообращения ( увеличение печени и отеки).
Слайд 41Классификация СН при ВПС у новорожденных (Шарыкин А.С.)
1 степень : умеренная одышка

до 120% от нормы в покое или при нагрузке ( кормление), печень +3см.Сердце может быть не увелично. Компенсация возможна с помощью медикаментозной терапии.
2 степень: нарастание тахикардии и одышки до 125-150% от нормы, печень более 3см
отеки на лице и стопах, застойные хрипы в легких. ЭХО КГ-заметная дилатация полостей желудочков. Медикаментозной терапии уменьшает симптомы СН до 1 степени
Слайд 42Классификация СН при ВПС у новорожденных (Шарыкин А.С.)
3 степень тахикардии и одышки

до 160% от нормы, плотная увеличенная печень, переферичекие отеки, асцит, застойные хрипы в легких.Ребенок заторможен. Размеры сердца значительно увеличены.Стандартная терапия малоэффективна. Реанимация.ИВЛ.
4 степень Кардиогенный шок – артериальная гипотония, декомпенсированный ацидоз, периферический спазм, бледность. Угнетение ЦНС,олигурия. Возожна брадикардия ниже 80 в минуту. Интенсивная или реанимционная терапия.
Слайд 43Сердечная недостаточность
Причинами сердечной недостаточности при ВПС являются • Перегрузка объемом (пороки с

большими лево-правыми сбросами, ТАДЛВ, недостаточность клапанов сердца) •
Перегрузка сопротивлением (критические аортальный и легочный стеноз, коарктация аорты) SaO2 менее 95% и более 90% на обеих конечностях SaO2 равна и превышает 95% на обеих конечностях, разница SaO2 между верхней и нижней конечностью не превышает 3%. SaO2 менее 90% на обеих конечностях измерение через 1 час SaO2 менее 90% на обеих конечностях SaO2 менее 95% и более 90% на обеих конечностях SaO2 равна и превышает 95% на обеих конечностях, разница SaO2 между верхней и нижней конечностью не превышает 3%. положительный скрининг отрицательный скрининг немедленное извещение неонатолога респираторный цианоз? углубленный осмотр неонатолога, детского кардиолога возможность проведения ЭХОКГ? подготовка и транспортировка в стационар более высокого уровня нет да •
Гипоксическое или ишемическое поражение миокарда (пороки сопровождающиеся выраженной гипоксемией, аномальное отхождение левой коронарной артерии от легочного ствола.
Слайд 44Сердечная недостаточность
Лечение сердечной недостаточности у новорожденных с ВПС:
- негликозидные инотропные препараты

( в1 адреномиметики –добутамин и допаминергические средства – допамин),
- диуретики,
- сердечные гликозиды,
- антагонисты рецепторов к альдостерону.
Слайд 45Легочная гипертензия
Более 50-60% всех ВПС относятся к порокам с обогащением МКК,

протекающим преимущественно без цианоза и с артериовенозным шунтом крови. Из них наиболее часто диагностируют ДМЖП – 20% всех случаев ВПС, ДМПП- 2,5-16%, ОАП -6-18%.
Слайд 46Легочная гипертензия
Легочная гипертензия- самое тяжелое и опасное осложнение данных ВПС .Среди часто

встречающихся врожденных пороков сердца легочная гипертензия в 55-60% осложняет ДМЖП уже в раннем возрасте, в 20-27% -ДМПП, в более старших возрастных группах и в 9-35% осложняет открытый артериальный проток .Легочная гипертензия ( ЛГ) является грозным и тяжелым осложнением естественного течения ВПС. Она существенно ухудшает прогнозы для жизни, исход оперативного лечения и выживаемость пациентов.
Слайд 47Легочная гипертензия
Легочная гипертензия (ЛГ) - это состояние, при котором среднее давление в

легочной артерии (ДЛА) более или равно 25 мм.рт.ст в покое по данным катетеризации правых отделов сердца (КПОС). Нормальное среднее ДЛА в покое – 14 +- 3 мм рт.ст.с верхней границей нормы 20 мм рт.ст.
Слайд 48Легочная гипертензия
В 2011 году в Панаме рабочая группа Института изучения заболеваний сосудов

легких внесла предложение о формировании терминологии и классификации ЛГ у детей. Согласно их рекомендациям, обязательным критерием гипертензионной сосудистой болезни легких у детей является повышение легочного сосудистого сопротивления более 3 ед. Вуда * м2. В некоторых случаях это обусловлено тем, что при лево-правых системно-легочных шунтах, повышение давления в легочной артерии не сопровождается увеличением легочного сосудистого сопротивления, и у этих детей необходима скорейшая оперативная коррекция порока, а не медикаментозное лечение.
Слайд 49Стадии формирования ЛГ
1) Гиперволемическая стадия, когда происходит большой артериовенозный сброс крови в

малый круг кровообращения при незначительном защитным спазмом сосудов. Имеет место несоответствие емкости сосудистого русла легких объему поступающей в них крови.
2) Смешанная стадия - повышение давления в легочной артерии обусловлено защитным спазмом сосудов легких, ограничивающим артериовенозный сброс. Вазоконстрикция является важным механизмом адаптационной системы организма.
3) Склеротическая стадия - имеют место распространенные необратимые изменения легочных сосудов. Склеротическая стадия легочной гипертензии определяет прогнозы результатов хирургической коррекции порока.
Слайд 50Легочная гипертензия
Выделение стадий ЛГ имеют колоссальное практическое значение, т.к. помогают определять

тактику консервативного лечения и уточнять рациональные сроки оперативного вмешательства, а также делать прогнозы результатов хирургической коррекции порока.
Слайд 51Степени легочной гипертензии
По классификации Ф. Углова и А.Попова легочная гипертензия делится

на степени в зависимости от величины расчетного давления в легочной артерии (РДЛА).
I степень ЛГ: РДЛА составляет 25-50мм.рт.ст.,
II степень ЛГ: РДЛА - 51-75 мм.рт.ст.,
III степень ЛГ: РДЛА - 76-110 мм.рт.ст и
IV степень ЛГ: РДЛА более 111 мм.рт.ст.
Слайд 52Легочная гипертензия
Предварительно диагностировать ВПС и наличие тяжелой ЛГ можно с помощью такого

не инвазивного метода, как ЭХОКГ, но наиболее точным методом, так называемым «золотым стандартом» диагностики ЛГ, является инвазивное измерение давления в правых отделах сердца посредством их катетеризации.
Одним из методов, нашедшим широкое распространение, является КТ ангиокардиография произведенная на мультиспиральном компьютерном томографе. Основная роль его заключается в том, чтобы продемонстрировать особенности вторичных форм ЛГ. Позволяет получить необходимую информацию об анатомии порока, состоянии легких и других органов грудной клетки.
Слайд 53Диагностика ВПС
Пренатальная диагностика ВПС: • подробный сбор анамнеза у беременной женщины и

выявление факторов риска рождения ребенка с аномалиями развития • пренатальный ультразвуковой скрининг в декретированные сроки беременности • при подозрении на порок развития проводится прицельное УЗИ плода на аппрате экспертного класса • проведение пренатального консилиума, целью которого является определение сроков и места родоразрешения, информирование родителей о имеющемся пороке развития, предполагаемой тактике ведения ребенка после рождения, возможной кардиохирургической коррекции, формирование предварительного прогноза.
Слайд 54Показания для выполнения ЭХО-КГ плода со стороны матери
Метаболические заболевания : сахарный диабет,

фенилкетонурия.
2. Коллагеновые сосудистые заболевания.
3. Влияние тератогенов: употребление матерью наркотиков, алкоголя , аналогов вит А, противосудорожных, противоэпилептических препаратов, препаратов лития.
4. Влияние НПВС .
5. Краснуха .
6. ЭКО 7.
Возраст матери.
8. Токсикоз и угроза прерывания в 1 триместре беременности.
9. Мертворождения в анамнезе.
Слайд 55Показания для выполнения ЭХО-КГ плода со стороны семьи
1. Наличие в анамнезе у

членов семьи ВПС
2. Наличие в анамнезе у членов семьи хромосомных или генетических отклонений: синдром Нунана, Ди-Джоржи, Морфана и т. п.
Слайд 56Показания для выполнения ЭХО-КГ плода со стороны плода
1. Аномальная частота сердцебиений плода,

аритмии
2. Подозреваемые сердечные пороки, выявленные скрининговыми УЗИ
3. Наличие других пороков развития, выявленных при УЗИ (пупочная грыжа, омфалоцеле, атрезия 12-п.к., spina bifida, единственная артерия пуповины, аномалии мочеполовой системы, аномалии ЦНС.
4. Мало- или многоводие
5. Доказательства фетальной водянки (наличие жидкости в плевральной или брюшной полости)
6. Задержка внутриутробного развития плода
7. Многоплодная беременность
8. Утолщение в 1 триместре ТВП .
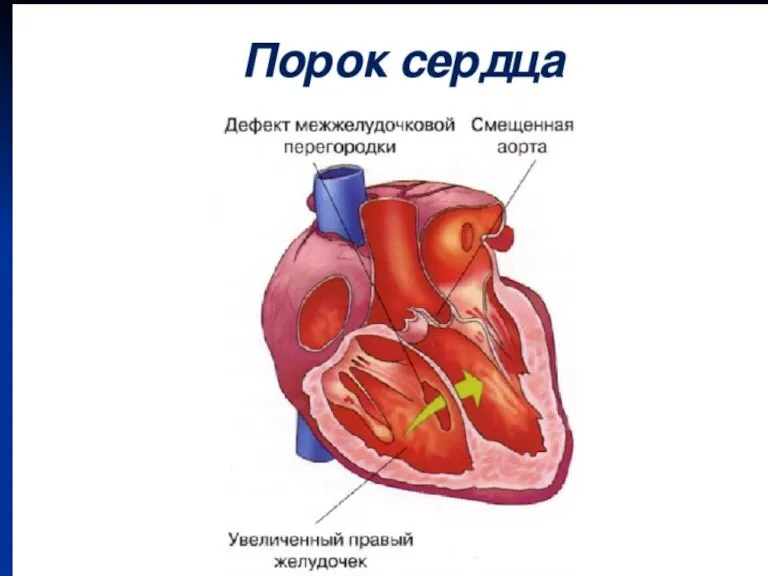
Слайд 57Дефект межжелудочковой перегородки
ДМЖП- врожденный порок сердца, характеризующийся наличием сообщения (отверстия) между

правым и левым желудочком. Перимембранозные дефекты составляют 61,4- 80 % всех случаев ДМЖП, мышечные дефекты-5-10%.
Клинические проявления: малые ДМЖП имеют скудную клиническую картину. Большие ДМЖП имеют два пика клинических проявлений. В течение первого года ведущим синдромом является сердечная недостаточность. Она обусловлена максимальной величиной артериовенозного сброса и неразвитостью механизмов адаптации. Второй пик клинических проявлений обусловлен прогрессированием легочной гипертензией.
Детей беспокоит одышка, сердцебиения, утомляемость , связанные с физической нагрузкой. Отмечается плохая прибавка массы тела и частые инфекционные заболевания легких.
Слайд 59ДМЖП
Физикальные данные: раннее формирование сердечного горба. При пальпации определяется систолическое «кошачье мурлыканье»

по середине грудины вдоль левого края. При аускультации выслушивается грубый систолический шум в пределах левой нижней стернальной границы, акцент II тона над легочной артерией. При постепенном увеличении давления в правом желудочке шум становится более низким коротким и мягким.
ЭКГ- признаки перегрузки левого желудочка. При большом дефекте и выраженной легочной гипертензии отмечаются ЭКГ признаки гипертрофии обоих желудочков или изолированная гипертрофия правого желудочка.
ЭХО КГ дает информацию о локализации, размере , количестве дефектов; выраженности объемной перегрузки левого желудочка, степени легочной гипертензии.
Слайд 60ДМЖП
Тактика лечения определяется гемодинамической значимостью и известным для него прогнозом. Лечение сердечной

недостаточности проводится диуретиками, сердечными гликозидами, ингибиторами АПФ.
Показаниями к хирургическому лечению являются сердечная недостаточность и дыхательная недостаточность в первые 3 месяца жизни, задержка физического развития не поддающиеся лечению.
У детей старше 6 месяцев хирургическое лечение при подаортальном дефекте показано при нарастании общелегочного сосудистого сопротивления.
Закрытие дефекта окклюдером рекомендуется в тех случаях, когда дефект находится на достаточном расстоянии от трехстворчатого и аортального клапанов.
Операцию по поводу изолированного ДМЖП рекомендуется выполнять путем ушивания или закрытия заплатой из биологического (ксено-или аутоперикарда) или синтетического материала (дакрона, политетрафторэтилена).
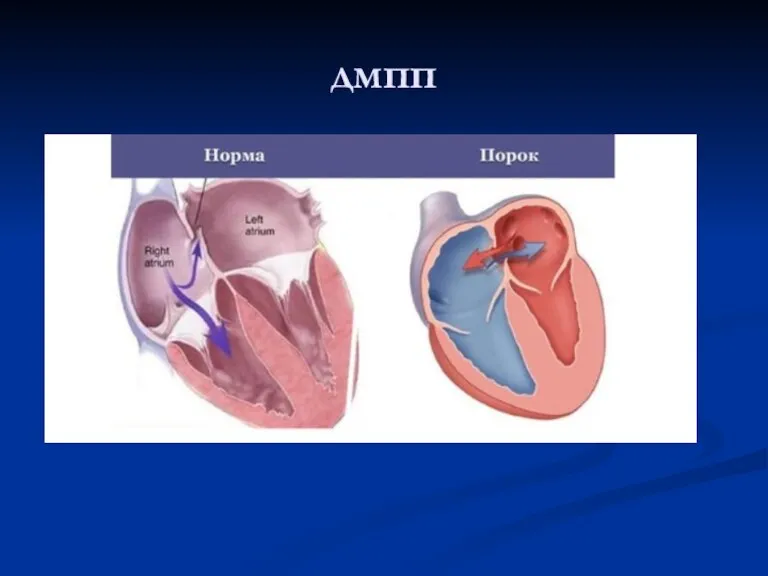
Слайд 61Дефект межпредсердной перегородки
Вторичный ДМПП является одним из самых частых врожденных

пороков сердца и представляет собой постоянное сообщение между предсердиями. Существует несколько разных типов ДМПП: ДМПП в области овальной ямки (fossa ovalis) или центральный составляет до 85% всех случаев ДМПП). дефект венозного синуса (от 5% до 10%), расположенный вверху (у устья верхней полой вены) или внизу (над устьем нижней полой вены) и редко встречающийся дефект венечного синуса или обескрышенный коронарный синус (менее 1%), который приводит к сбросу крови через отверстие венечного синуса.
Слайд 63Дефект межпредсердной перегородки
Неоперированные ДМПП локализующиеся в области овального окна или в аневризме

межпредсердной перегородки имеют тенденцию к спонтанному закрытию в течение первого года жизни (до 50% ДМПП, диагностированных при рождении). ДМПП другой локализации, как правило, спонтанно не закрываются.
Слайд 64Дефект межпредсердной перегородки
Следствием сброса крови слева направо через ДМПП является перегрузка правого

желудочка объемом и избыточный легочный кровоток.
Вследствие большого легочного кровотока и правожелудочковой сердечной недостаточности значительный сброс крови на уровне предсердий приводит к симптомам, включающим частые легочные инфекции, утомляемость, непереносимость физической нагрузки и сердцебиение.
Предсердные аритмии: трепетание предсердий, фибрилляция предсердий, синдром слабости синусового узла являются результатом длительной перегрузки правых отделов объемом и возникают, как правило, во взрослом возрасте.
Слайд 65Дефект межпредсердной перегородки
Легочная артериальная гипертензия при ДМПП развивается редко .
Такие симптомы, как

одышка и сердцебиение являются наиболее частыми ранними симптомами заболевания при больших ДМПП у детей, но как правило в течение первых месяцев жизни происходит компенсация гемодинамики и регресс клинической картины. В дальнейшем большая часть детей с ДМПП асимптоматичны и не имеют жалоб.
Пациенты с небольшими дефектами (менее 5-6 мм) могут оставаться бессимптомными до четвертого и пятого десятилетий жизни, однако, в результате увеличения сброса крови симптомы могут появляться с возрастом даже при небольших дефектах.
Слайд 66Дефект межпредсердной перегородки
Клинические данные включают систолический шум во втором и третьем межреберье

слева от грудины, фиксированное расщепление второго тона сердца. При сопутствующей трикуспидальной недостаточности наблюдается диастолический шум на трехстворчатом клапане.
ЭКГ - часто имеет место отклонение электрической оси сердца вправо, признаки гипертрофии правого предсердия, неполная блокада правой ножки пучка Гиса (вторичный ДМПП) или аномальная ось зубца P (дефект венозного синуса).
Слайд 67Дефект межпредсердной перегородки
На рентгенографии органов грудной клетки может выявляться увеличение ПЖ или

правого предсердия (ПП), выбухание дуги легочной артерии и усиление легочного артериального рисунка.
Эхо-КГ является основным диагностическим визуализирующим исследованием при ДМПП. Диагностическое обследование пациента с подозрением на ДМПП направлено на определение размера и расположения ДМПП, функциональной оценки сброса правого и левого желудочков и легочного кровообращения, а также любых связанных с ними повреждений.
Слайд 68Дефект межпредсердной перегородки
Контрастная Эхо-КГ применяется для подтверждения наличия предсердного сброса справа налево,

если видео и цветовое доплеровское исследование неубедительны.
МРТ является дополнительным неинвазивным способом визуализации, если результаты Эхо-КГ неубедительны.
Также может потребоваться катетеризация для определения размера ДМПП, аномального дренажа легочных вен, если неинвазивные методы оказались малоинформативными.
В настоящее время в ряде случаев катетеризация выполняется одновременно с закрытием дефекта окклюдером.
Слайд 69Дефект межпредсердной перегородки
Новорожденные дети с ДМПП подлежат динамическому наблюдению.
При необходимости выполняется

лечение сердечной недостаточности.
Оперативное лечение показано при отсутствии тенденции к закрытию ДМПП в течение первого года жизни и возрастании степени нагрузки на ПЖ.
Медикаментозная терапия легочной гипертензии показана только тем пациентам, у которых наблюдается необратимая легочная гипертензия, и поэтому закрытие ДМПП им не показано
Хирургическое закрытие ДМПП является «золотым стандартом» лечения с прекрасными отдаленными результатами. Операция, как правило, включает закрытие дефекта заплатой или прямое ушивание.
Хирургическое лечение не осложненных ДМПП не показано детям в возрасте менее 6 месяцев (Уровень доказательности: С).
Слайд 70Дефект межпредсердной перегородки
В настоящее время большинство вторичных ДМПП могут быть закрыты с

помощью чрескожного катетерного метода. Если эта процедура технически невыполнима или не подходит пациенту, то рекомендуется выполнение хирургического закрытия. Катетерное вмешательство не рекомендуется у детей раннего возраста (уровень доказательности С).
Оценка возможной миграции окклюдера, развития эрозии или других осложнений рекомендованы пациентам через 3 -12 месяцев после операции и периодически далее (Уровень доказательности: С).
У пациентов, которым хирургическое лечение ДМПП было выполнено в детском возрасте, обычно нет поздних осложнений.
Слайд 71Дефект межпредсердной перегородки
Профилактика эндокардита требуется у пациентов с сопутствующими клапанными пороками, при

изолированных ДМПП - первые 6 месяцев после закрытия дефекта.
Спустя 6 месяцев после хирургического вмешательства пациенты с неосложненным ДМПП могут вести обычный образ жизни.
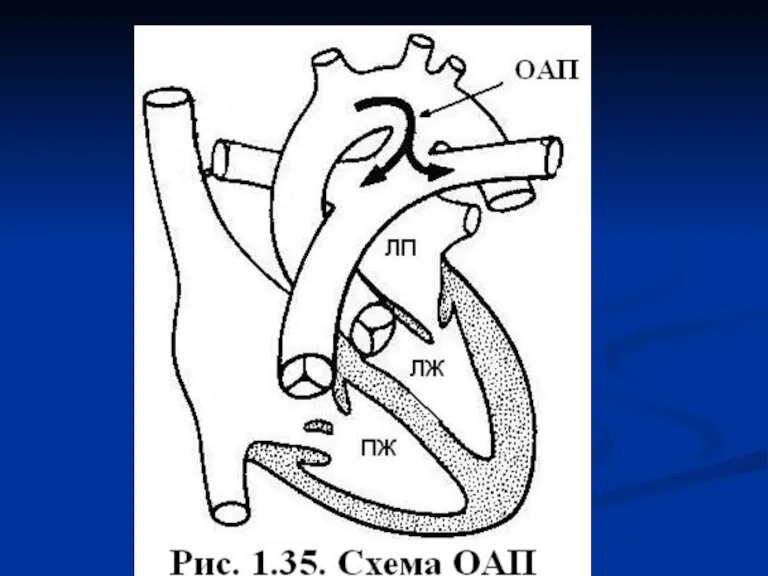
Слайд 72Открытый артериальный проток
ОАП наблюдается у 5-10% всех детей с ВПС, если не

учитывать недоношенных новорожденных, у которых наличие ОАП - типичная проблема.
У детей массой тела при рождении меньше 1750 грамм в 45% определяется наличие персистирующего артериального протока, при массе тела меньше 1200 грамм - в 80%.
Проток обычно представляет собой существующий в норме внутриутробно сосуд, соединяющий ствол легочной артерии и нисходящую аорту, обычно на 5-10 мм дистальнее устья левой подключичной артерии.
Проток обычно имеет более узкое устье в легочной артерии. Размеры и форма протока широко варьируют.
Слайд 75Открытый артериальный проток
Клинические проявления: при маленьком ОАП пациенты обычно не имеют симптомов.

При большом ОАП характерны признаки сердечной недостаточности ( плохая прибавка в весе, одышка и тахикардия, частые респираторные инфекции, пневмонии).
Физикальные данные: У больных с большим ОАП и значительным лево-правым шунтом определяется гиперреактивность и увеличение размеров сердца.
Систолический шум определяется по левому краю грудины. Пульсация артерий на конечностях может быть усиленной из-за снижения диастолического давления. II тон нормальный, однако при повышении давления в легочной артерии определяется его акцент. Для ОАП средних размеров характерен систолодиастолический непрерывный шум на основании сердца.
Слайд 76Контрастная Эхо-КГ применяется для подтверждения наличия предсердного сброса справа налево, если видео

и цветовое доплеровское исследование неубедительны.
МРТ является дополнительным неинвазивным способом визуализации, если результаты Эхо-КГ неубедительны.
Также может потребоваться катетеризация для определения размера ДМПП, аномального дренажа легочных вен, если неинвазивные методы оказались малоинформативными.
В настоящее время в ряде случаев катетеризация выполняется одновременно с закрытием дефекта окклюдером.
Слайд 77Открытый артериальный проток
ЭхоКГ позволяет визуализировать ОАП у большинства пациентов. Доплеровское исследование позволяет

определить гемодинамическую ситуацию, направление шунта и градиент давления.
Прогноз. Спонтанное закрытие ОАП может быть отсроченным у нормального новорожденного, однако редко наблюдается после 1 месяца жизни. При большом шунте развивается сердечная недостаточность, повторные пневмонии, которые могут привести к смерти в раннем возрасте. Наличие ОАП у недоношенного новорожденного в сочетании с незрелостью легочной паренхимы часто ведет к сердечной недостаточности, бронхолегочной дисплазии, зависимости от искусственной вентиляции легких. При отсутствии лечения (медикаментозного или хирургического), направленного на закрытие ОАП, такие состояния сопровождаются высокой летальностью.
Лечение. Индометацин применяется для закрытия ОАП у недоношенных новорожденных. Введение индометацина не эффективно у доношенных новорожденных. Наличие ОАП, независимо от размеров, является показанием для его закрытия хирургически.
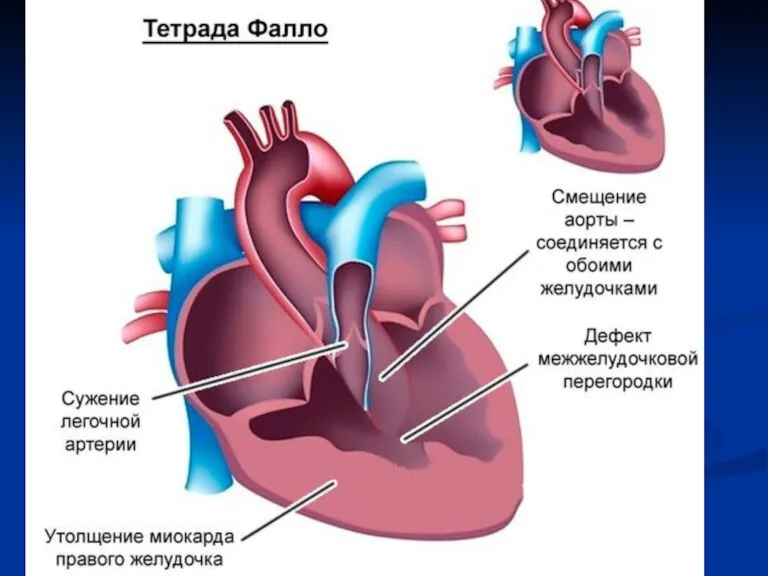
Слайд 78Тетрада Фалло
Это самый частый цианотический порок, наблюдаемый после первого года жизни.

Оригинальное описание ТФ, как комбинация четырех признаков (стеноз выводного отдела правого желудочка, ДМЖП, декстропозиция аорты, гипертрофия миокарда правого желудочка) сократилась до описания двух основных компонентов: ДМЖП и стеноза выходного тракта правого желудочка.
ДМЖП при ТФ большой, не рестриктивный, занимает всю субаортальную область, обычно равен или больше диаметра аорты. В 3% случаев наблюдаются множественные ДМЖП. Обструкция выхода из правого желудочка наблюдается у 75% больных на уровне выходного тракта. К ней присоединяется в 30% стеноз клапана легочной артерии. Лишь у 10% больных стеноз ограничивается лишь легочным клапаном. Еще у 15% больных клапан легочной артерии атрезирован, как крайняя форма патологии в этом спектре.
Слайд 80Тетрада Фалло
Клинические проявления: систолический шум выслушивается сразу после рождения.
Большинство пациентов имеют

цианоз сразу после рождения. Одышка при нагрузке, гипоксические приступы развиваются позже у детей с умеренным цианозом.
Сердечная недостаточность не характерна. Дети в раннем возрасте с ацианотической формой ТФ могут быть бессимптомны, или даже показывать признаки сердечной недостаточности из-за лево-правого шунта.
Слайд 81Тетрада Фалло
1. Клинические проявления зависят от степени обструкции выходного тракта правого желудочка.

Чем меньше легочный кровоток, тем в большей степени выражена гипоксия. Наиболее типично насыщение крови кислородом около 70-75%. Видимый цианоз зависит от двух факторов: степени гипоксии и содержания гемоглобина. Чем выше гемоглобин, тем раньше заметен цианоз.
2. Интенсивный систолический шум выслушивается по левому краю грудины. Чем более выражена обструкция выходного тракта правого желудочка, тем короче и слабее шум. Второй тон может быть нерасщепленным (так как отсутствует легочный компонент) и акцентированным (из-за увеличения размеров и декстрапозиции аорты). У больных с атрезией легочной артерии может быть слышен постоянный систоло-диастолический шум ОАП или больших аорто-легочных коллатеральных сосудов. Длительно существующий цианоз приводит к характерным изменениям ногтевых фаланг пальцев («барабанных палочек»).
Слайд 82Тетрада Фалло
ЭКГ : отклонение оси сердца вправо, вследствие гипертрофии правого желудочка;
· в

правых грудных отведениях, как правило, имеется доминирующий зубец R, а в левых – доминирующий зубец S, но иногда зубцы R и S могут быть одинаковой высоты в V грудном отведении или во всех отведениях доминирует зубец R.
· Зубцы Т могут быть высокими или инвертированными в этих же отведениях. У детей младшего возраста отрицательные зубцы Т в этих отведениях указывают на более выраженную гипертрофию правого желудочка. (Rowe и соавторы)
Эхокардиография. Двухмерная эхокардиография и доплеровское исследование могут быть достаточными для постановки диагноза и определения плана лечения.
КТ-ангиография/МРТ:- метод выбора для диагностики анатомии порока (анатомии легочных артерий) и выявления сопутствующих ВПС.
ОАК: эритроцитоз, повышение уровня гемоглобина.
Прогноз: дети с ТФ постепенно становятся более цианотичными.
Задержка развития наблюдается в случаях выраженного цианоза. Возможно развитие тромбоэмболических осложнений и абсцессов головного мозга. Септический эндокардит.
Слайд 83Тетрада Фалло. Тактика лечения
· Оптимальный срок радикальной коррекции 6-12 месяцев;
· новорожденные и

дети раннего возраста, не имеющие выраженной гипоксемии, не нуждаются в хирургической коррекции, оперативная коррекция проводится в возрасте 6-12 месяцев;
· наличие одышечно-цианотических приступов является показанием к назначению пропранолола, при прекращении приступов и сатурации более 80% хирургическое вмешательство может быть отложено;
· наличие частых одышечно-цианотических приступов с десатурацией ниже 75%-80% является показанием к операции в раннем возрасте;
· наличие таких факторов как: атрезия клапана легочной артерии, гипоплазия легочных артерий, гипоплазия ЛЖ являются показанием для паллиативного вмешательства в раннем возрасте;
· проведение радикальной коррекции в период новорожденности сопровождается высокой летальностью – до 10%.
Слайд 84Тетрада Фалло. Тактика лечения
Медикаментозное лечение, оказываемое на амбулаторном уровне:
· пропранолол 1 мг/кг/сут

в 3 приема до момента выполнения хирургической коррекции порока (с целью профилактики гипоксических кризов);
· препараты железа (для лечения относительной железодефицитной анемии, которая диагностируется у цианотичных пациентов).
Слайд 85Лечение одышечно-цианотических приступов
Лечение приступов состоит в прерывании порочного круга неэффективной

одышки и гипоксии
Кислород подается через маску, 6л/мин (оказывает вазодилятирующие действие на легочные сосуды и системное вазоконстрикторное действие).
Коленно-грудное положение - повышает ОПСС и легочный кровоток .
Морфин 0,1-0,2 мг/кг в/м или 0,01-0,02 мг/кг медленно внутривенно в течение 5-10 минут (оказывает седативное действие, контроль гиперпноэ).
С седативной целью также могут использоваться:Фентанил 1-2 мкг/кг в/в, Кетамин 1-2 мг/кг в/в .
Слайд 86Лечение одышечно-цианотических приступов
Эсмолол 0,5 мг/кг в/в в течение 1-2 минут, затем можно

продолжить в/в инфузию препарата 50-300 мкг/кг/мин. до 48 часов.
Метопролол 0,1 мг/кг медленно в/в (в течение 5 мин.). При необходимости в/в введение может быть повторено через 5 минут, максимально до 3 доз. В последующем можно продолжить в/в инфузию 1-2 мкг/кг/мин.
Пропранолол 0,1-0,2 мг/кг в/в. При необходимости в/в введение может быть повторено до 3-4 раз в день. (β-блокаторы снижают частоту сердечных сокращении, снимают спазм ВОПЖ ).
Натрия бикарбонат 4% 1 мл/кг медленно в/в в течение 5-10 мин. Может быть повторен через 10 минут (коррекция ацидоза ).
5% глюкоза/ физиологический раствор/раствор Рингера в/в 20-30 мл/кг/час Способствует увеличению легочного кровотока, за счет повышения венозного возврата и снижения вязкости крови.
Слайд 87Лечение ВПС
В настоящее время при большинстве ВПС может быть выполнено хирургическое

лечение.
Сроки лечения( экстренное, срочное и плановое ) и вид вмешательства (радикальное, вспомогательная или гемодинамическая коррекция) определяется анатомией порока.
Терапевтическое лечение показано при развитии критического состояния(для стабилизации перед оперативным пособием) или при сердечной недостаточности.


![Кодирование ВПС по МКБ-10 Q20-Q26 ВРОЖДЕННЫЕ АНОМАЛИИ [ПОРОКИ РАЗВИТИЯ] СИСТЕМЫ КРОВООБРАЩЕНИЯ Врожденные](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1148610/slide-3.jpg)














































































 Антиаритмики. Практика
Антиаритмики. Практика Средства, влияющие на дыхательную и сердечнососудистую системы. Диуретики. лекция 6
Средства, влияющие на дыхательную и сердечнососудистую системы. Диуретики. лекция 6 IRM® цемент стоматологический
IRM® цемент стоматологический -1636308160
-1636308160 Прямая реставрация передней группы зубов (зубов 1.2-2.2)
Прямая реставрация передней группы зубов (зубов 1.2-2.2) Ярмарка вакансий
Ярмарка вакансий Корь. Симптомы. Инкубация
Корь. Симптомы. Инкубация Перинатальные поражения центральной нервной системы. Актуальность. Тренды
Перинатальные поражения центральной нервной системы. Актуальность. Тренды Holographic Medical Pods
Holographic Medical Pods МДК 02.03 лекция № 7 акушеркам СП А1 термические поражения1
МДК 02.03 лекция № 7 акушеркам СП А1 термические поражения1 Combat Ready Clamp™
Combat Ready Clamp™ Приемное отделение. Выполнение установленных объемов (случаи госпитализации)
Приемное отделение. Выполнение установленных объемов (случаи госпитализации) Диагностика инфекционных стоматитов у стоматологических больных
Диагностика инфекционных стоматитов у стоматологических больных Заболевания крови
Заболевания крови Онкологиядағы шұғыл жағдайлар
Онкологиядағы шұғыл жағдайлар От чего мы иногда болеем
От чего мы иногда болеем Заболевания ОДА. Остеохондроз позвоночного столба
Заболевания ОДА. Остеохондроз позвоночного столба Трансфузионная терапия
Трансфузионная терапия Блокада плечевого сплетения по Куленкампфу
Блокада плечевого сплетения по Куленкампфу Cупрессия иммунного ответа
Cупрессия иммунного ответа Атеросклероз
Атеросклероз Тубоовариалды түзілісі бар науқастарды жүргізу тактикасы
Тубоовариалды түзілісі бар науқастарды жүргізу тактикасы Что такое хирургическая операция? Понятие о хирургических пациентах
Что такое хирургическая операция? Понятие о хирургических пациентах Инструменты реализации решений Правительства РФ по противодействию ВИЧ/СПИД
Инструменты реализации решений Правительства РФ по противодействию ВИЧ/СПИД Հարuեր եվ վարerոթյոններ բժշկության մեջ
Հարuեր եվ վարerոթյոններ բժշկության մեջ Антибиотиктер микробтар мен
Антибиотиктер микробтар мен Задачи по КОС
Задачи по КОС Инфекционные и инвазивные поражения сердечно-сосудистой системы
Инфекционные и инвазивные поражения сердечно-сосудистой системы