Автор: Ивлиева Наталья Александровна, учитель химии высшей квалификационной категории муниципального бюджетного общеобразовате
Содержание
- 2. Автор: Ивлиева Наталья Александровна, учитель химии высшей квалификационной категории муниципального бюджетного общеобразовательного учреждения «Ключевская средняя общеобразовательная
- 3. Рецензенты: Якушева Г.И. – зав. кафедрой химии и методики преподавания химии ОГПУ, к.х.н., доцент; Фарус О.А.
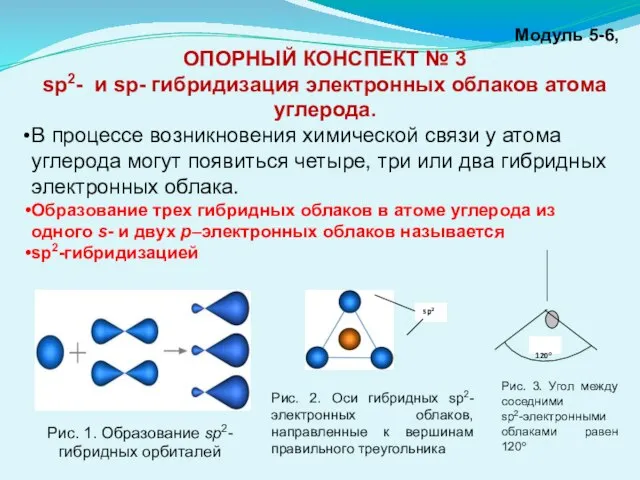
- 5. Модуль 5-6, ОПОРНЫЙ КОНСПЕКТ № 3 sp2- и sp- гибридизация электронных облаков атома углерода. В процессе
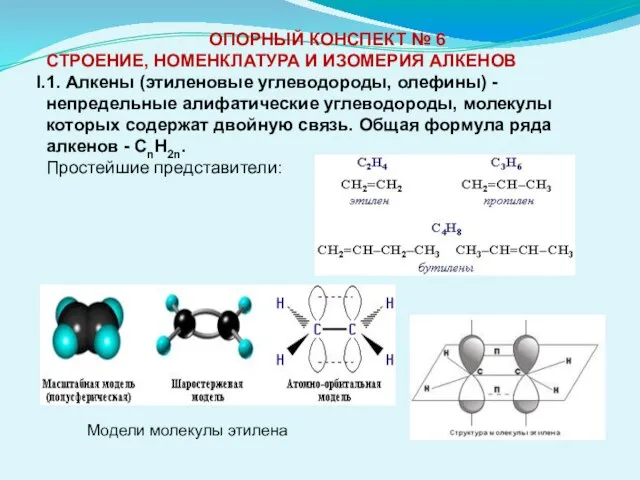
- 6. ОПОРНЫЙ КОНСПЕКТ № 6 СТРОЕНИЕ, НОМЕНКЛАТУРА И ИЗОМЕРИЯ АЛКЕНОВ 1. Алкены (этиленовые углеводороды, олефины) - непредельные
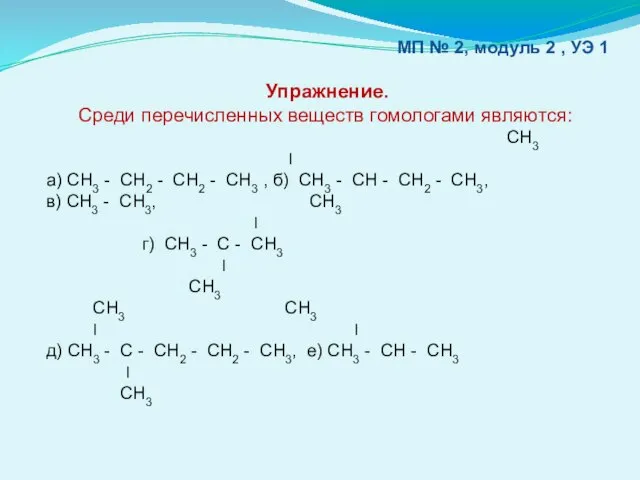
- 7. МП № 2, модуль 2 , УЭ 1 Упражнение. Среди перечисленных веществ гомологами являются: СН3 ׀
- 8. МП № 1, модуль 4, УЭ 1 Упражнение Дополните предложения: Способность атома углерода соединяться в различной
- 9. МП 7, модуль 1, УЭ 2. Упражнение Установите соответствие между исходными веществами и продуктами реакции. Запишите
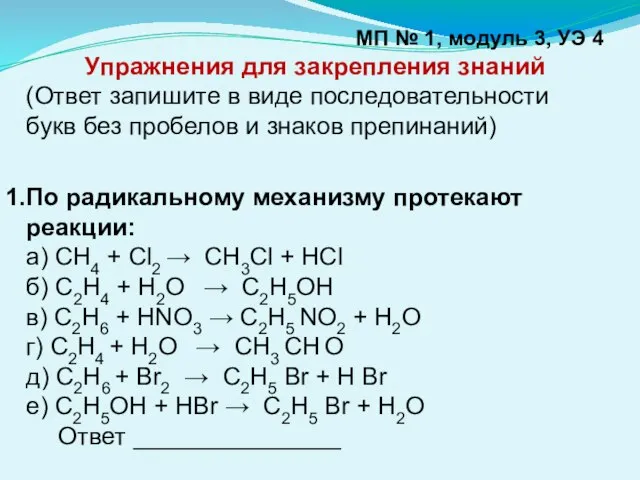
- 10. МП № 1, модуль 3, УЭ 4 Упражнения для закрепления знаний (Ответ запишите в виде последовательности
- 11. Тест для самоконтроля и самооценки знаний 1. В соответствии с конечным результатом данная реакция является .
- 12. МП 2, модуль 2, УЭ 5 Тест 2 (промежуточный контроль) 1. Определите ряд, в котором все
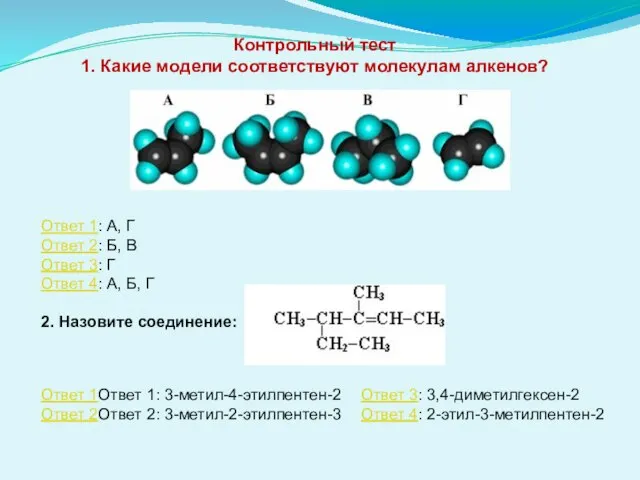
- 13. Контрольный тест 1. Какие модели соответствуют молекулам алкенов? Ответ 1: А, Г Ответ 2: Б, В
- 14. Тест-дополнение (входной контроль) Тип гибридизации электронных орбиталей атомов углерода в молекулах: этана _____, этилена ____, циклопропана
- 15. Алгоритм решения задач на вывод формулы вещества по данным количественного анализа Дано: w (С)= 82,75% =
- 16. Алгоритм решения задач на вывод формулы Для решения задач такого типа удобно использовать общую формулу данного
- 17. МП 4, модуль 3, УЭ 4 - низкий уровень - средний уровень - высокий уровень При
- 18. Из КИМов При окислении ароматического углеводорода состава С8Н10 была получена кислота, 24,9 г которой при реакции
- 19. МП 3, модуль 2, УЭ 1 Методика переноса знаний с ранее изученного на изучаемое Установить сходство
- 20. МП 3, модуль 2, УЭ 2 Памятка 2 Все составляющие молекулу атомы находятся во взаимосвязи и
- 21. МП 5, модуль 2, УЭ 3. Памятка 2 (правило ориентации) Важное значение для реакций замещения имеет
- 22. МП 8, модуль 3, УЭ 3 Действие спирта и фенола на живые организмы (фрагмент) Этиловый спирт
- 23. МП 10, модуль 5, УЭ 3 Муравьиная кислота (фрагмент) Химическая формула СН2О2, или НСООН, соответствует простейшей
- 24. МП 3, модуль 3, УЭ 6 Кроссворд «АЛКEНЫ» По вертикали: 1. Буква греческого алфавита, которой обозначают
- 25. МП 10, модуль 5, УЭ 5 Кроссворд «КАРБОНОВЫЕ КИСЛОТЫ» Необходимо найти на буквенном поле ответы на
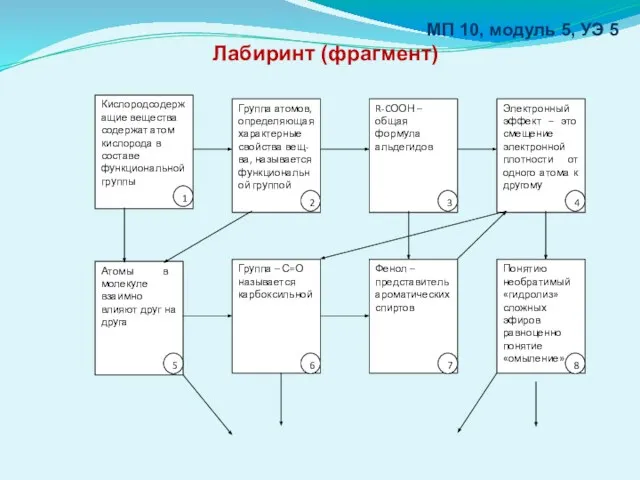
- 26. МП 10, модуль 5, УЭ 5 Лабиринт (фрагмент)
- 28. М О Д У Л Ь Н А Я П Р О Г Р А М
- 29. МОДУЛЬ 0 КОМПЛЕКСНАЯ ДИДАКТИЧЕСКАЯ ЦЕЛЬ В результате овладения содержанием всех модулей вы должны: раскрыть строение, свойства,
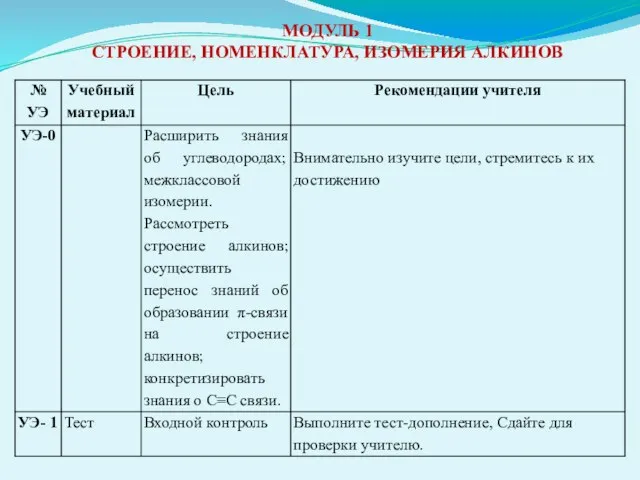
- 30. МОДУЛЬ 1 СТРОЕНИЕ, НОМЕНКЛАТУРА, ИЗОМЕРИЯ АЛКИНОВ
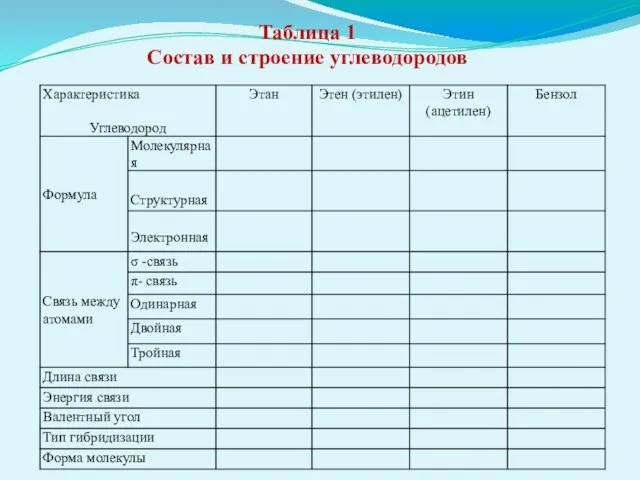
- 33. Таблица 1 Состав и строение углеводородов
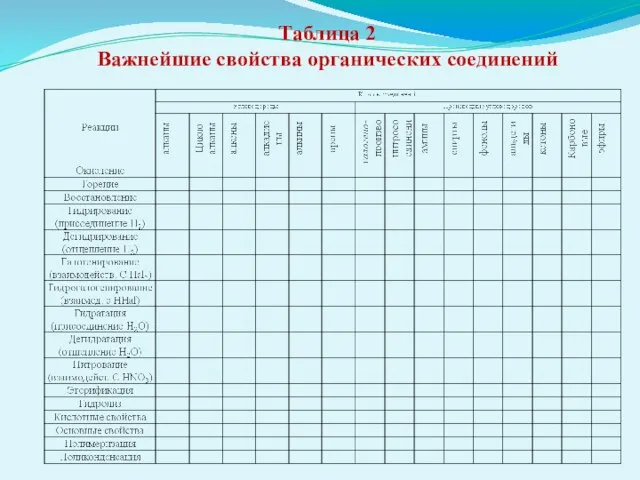
- 34. Таблица 2 Важнейшие свойства органических соединений
- 35. ЛИТЕРАТУРА Беспалов П.И. Модульные программы при изучении органической химии. Ч.1.- М.: -Центрхимпресс, 2003 Габриелян О.С. Химия:
- 36. Мультимедийные комплексы CD № 1 «Органическая химия». Учебный комплекс для средней школы. Под редакцией А.В. Соловова,
- 38. Скачать презентацию


























 Презентация на тему Россия – Родина моя 1 класс
Презентация на тему Россия – Родина моя 1 класс Яна
Яна Презентация на тему "Проектная методика" - скачать презентации по Педагогике
Презентация на тему "Проектная методика" - скачать презентации по Педагогике Иврит с удовольствием
Иврит с удовольствием Единый государственный экзамен по английскому языку
Единый государственный экзамен по английскому языку Устройства вывода информации 7 класс
Устройства вывода информации 7 класс Декоративная доска для кухни. Декупаж. Ягодное настроение
Декоративная доска для кухни. Декупаж. Ягодное настроение Ведение кассовой книги и хранение денег. Ревизия кассы и контроль за соблюдением кассовой дисциплины
Ведение кассовой книги и хранение денег. Ревизия кассы и контроль за соблюдением кассовой дисциплины Основы моделирования изделия
Основы моделирования изделия Антуан де Сент-Экзюпери
Антуан де Сент-Экзюпери C юбилеем, родная школа
C юбилеем, родная школа Веревочный парк
Веревочный парк Стратегия 2021
Стратегия 2021 Волосы- показатель здоровья
Волосы- показатель здоровья Обновление содержания курса географии в УМК нового поколения
Обновление содержания курса географии в УМК нового поколения Соединение волокон. Потери (2020)
Соединение волокон. Потери (2020) Фрунзенский район ГОУ СОШ №303 Исследование освещённости рабочего места и рабочей зоны.
Фрунзенский район ГОУ СОШ №303 Исследование освещённости рабочего места и рабочей зоны. ШКОЛА №4
ШКОЛА №4 Презентация на тему Интересные факты о витаминах
Презентация на тему Интересные факты о витаминах  Украшение и реальность
Украшение и реальность Презентация на тему Дизайн - проект развивающей среды в младшей группе "Теремок"
Презентация на тему Дизайн - проект развивающей среды в младшей группе "Теремок" Ганс-Христиан Андерсон
Ганс-Христиан Андерсон Управление маркетингом и реклама
Управление маркетингом и реклама Азбука. Игра
Азбука. Игра Презентация на тему Три главных вопроса экономики
Презентация на тему Три главных вопроса экономики  Управление проектами
Управление проектами О формировании нормативной базы проектирования объектов переработки ПНГ, хранения и транспорта СУГ (ШФЛУ)
О формировании нормативной базы проектирования объектов переработки ПНГ, хранения и транспорта СУГ (ШФЛУ) Система перечней документов
Система перечней документов