Содержание
- 4. АМИНОКИСЛОТЫ
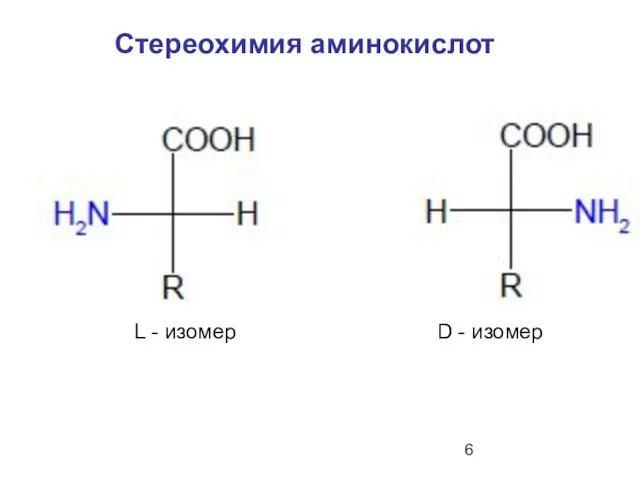
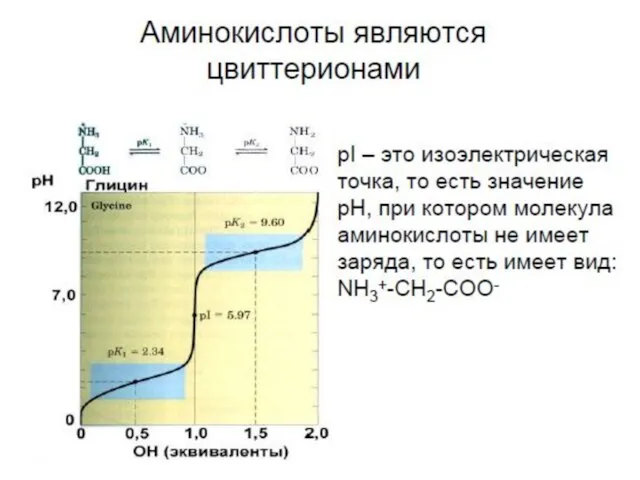
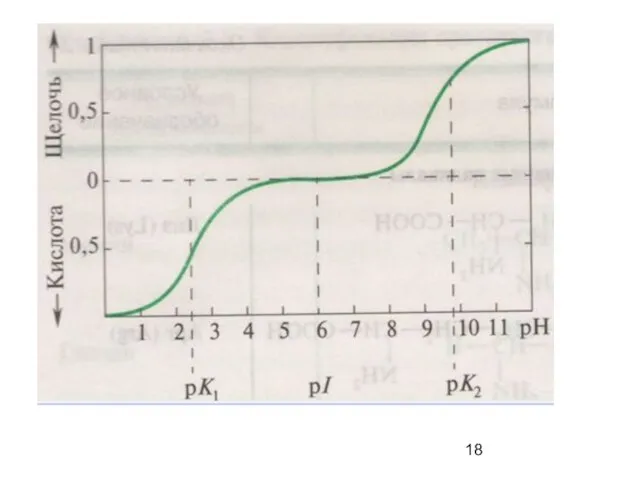
- 6. Стереохимия аминокислот L - изомер D - изомер
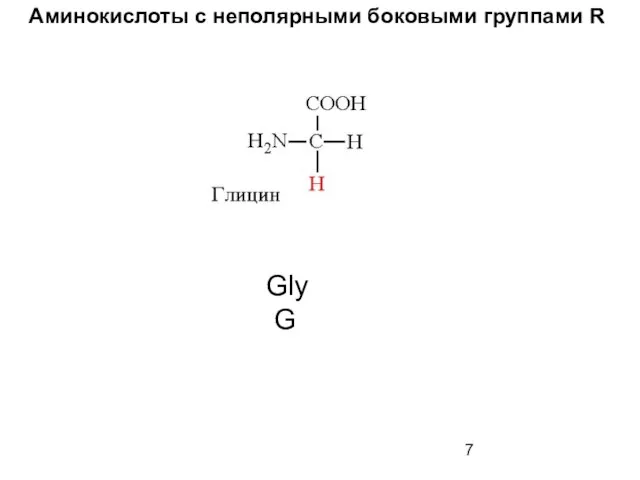
- 7. Аминокислоты с неполярными боковыми группами R Gly G
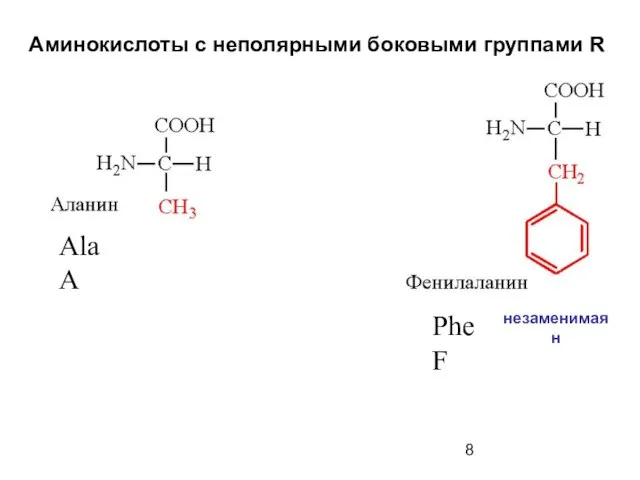
- 8. Аминокислоты с неполярными боковыми группами R Ala A Phe F незаменимая н
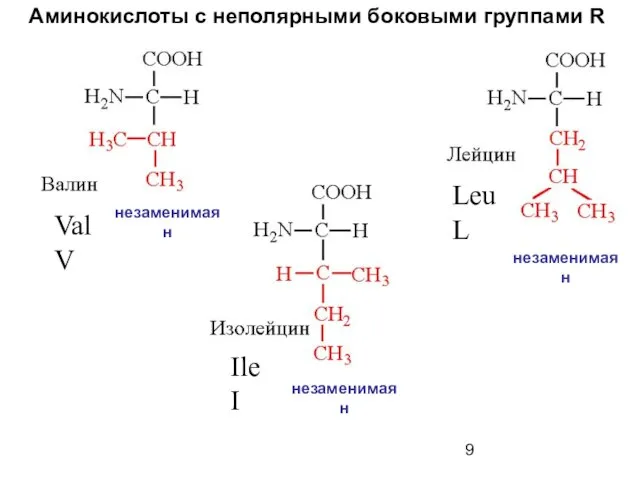
- 9. Аминокислоты с неполярными боковыми группами R Val V Leu L Ile I незаменимая н незаменимая н
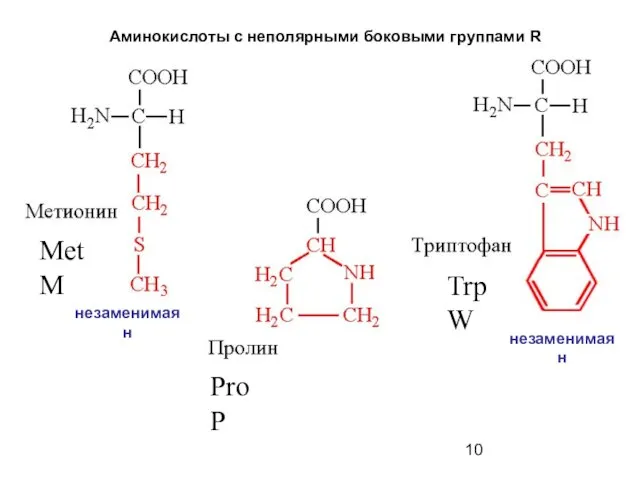
- 10. Аминокислоты с неполярными боковыми группами R Met M Pro P Trp W незаменимая н незаменимая н
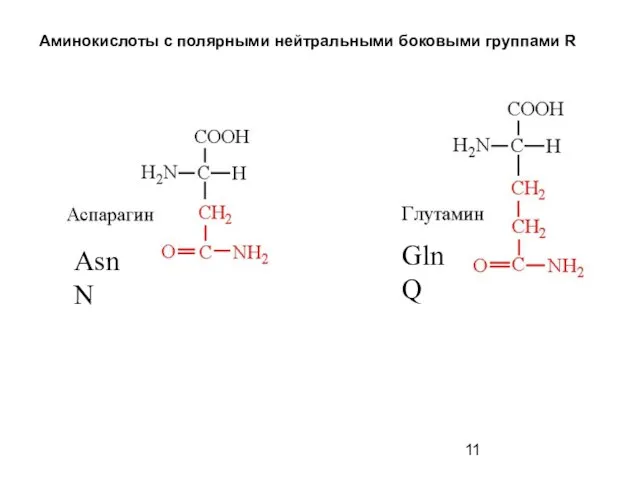
- 11. Аминокислоты с полярными нейтральными боковыми группами R Asn N Gln Q
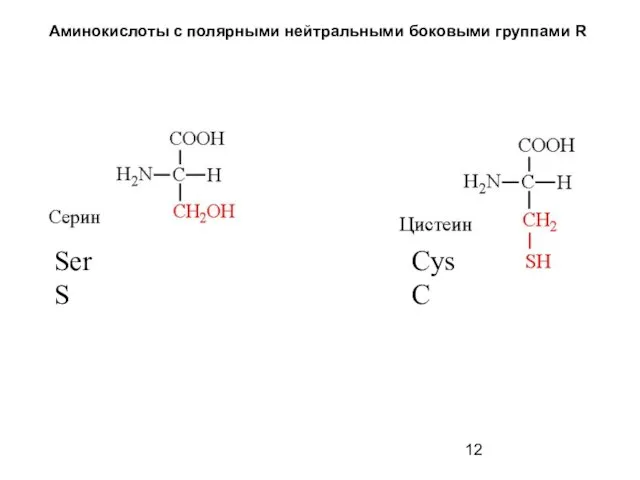
- 12. Аминокислоты с полярными нейтральными боковыми группами R Ser S Cys C
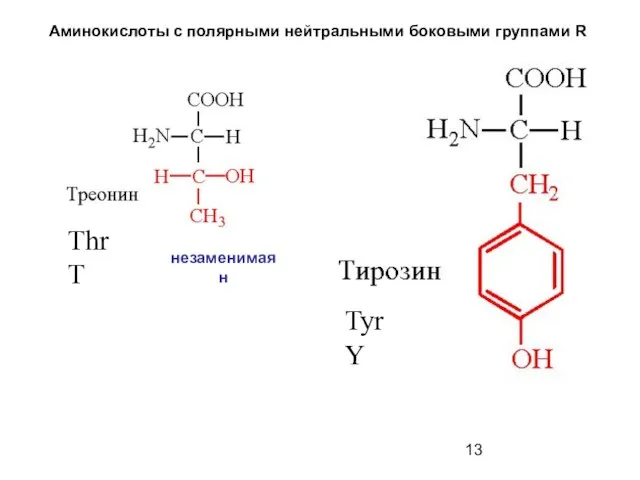
- 13. Аминокислоты с полярными нейтральными боковыми группами R Thr T Tyr Y незаменимая н
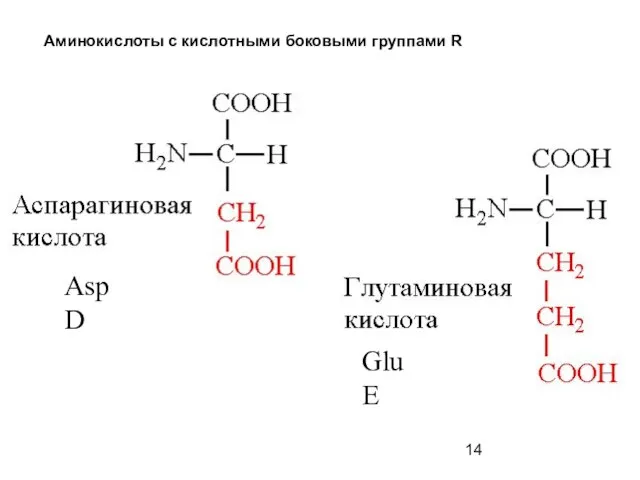
- 14. Аминокислоты с кислотными боковыми группами R Asp D Glu E
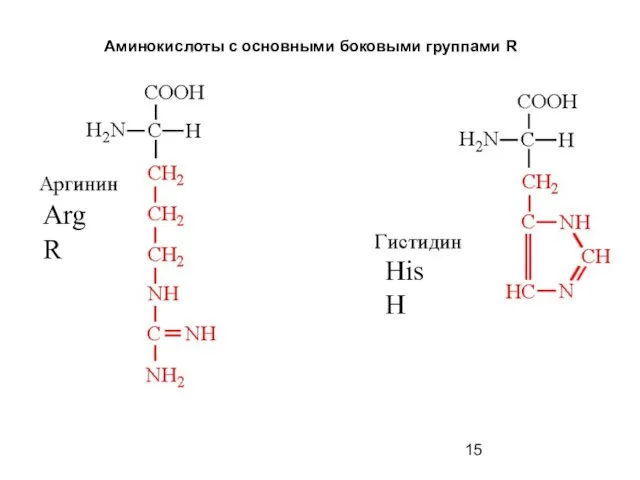
- 15. Аминокислоты с основными боковыми группами R Arg R His H
- 16. Аминокислоты с основными боковыми группами Lys K незаменимая н
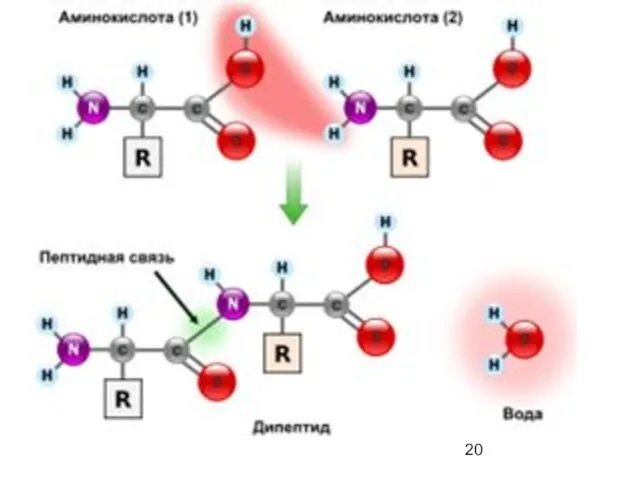
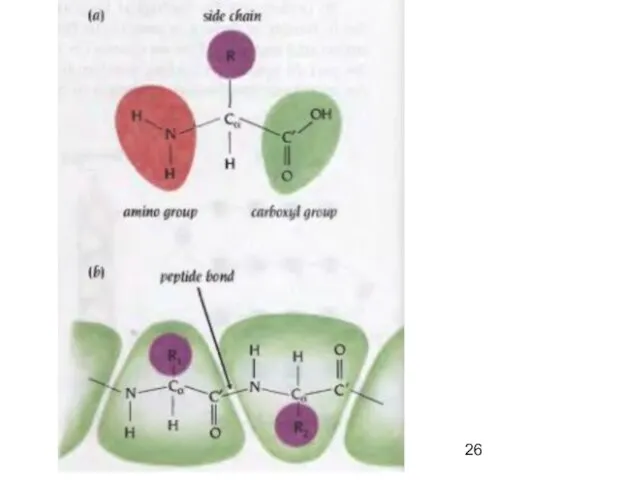
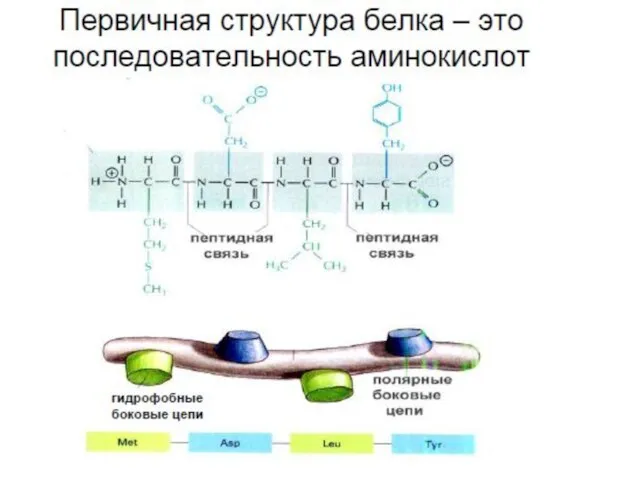
- 19. Пептиды (греч. πεπτος — питательный) — семейство веществ, молекулы которых построены из остатков α-аминокислот, соединённых в
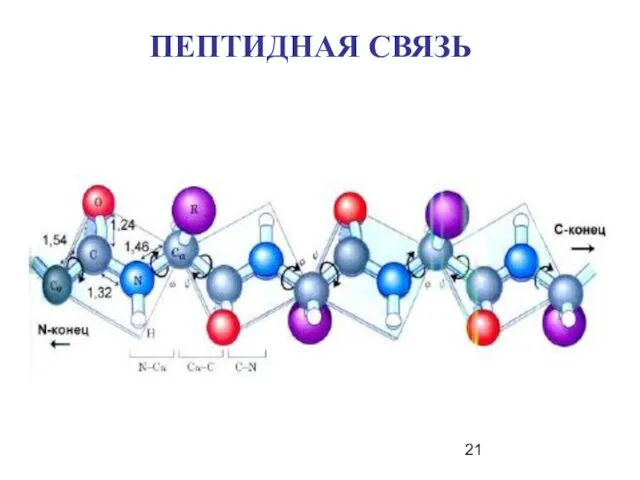
- 21. ПЕПТИДНАЯ СВЯЗЬ
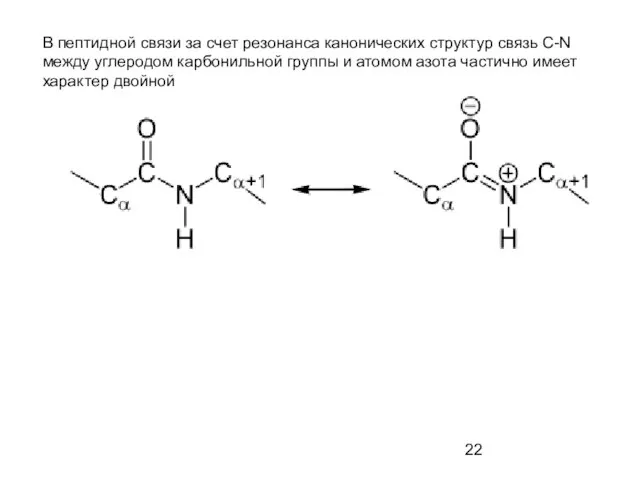
- 22. В пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом
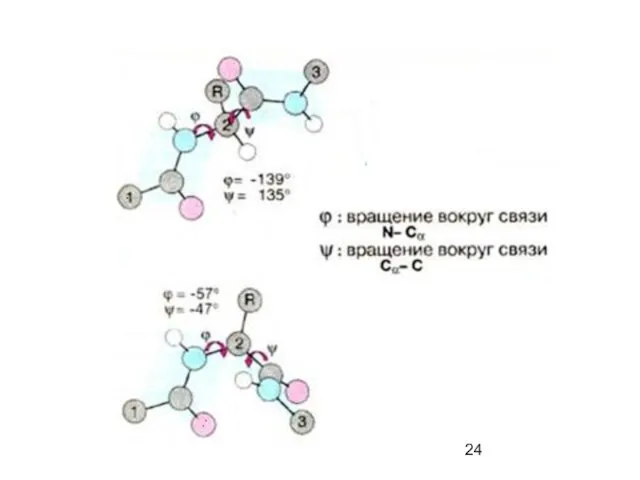
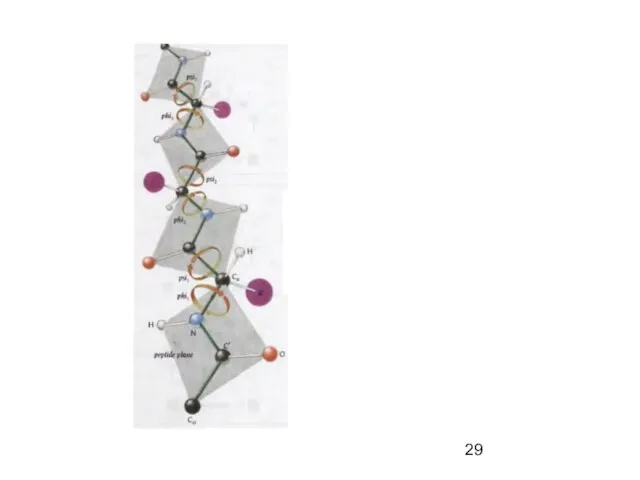
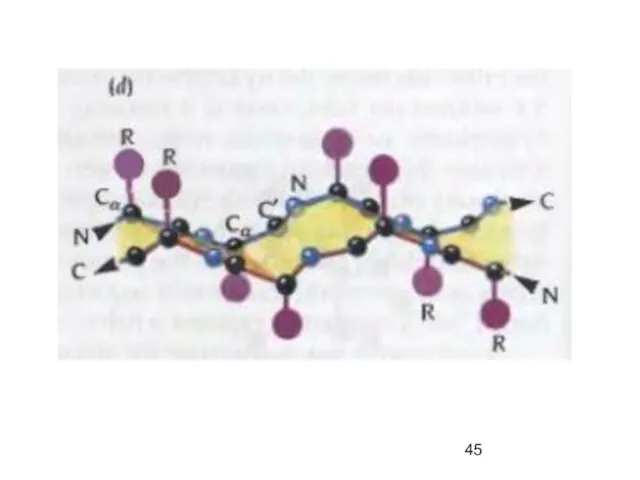
- 23. Пептидная связь представляет собой связь, с длиной 1,32А, вращение вокруг нее невозможно. 6 атомов, расположенных рядом
- 25. Пептиды классифицируются в соответствии с числом аминокислотных остатков в цепи: дипептиды, трипептиды, тетрапептиды и т.д. Аминокислота
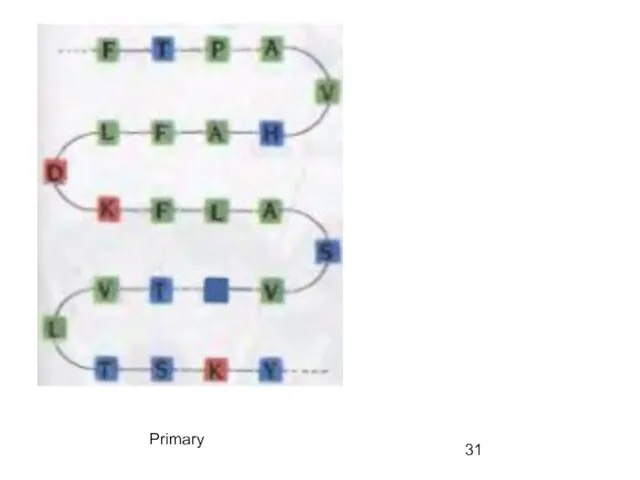
- 31. Primary
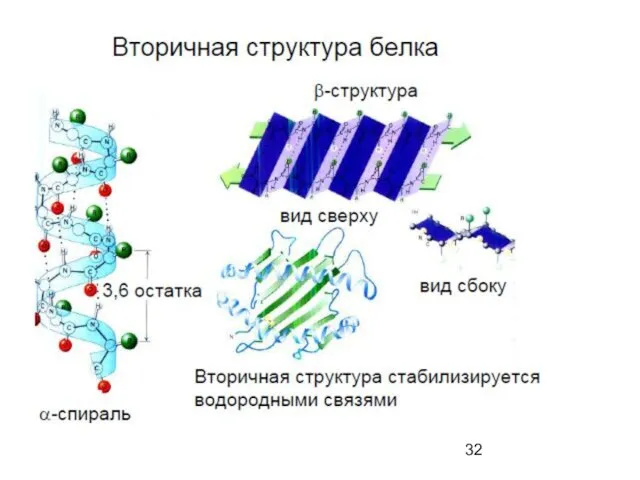
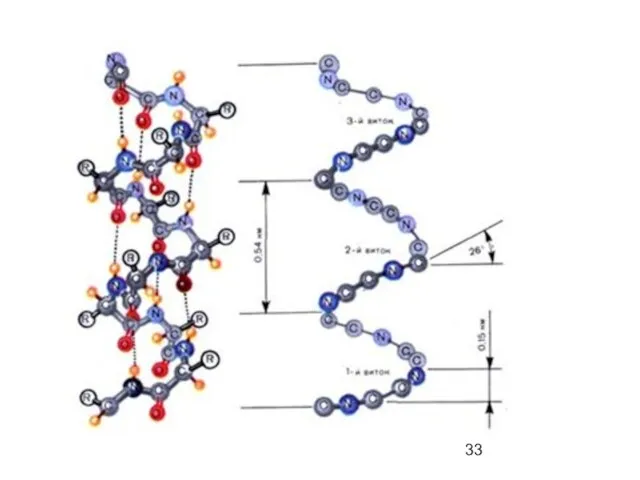
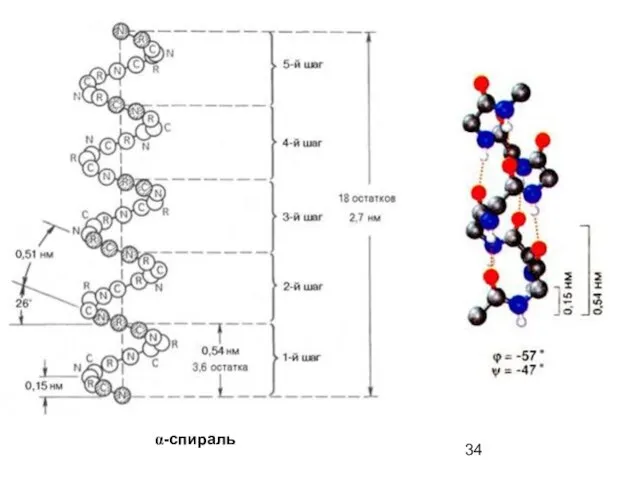
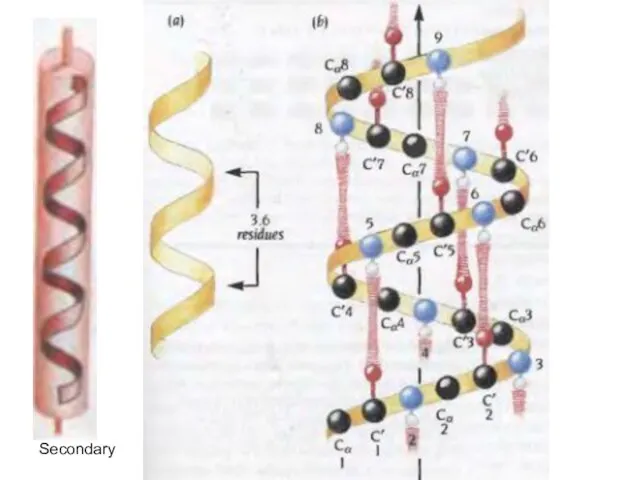
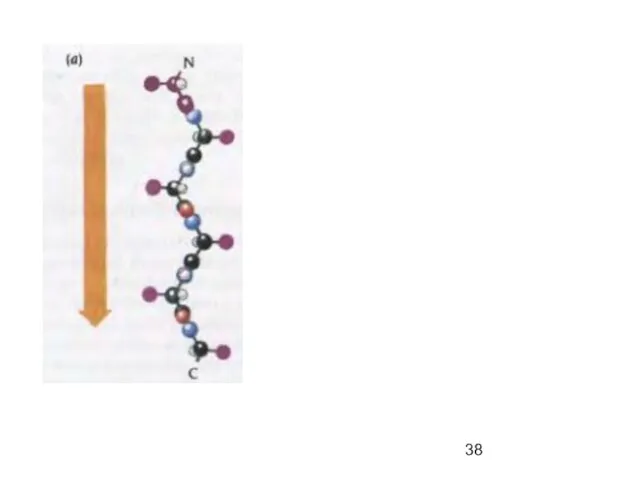
- 34. α-спираль
- 37. Secondary
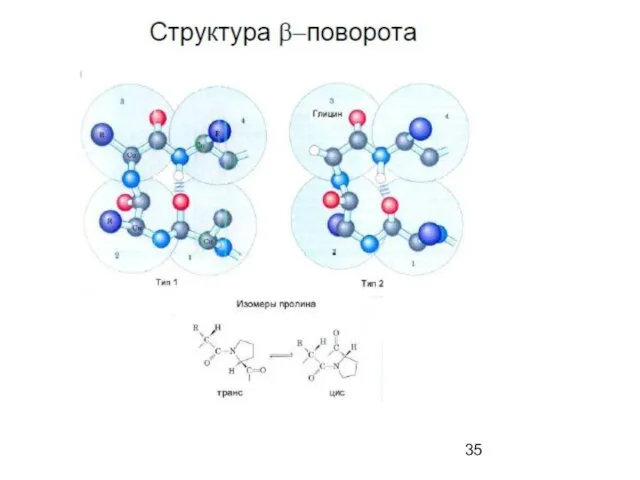
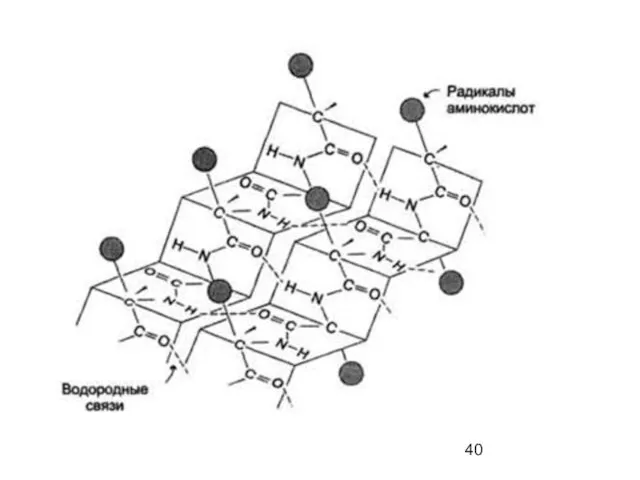
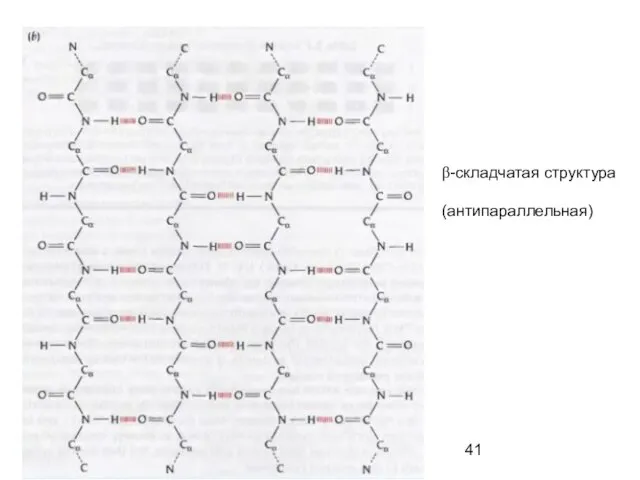
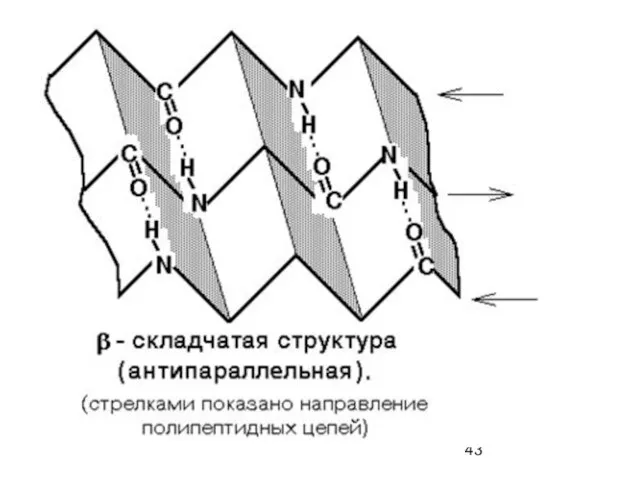
- 39. β-складчатый лист" - плоскости пептидных связей расположены в пространстве подобно равномерным складкам листа бумаги. B складчатых
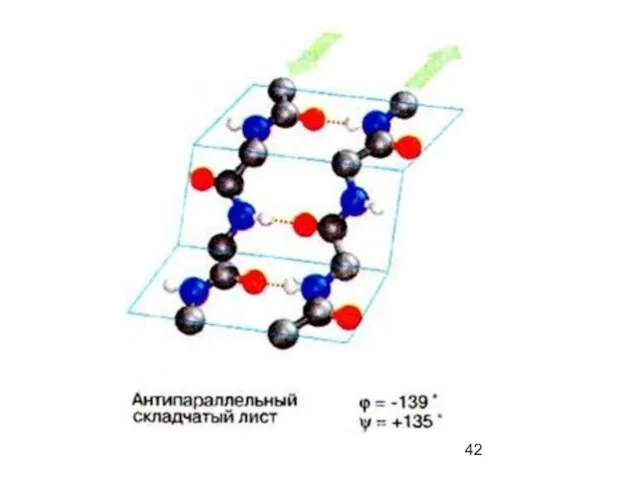
- 41. β-складчатая структура (антипараллельная)
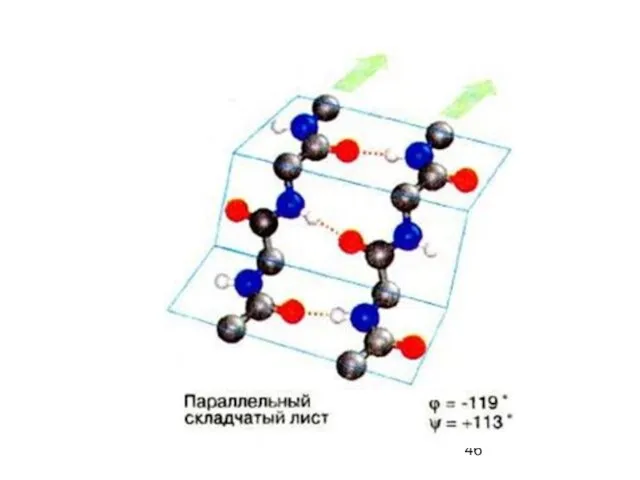
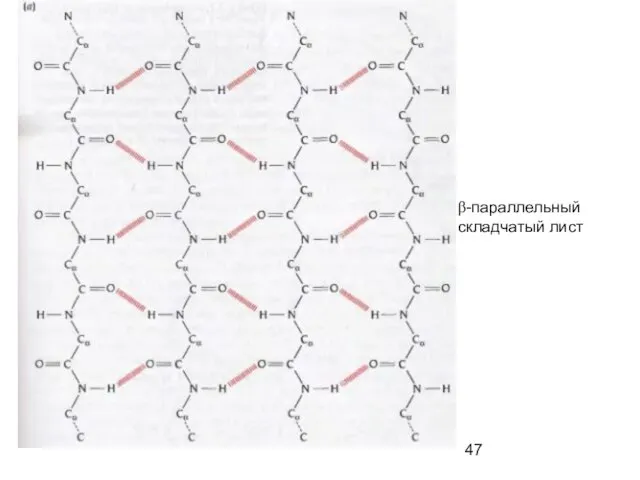
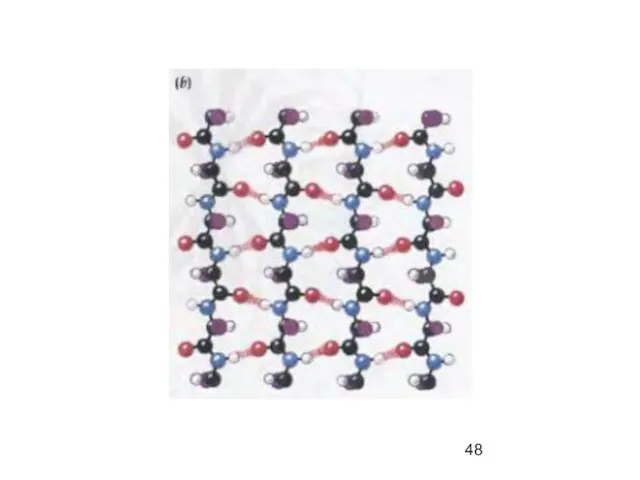
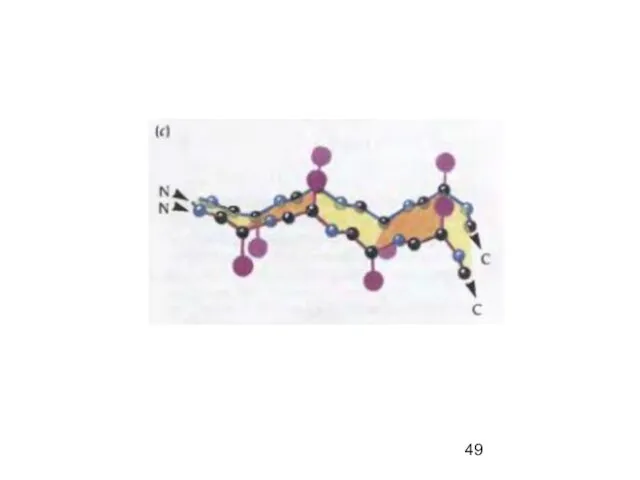
- 47. β-параллельный складчатый лист
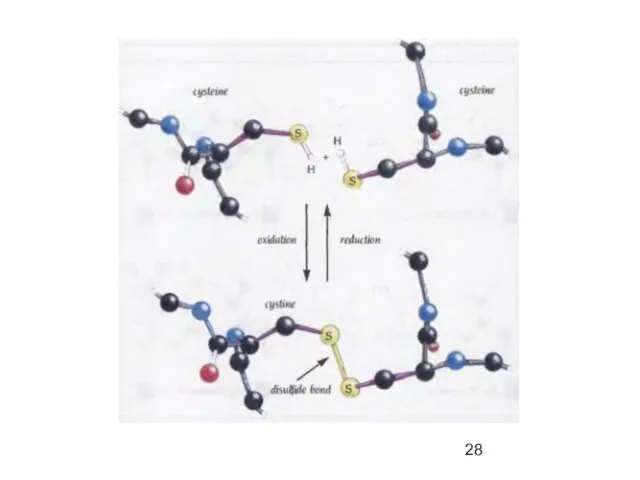
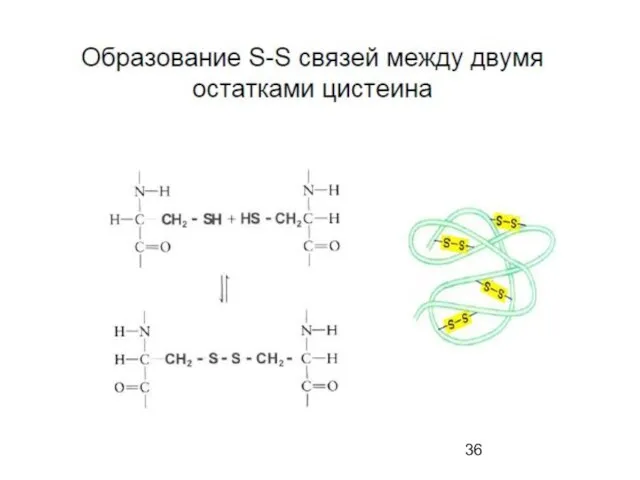
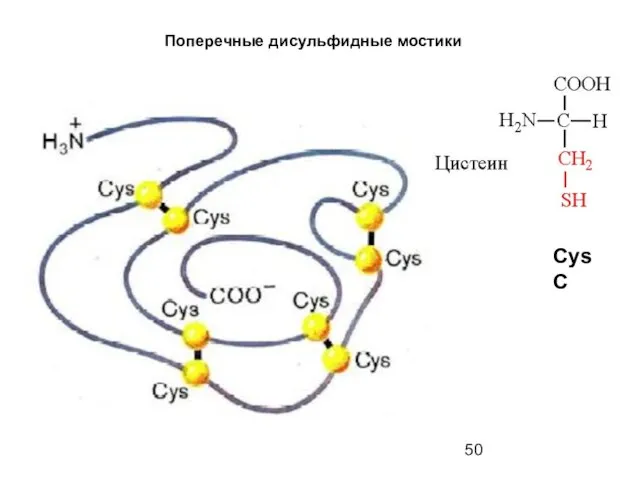
- 50. Поперечные дисульфидные мостики Cys C
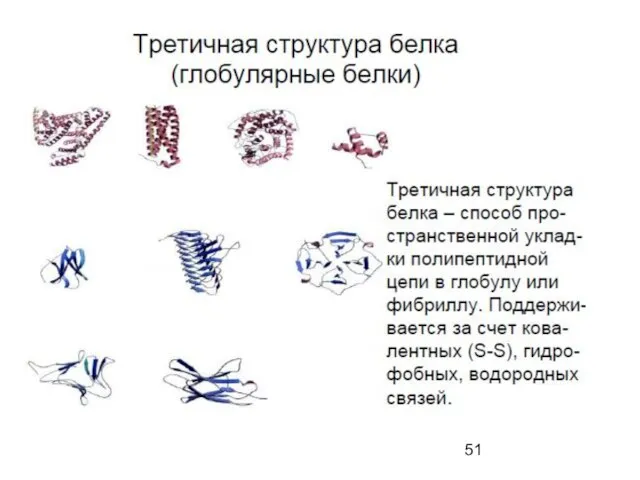
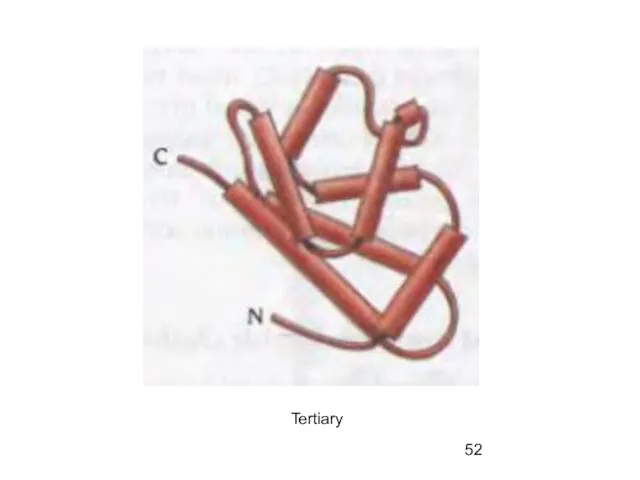
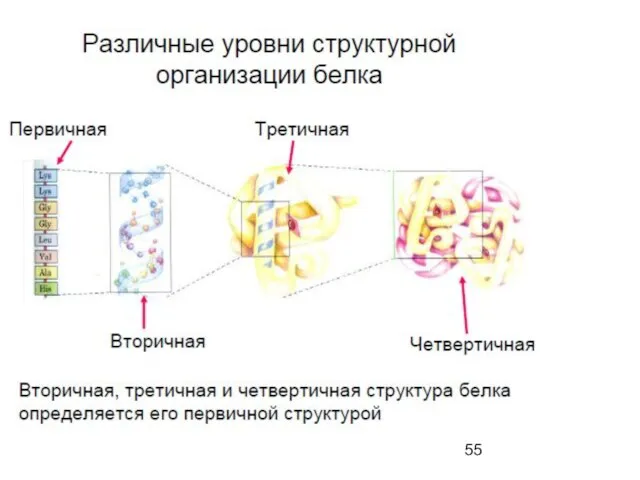
- 52. Tertiary
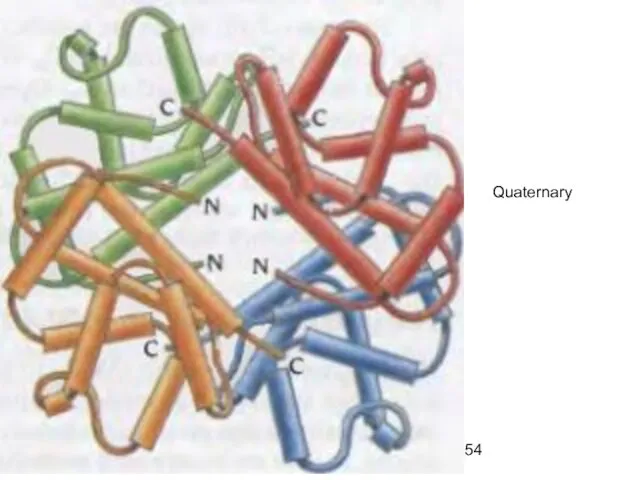
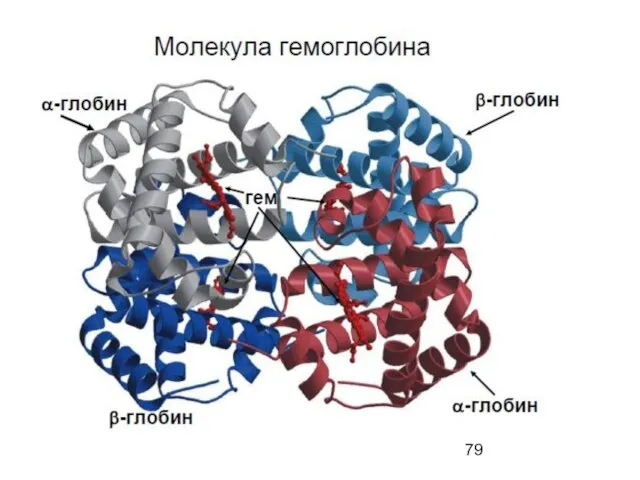
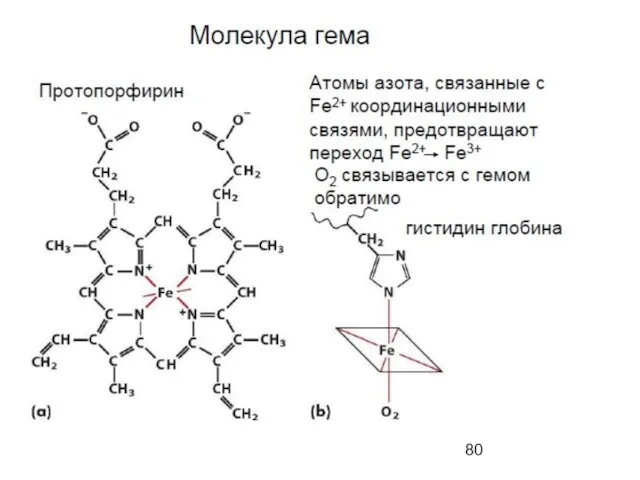
- 54. Quaternary
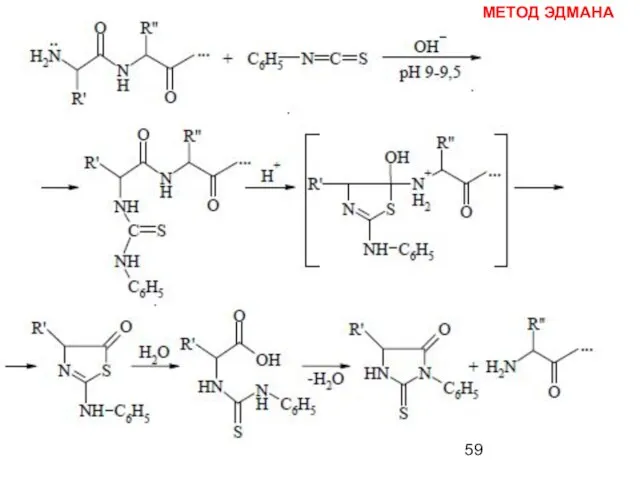
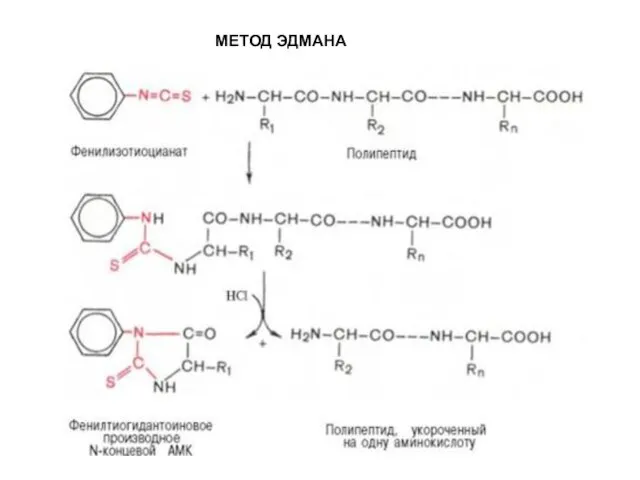
- 58. МЕТОД ЭДМАНА Метод Эдмана (метод ступенчатой деструкции, 1950 г.) К аминогруппе Ν-концевой α-аминокислоты присоединяют фенилизотиоцианат (ФИТЦ),
- 59. МЕТОД ЭДМАНА
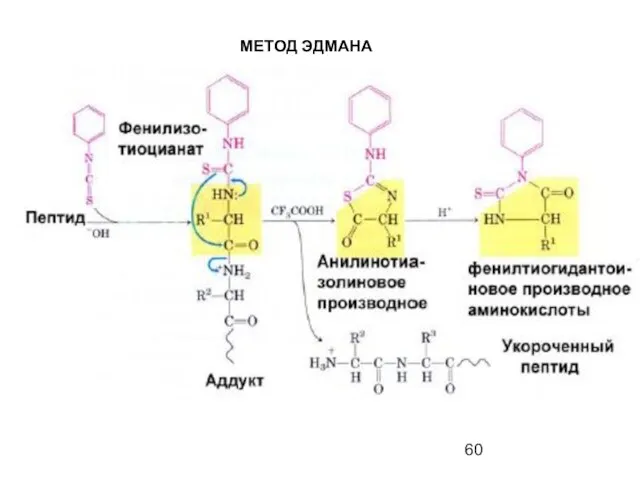
- 60. МЕТОД ЭДМАНА
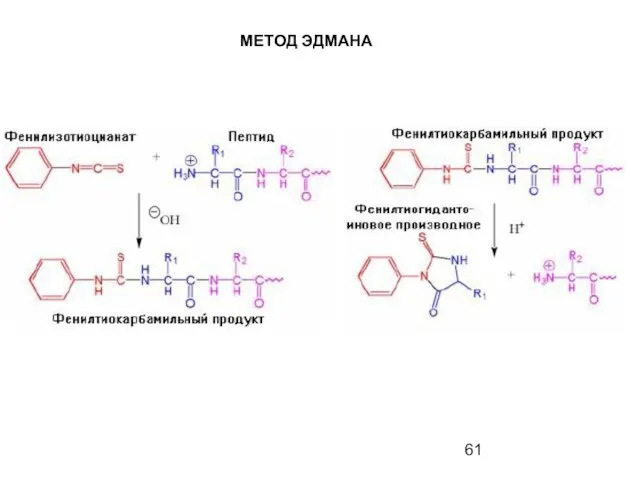
- 61. МЕТОД ЭДМАНА
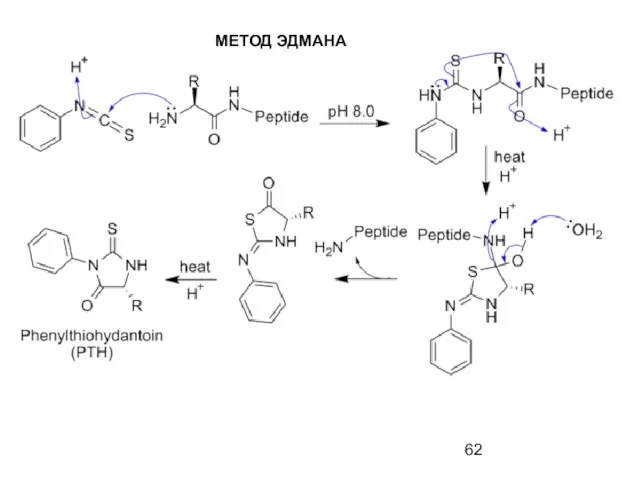
- 62. МЕТОД ЭДМАНА
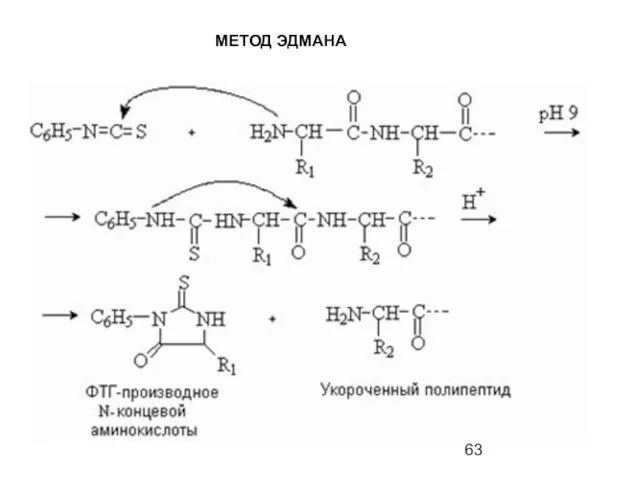
- 63. МЕТОД ЭДМАНА
- 64. МЕТОД ЭДМАНА
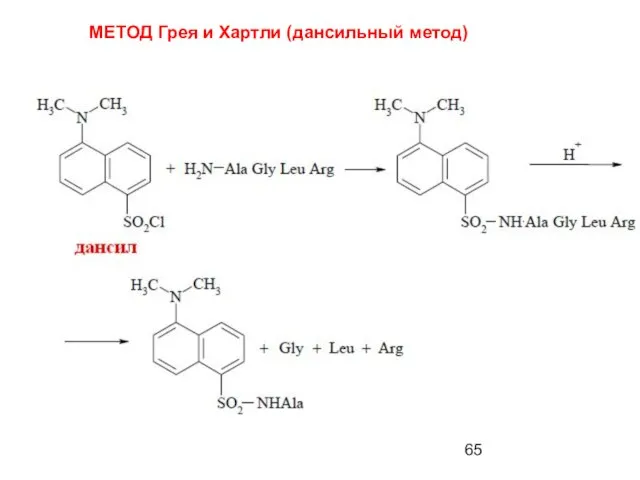
- 65. МЕТОД Грея и Хартли (дансильный метод)
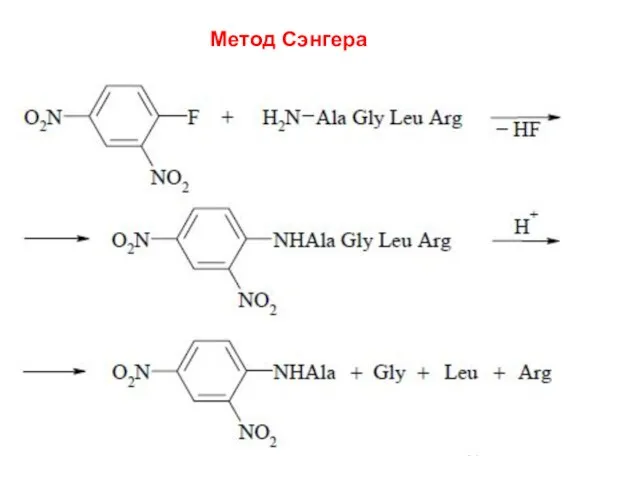
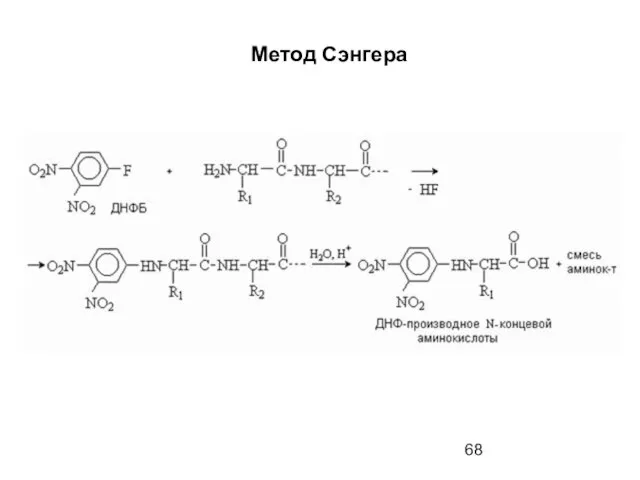
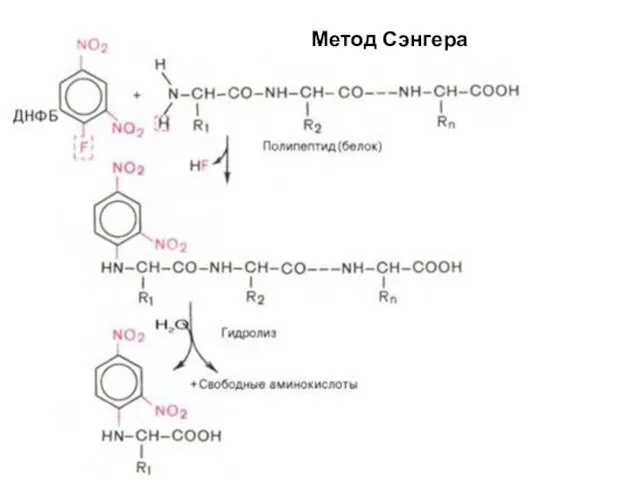
- 66. Метод Сэнгера (F. Sanger) основан на реакции арилирования полипептида 2,4-динитрофторбензолом (ДНФБ), что приводит к образованию окрашенного
- 67. Метод Сэнгера
- 68. Метод Сэнгера
- 69. Метод Сэнгера
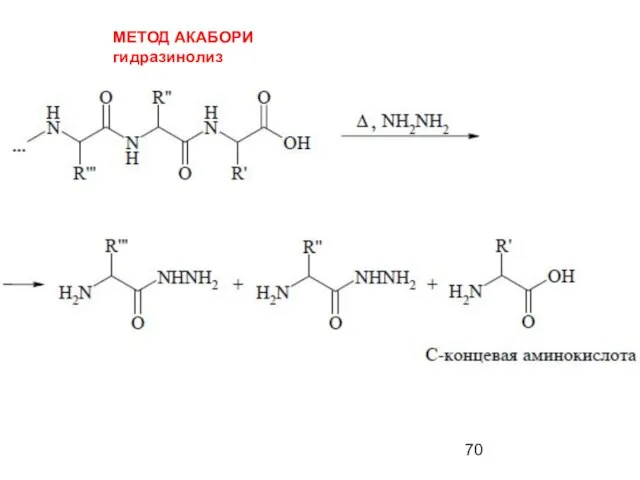
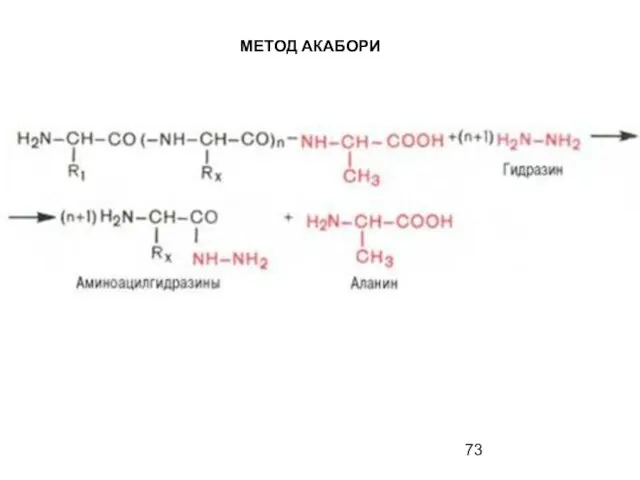
- 70. МЕТОД АКАБОРИ гидразинолиз
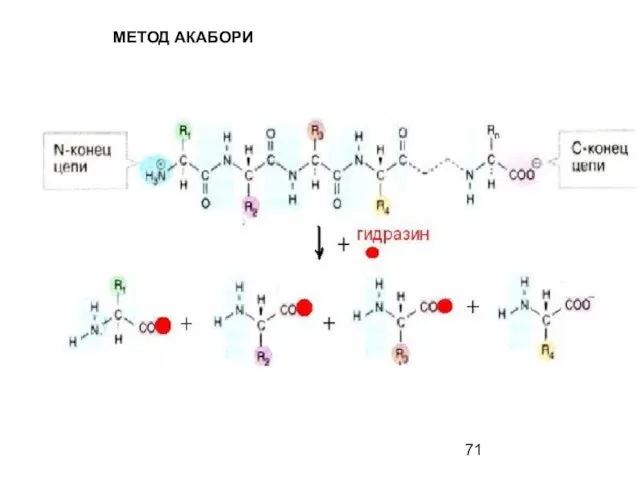
- 71. МЕТОД АКАБОРИ
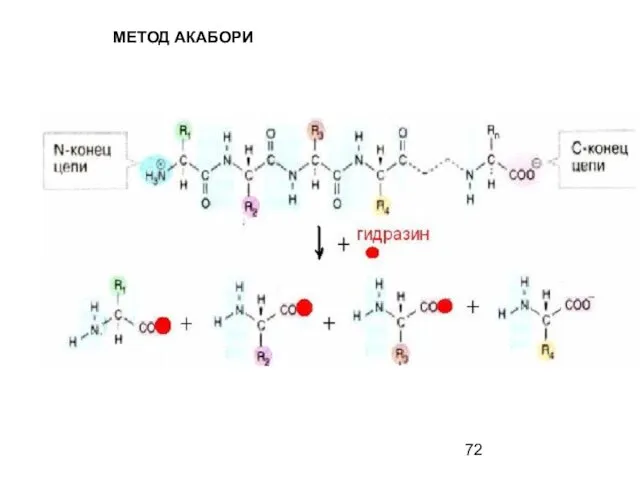
- 72. МЕТОД АКАБОРИ
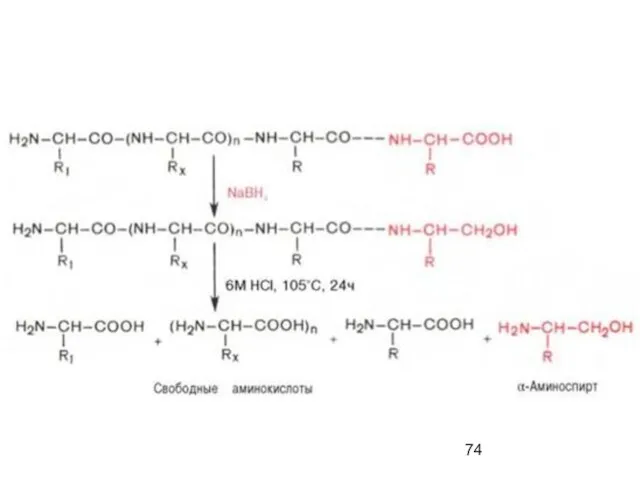
- 73. МЕТОД АКАБОРИ
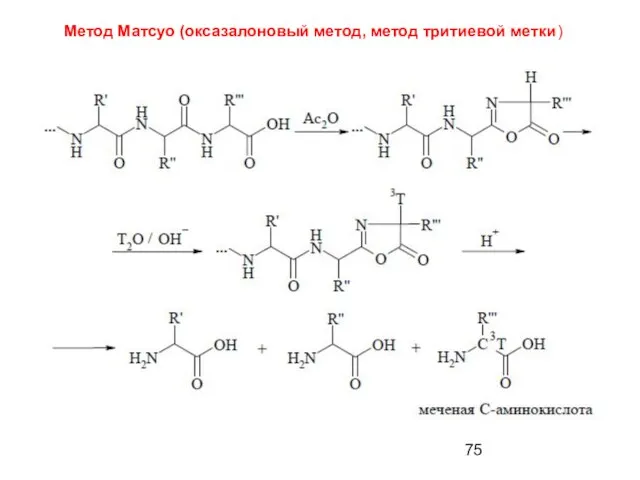
- 75. Метод Матсуо (оксазалоновый метод, метод тритиевой метки)
- 95. Скачать презентацию

















 Гражданская война 1918-1921гг
Гражданская война 1918-1921гг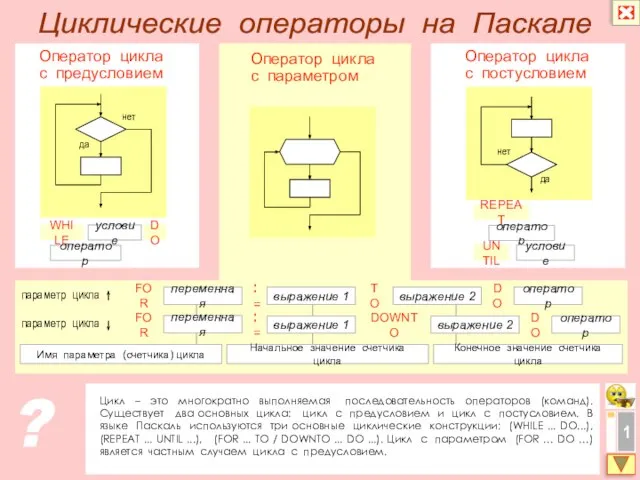 Циклические операторы на Паскале
Циклические операторы на Паскале Надо видеть себя в детях, чтобы помочь стать взрослыми, надо принимать их как повторение своего де
Надо видеть себя в детях, чтобы помочь стать взрослыми, надо принимать их как повторение своего де «ПОСТРОЕНИЕ ИЗОБРАЖЕНИЯ В ЛИНЗАХ»
«ПОСТРОЕНИЕ ИЗОБРАЖЕНИЯ В ЛИНЗАХ» Мировые религии в современном обществе
Мировые религии в современном обществе Точки на прямой
Точки на прямой 10 класс. Алгебра. Урок – математическое кафе.
10 класс. Алгебра. Урок – математическое кафе. Школа здоровья – повышение качества образования
Школа здоровья – повышение качества образования Элементы партизанского маркетинга в клиентском обслуживании
Элементы партизанского маркетинга в клиентском обслуживании Иван Матвеевич Виноградов
Иван Матвеевич Виноградов Элементы росписи оятской керамики. Часть 2
Элементы росписи оятской керамики. Часть 2 Биологические материалы и их механические свойства. Зубы.
Биологические материалы и их механические свойства. Зубы. биология
биология Управление человеческими ресурсами в организации
Управление человеческими ресурсами в организации Пропедевтика. Осмотр больных с заболеваниями органов кроветворения. Пальпация и перкуссия селезенки
Пропедевтика. Осмотр больных с заболеваниями органов кроветворения. Пальпация и перкуссия селезенки С Новым Годом, мама и папа
С Новым Годом, мама и папа Участие муниципального образования « Выборгский район» Ленинградской области в международном и приграничном сотрудничестве
Участие муниципального образования « Выборгский район» Ленинградской области в международном и приграничном сотрудничестве КЛУБ «ПОЛЕМИСТ»
КЛУБ «ПОЛЕМИСТ» В мире чисел
В мире чисел 996ec436602c4eebbe3536dfd2f932bc (1)
996ec436602c4eebbe3536dfd2f932bc (1) Короткая дистанция (2)
Короткая дистанция (2) Мариинский театр. Владивосток
Мариинский театр. Владивосток Театрализованные игры в детском саду
Театрализованные игры в детском саду Презентация на тему Что такое дисциплина 7 класс
Презентация на тему Что такое дисциплина 7 класс Возникновение Санкт-Петербурга и зарождение его культуры
Возникновение Санкт-Петербурга и зарождение его культуры Современные здания Санкт-Петербурга: Архитектура Петербурга в XXI веке
Современные здания Санкт-Петербурга: Архитектура Петербурга в XXI веке Гимнастика
Гимнастика Радуга бисера и азбука бисероплетения
Радуга бисера и азбука бисероплетения