Содержание
- 2. 1. Классификация 1.1. по положению аминогруппы 25.04.2012
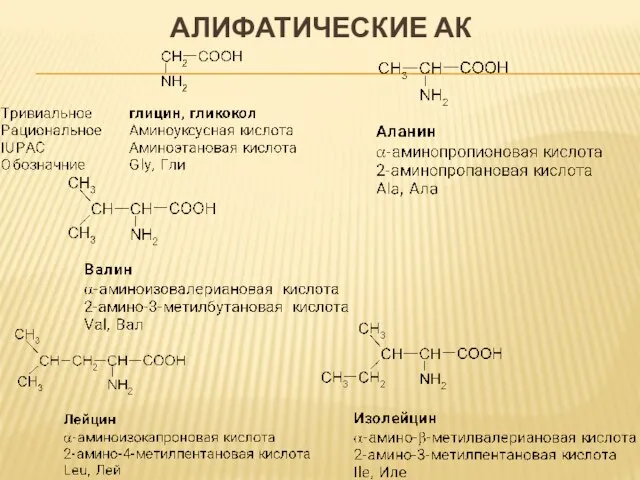
- 3. 1.2. По количеству карбокси- и аминогрупп Моноаминомонокарбоновые кислоты (глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин,
- 4. 1.3 Классификация по встречаемости в белках 25.04.2012 20 классических протеиногенных аминокислот, информация о положении которых в
- 5. 1.4. По пищевой ценности для человека Аминокислоты делятся на заменимые и незаменимые. К незаменимым аминокислотам относят:
- 6. АЛИФАТИЧЕСКИЕ АК
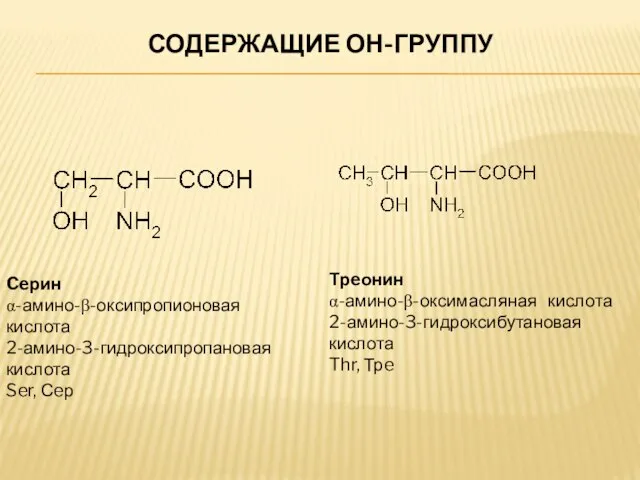
- 7. СОДЕРЖАЩИЕ ОН-ГРУППУ Ceрин α-амино-β-оксипропионовая кислота 2-амино-3-гидроксипропановая кислота Ser, Сeр Трeонин α-амино-β-оксимасляная кислота 2-амино-3-гидроксибутановая кислота Thr, Трe
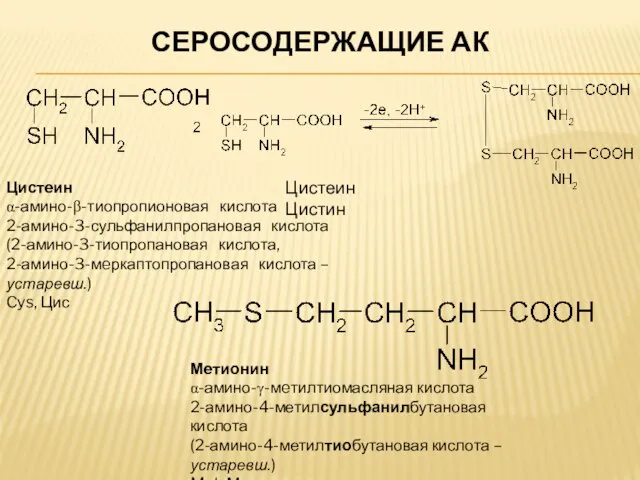
- 8. СЕРОСОДЕРЖАЩИЕ АК Цистеин Цистин Мeтионин α-амино-γ-мeтилтиомасляная кислота 2-амино-4-метилсульфанилбутановая кислота (2-амино-4-метилтиобутановая кислота – устаревш.) Met, Мет. Цистeин
- 9. МОНОАМИНОДИКАРБОНОВЫЕ КИСЛОТЫ И ИХ АМИДЫ Аспарагиновая кислота Аминоянтарная кислота Аминобутандиовая кислота Asp, Асп Глутаминовая кислота α-aминоглутаровая
- 10. СОДЕРЖАЩИЕ АМИНОГРУППУ Лизин α,ε-диаминокапроновая кислота 2,6-диаминогексановая кислота Lys, Лиз Аргинин α-амино-δ-гуанидилвалериановая кислота 2-амино-5-[амино(имино)метил]аминопентановая к-та Arg, Арг
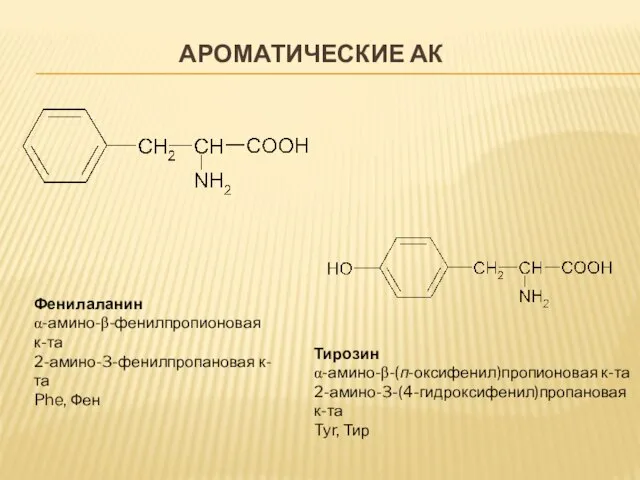
- 11. АРОМАТИЧЕСКИЕ АК Фенилаланин α-амино-β-фенилпропионовая к-та 2-амино-3-фенилпропановая к-та Phe, Фен Тирозин α-амино-β-(п-оксифенил)пропионовая к-та 2-амино-3-(4-гидроксифенил)пропановая к-та Tyr, Тир
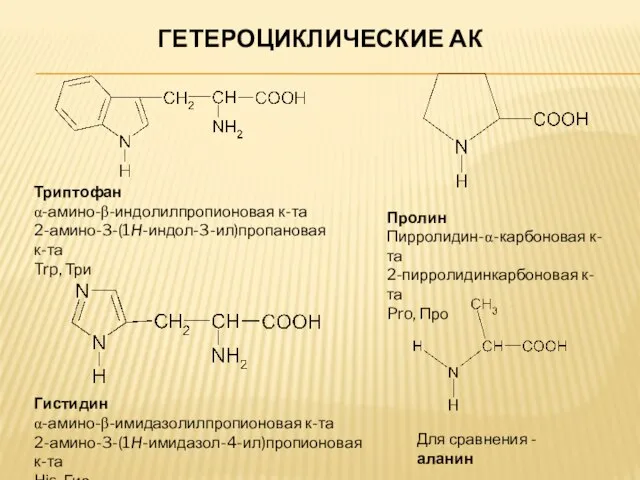
- 12. ГЕТЕРОЦИКЛИЧЕСКИЕ АК Триптофан α-амино-β-индолилпропионовая к-та 2-амино-3-(1H-индол-3-ил)пропановая к-та Trp, Три Гистидин α-амино-β-имидазолилпропионовая к-та 2-амино-3-(1H-имидазол-4-ил)пропионовая к-та His, Гис
- 13. 2. Номенклатура 2.1. Тривиальная номенклатура в основном используется для широко распространённых аминокислот. 2.2. Рациональная 2.3. IUPAC
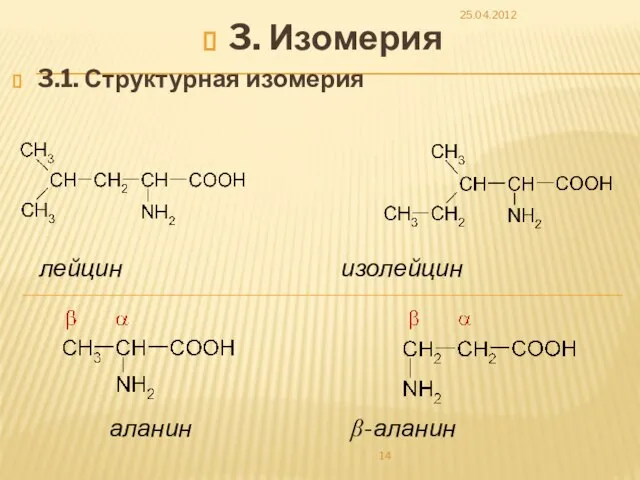
- 14. 3. Изомерия 3.1. Структурная изомерия 25.04.2012 лейцин изолейцин аланин β-аланин
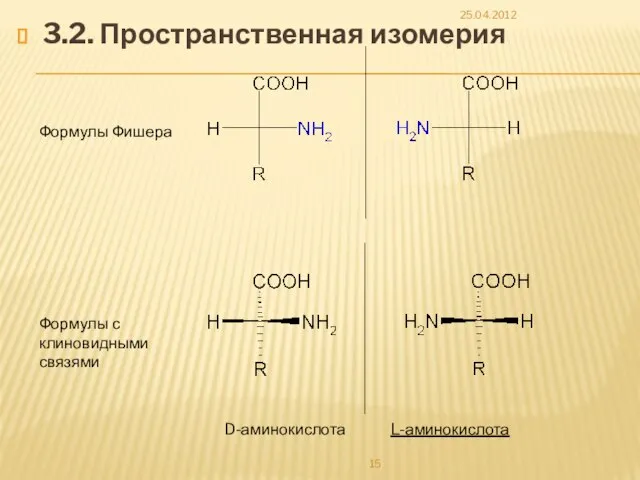
- 15. 3.2. Пространственная изомерия 25.04.2012 D-аминокислота L-аминокислота Формулы Фишера Формулы с клиновидными связями
- 16. 4. Физические свойства Аминокислоты, как правило, являются бесцветными кристаллическими соединениями. Большинство из них умеренно растворимы в
- 17. 5. Биологические свойства Из остатков аминокислот построены такие важные соединения как белки, которые участвуют практически во
- 18. うま味 Умами - “мясной вкус” 25.04.2012 Глутаминовая кислота (E620) и её соли (глутамат натрия Е621, глутамат
- 19. Глутаминовая кислота и её соли безопасны J Nutr. 2000 Apr;130(4S Suppl):1049S-52S. The safety evaluation of monosodium
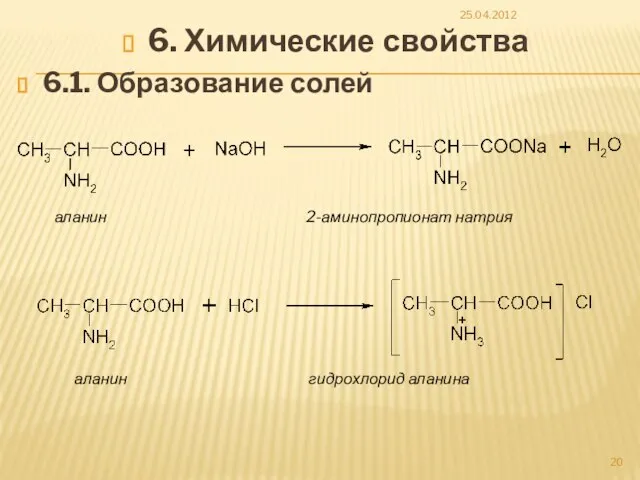
- 20. 6. Химические свойства 6.1. Образование солей 25.04.2012 аланин 2-аминопропионат натрия аланин гидрохлорид аланина
- 21. 25.04.2012 Аминогруппа нейтрализует карбоксильную группу, поэтому АК в твёрдом виде и в растворе при pH =
- 22. 25.04.2012 Сильнокислая среда Почти нейтральная Сильнощелочная среда Для моноаминомонокарбоновых кислот pI ≈ 5-6 pI моноаминодикарбоновых кислот
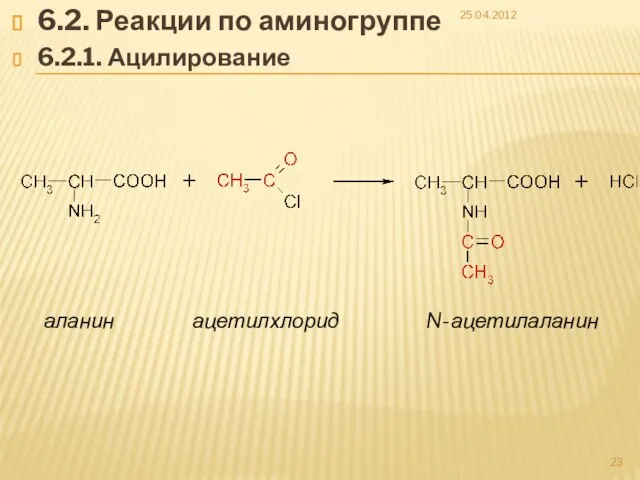
- 23. 6.2. Реакции по аминогруппе 6.2.1. Ацилирование 25.04.2012 аланин ацетилхлорид N-ацетилаланин
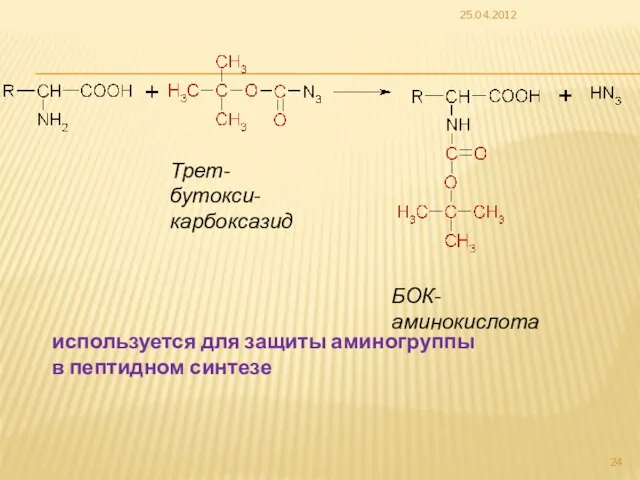
- 24. 25.04.2012 БОК-аминокислота Трет-бутокси-карбоксазид используется для защиты аминогруппы в пептидном синтезе
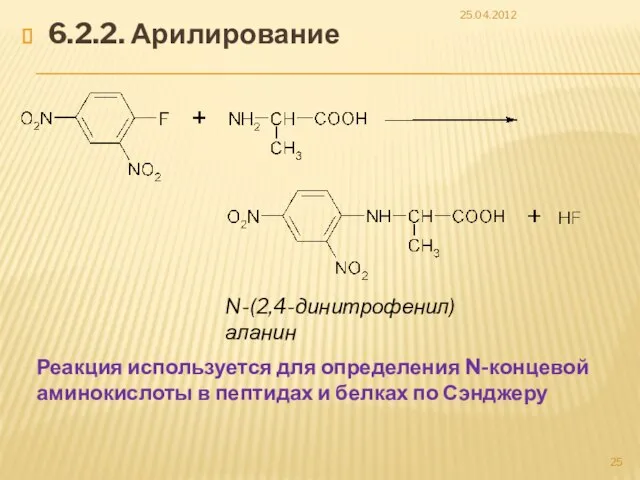
- 25. 6.2.2. Арилирование 25.04.2012 N-(2,4-динитрофенил)аланин Реакция используется для определения N-концевой аминокислоты в пептидах и белках по Сэнджеру
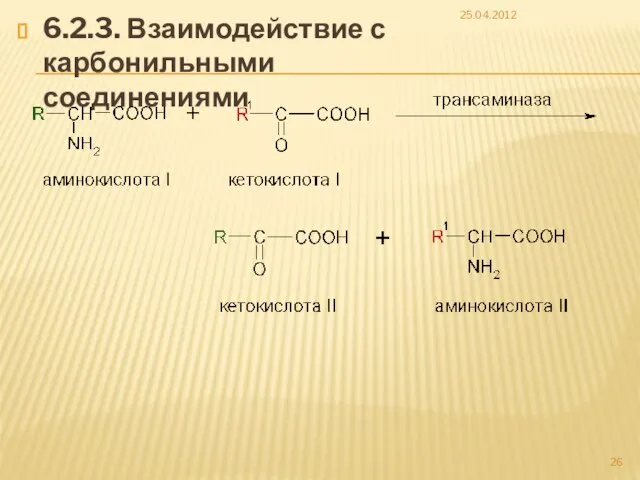
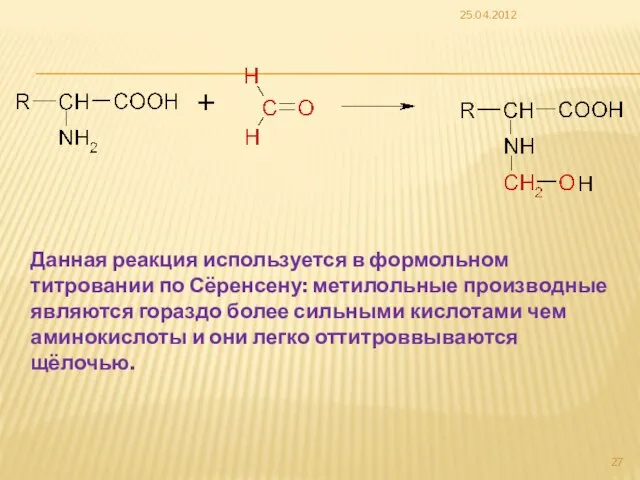
- 26. 6.2.3. Взаимодействие с карбонильными соединениями 25.04.2012
- 27. 25.04.2012 Данная реакция используется в формольном титровании по Сёренсену: метилольные производные являются гораздо более сильными кислотами
- 28. 6.2.4. Взаимодействие с азотистой кислотой 25.04.2012 α -аминокислота α-гидроксикислота Реакция с азотистой кислотой используется определения аминокислот
- 29. 6.2. Реакции по карбоксильной группе 25.04.2012 Реакция используется для защиты карбоксильной группы в синтезе пептидов
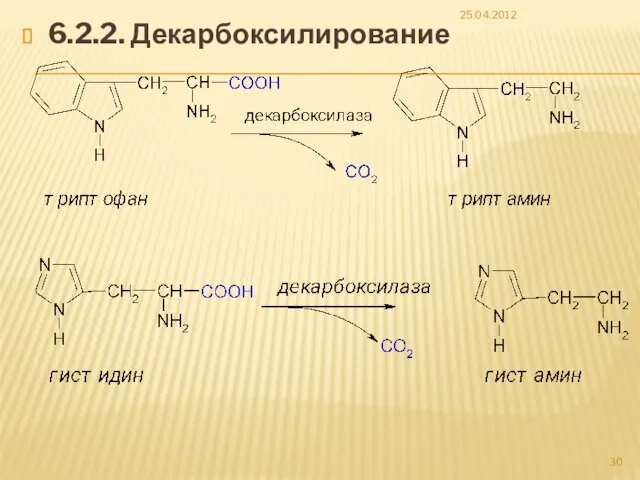
- 30. 6.2.2. Декарбоксилирование 25.04.2012
- 31. 25.04.2012
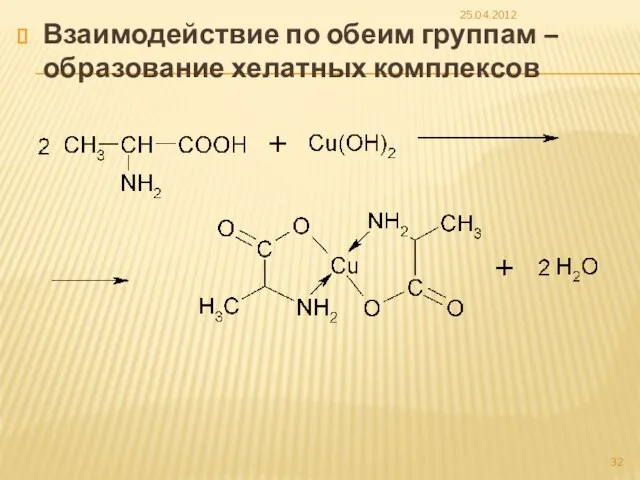
- 32. Взаимодействие по обеим группам – образование хелатных комплексов 25.04.2012
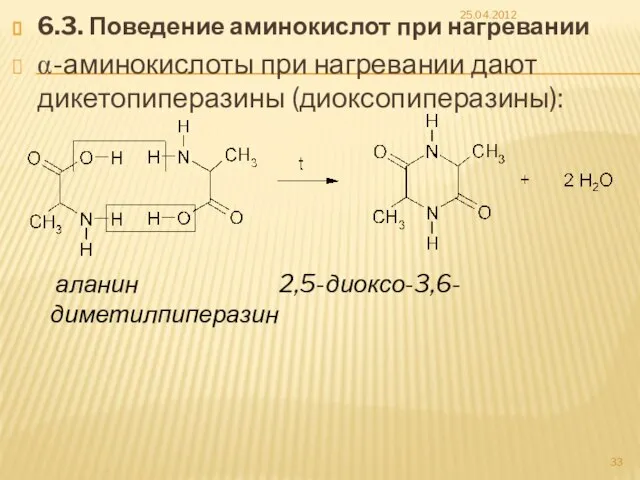
- 33. 6.3. Поведение аминокислот при нагревании α-аминокислоты при нагревании дают дикетопиперазины (диоксопиперазины): 25.04.2012 аланин 2,5-диоксо-3,6-диметилпиперазин
- 34. β-аминокислоты при нагревании отщепляют воду (реакция элиминирования), образуя ненасыщенные кислоты: 25.04.2012 β-аминопропионовая пропеновая (акриловая) кислота кислота
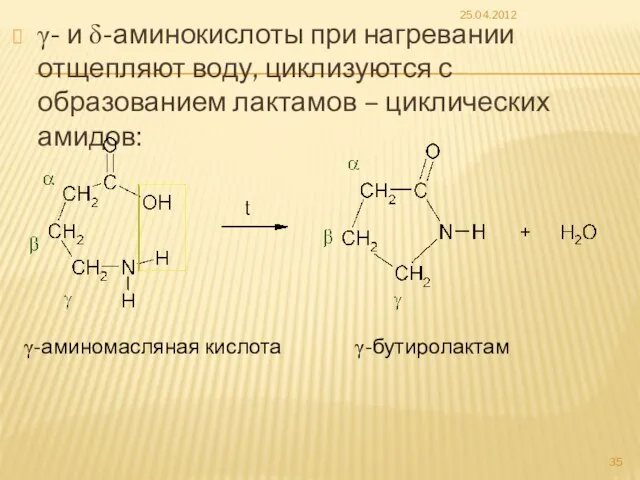
- 35. γ- и δ-аминокислоты при нагревании отщепляют воду, циклизуются с образованием лактамов – циклических амидов: 25.04.2012 γ-аминомасляная
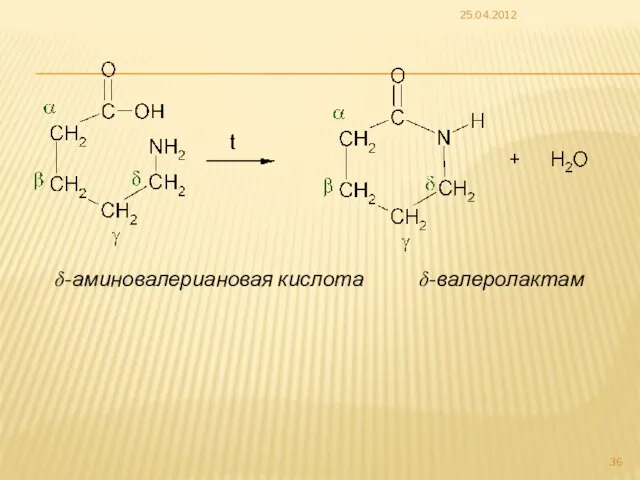
- 36. 25.04.2012 δ-аминовалериановая кислота δ-валеролактам
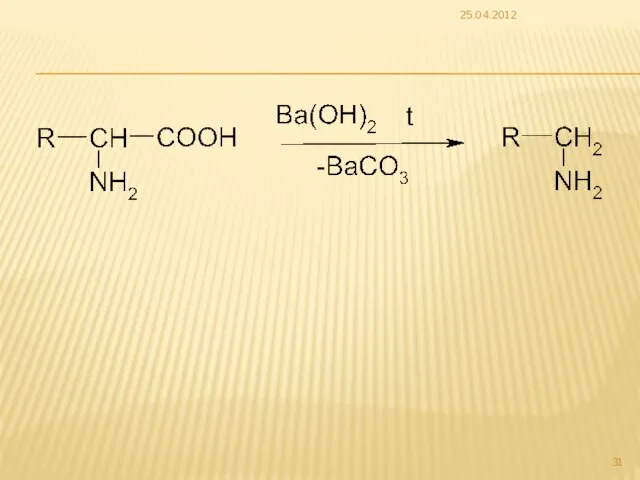
- 37. 7. Получение аминокислот 7.1. Выделение из белков и пептидов Белки гидролизуют в присутствии кислот (6 М
- 38. 7.3. Пребиотический (абиогенный) синтез аминокислот CH4, NH3, H2, H2O, HCN, H2S, CH2O УФ-излучение, электрический разряд, радиация
- 39. Proc Natl Acad Sci U S A. 2011 Apr 5;108(14):5526-31. Epub 2011 Mar 21. Primordial synthesis
- 40. 25.04.2012 http://ru.wikipedia.org/wiki/Миллер,_стенли_ллойд
- 41. Orig Life Evol Biosph. 2011 Apr 12. [Epub ahead of print] Catalytic effects of Murchison Material:
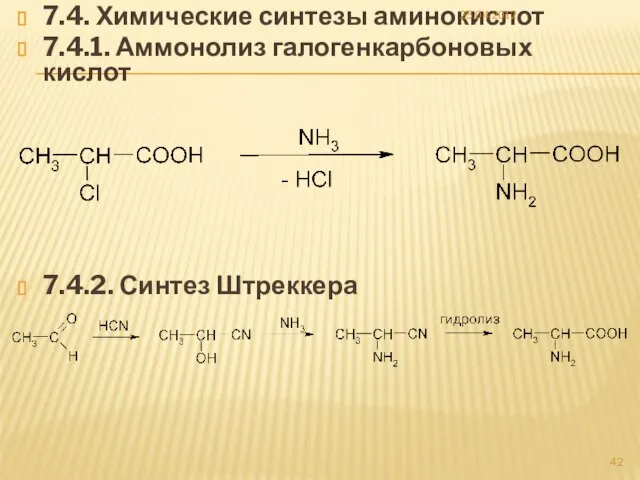
- 42. 7.4. Химические синтезы аминокислот 7.4.1. Аммонолиз галогенкарбоновых кислот 7.4.2. Синтез Штреккера 25.04.2012
- 43. ПЕПТИДЫ И БЕЛКИ Пептиды и белки - продукты поликонденсации аминокислот. Мr пептидов меньше 10000, у белков
- 44. ПЕПТИДЫ И БЕЛКИ Пептиды (πεπτος - сваренный) – первоначально - продукты неполного гидролиза белков Белки –
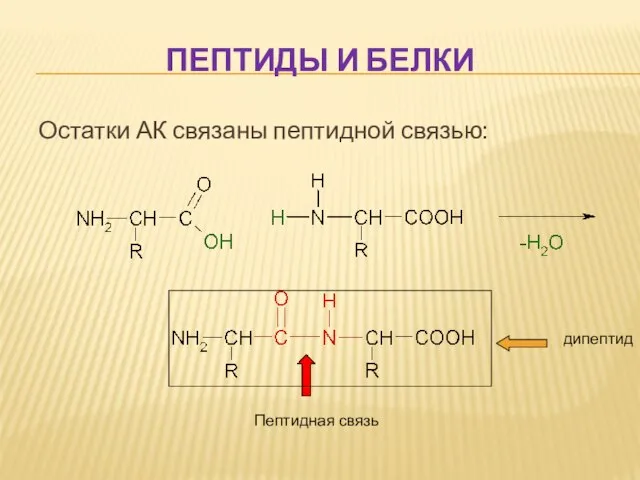
- 45. ПЕПТИДЫ И БЕЛКИ Остатки АК связаны пептидной связью: Пептидная связь дипептид
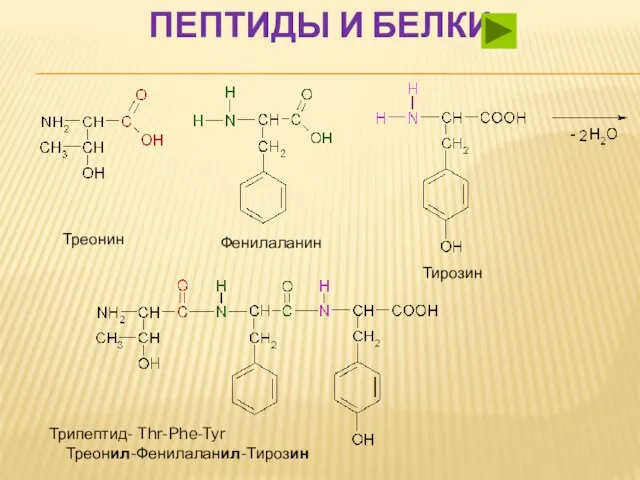
- 46. ПЕПТИДЫ И БЕЛКИ Треонин Фенилаланин Тирозин Трипептид- Thr-Phe-Tyr Треонил-Фенилаланил-Тирозин
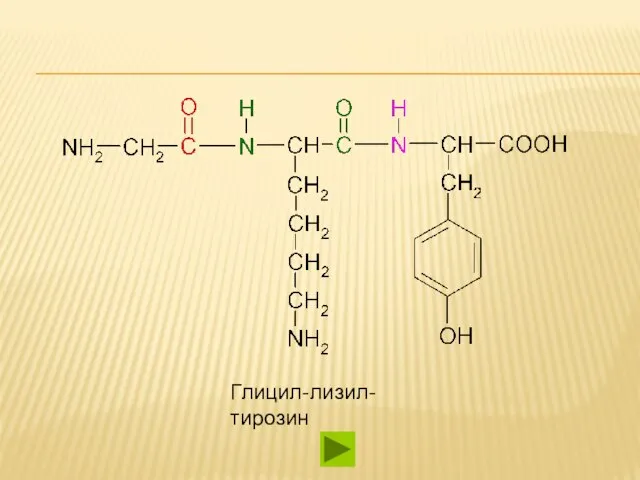
- 47. Глицил-лизил-тирозин
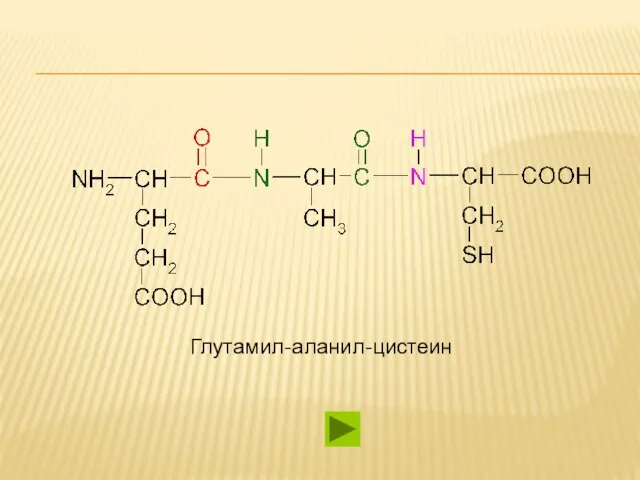
- 48. Глутамил-аланил-цистеин
- 49. ПЕПТИДНАЯ СВЯЗЬ Пространственное строение 1. Все атомы находятся в одной плоскости 2. Почти всегда атомы водорода
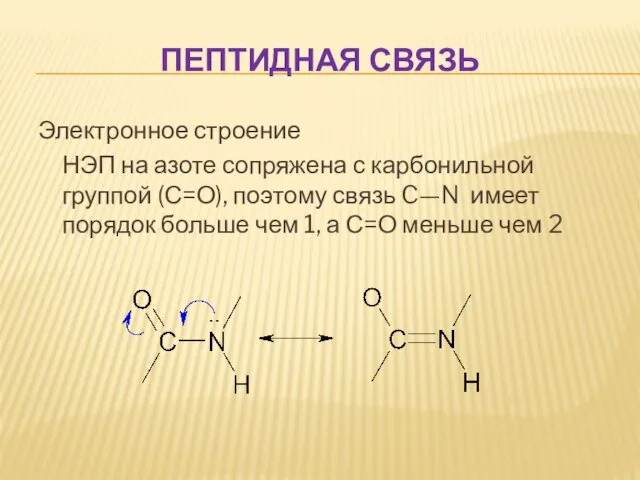
- 50. ПЕПТИДНАЯ СВЯЗЬ Электронное строение НЭП на азоте сопряжена с карбонильной группой (С=О), поэтому связь C—N имеет
- 51. ПЕПТИДЫ И БЕЛКИ Как и аминокислоты, пептиды и белки являются амфотерными соединениями, содержащими и кислотные группы
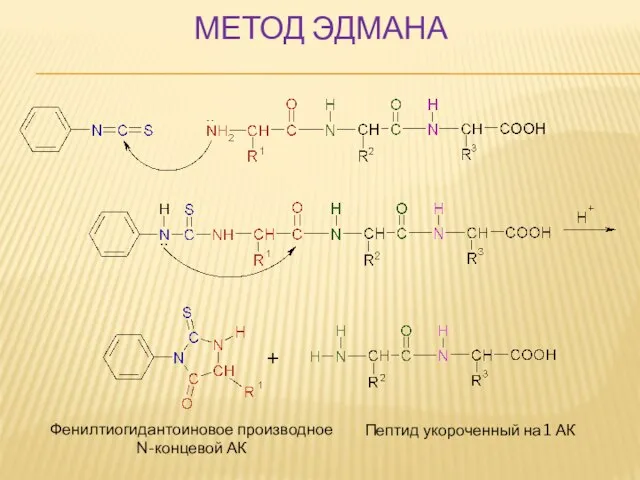
- 52. АНАЛИЗ ПЕРВИЧНОЙ СТРУКТУРЫ ПЕПТИДОВ МЕТОД ЭДМАНА Используя фенилизотиоцианат (Ph-NCS) последовательно отщепляют АК с N-конца и определяют
- 53. МЕТОД ЭДМАНА Фенилтиогидантоиновое производное N-концевой АК Пептид укороченный на 1 АК
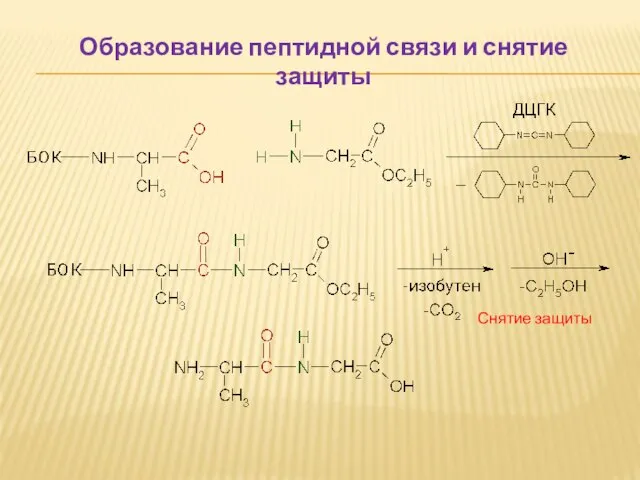
- 54. СИНТЕЗ ПЕПТИДОВ И БЕЛКОВ Защита аминогруппы (БОК-защита) Защита карбоксильной группы (образование сложных эфиров) Образование пептидной связи
- 55. Снятие защиты Образование пептидной связи и снятие защиты
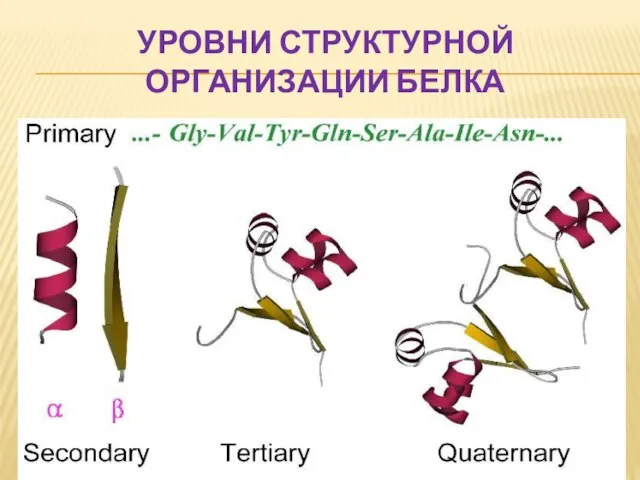
- 56. УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКА первичная структура – аминокислотная последовательность вторичная структура – локальные высокоупорядоченные конформации белковой
- 57. УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКА
- 58. ПЕРВИЧНАЯ СТРУКТУРА первичная структура –последовательность аминокислотных остатков в молекуле белка или пептида. NH2-Tyr-Pro-Lys-Gly-Phe-Tyr-Lys-COOH Первичная структура определяет
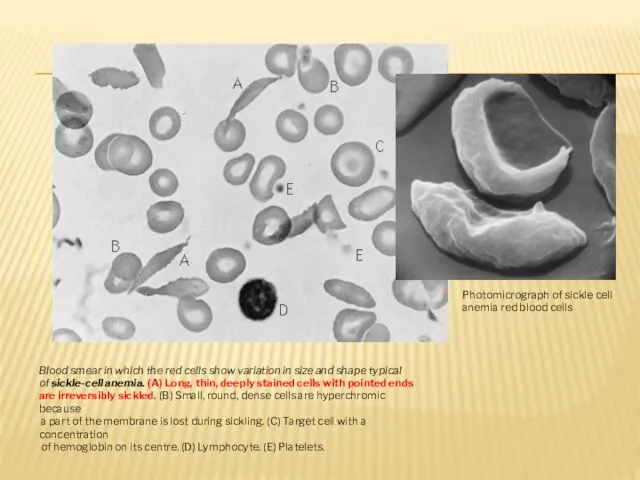
- 59. Blood smear in which the red cells show variation in size and shape typical of sickle-cell
- 60. Количество возможных первичных структур ОГРОМНО! 20 аминокислот могут дать примерно 100000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 белков, состоящих из 150 остатков
- 61. ВТОРИЧНАЯ СТРУКТУРА Вторичная структура- локальные высокоупорядоченные конформации белковой цепи – спирали и складчатые слои.
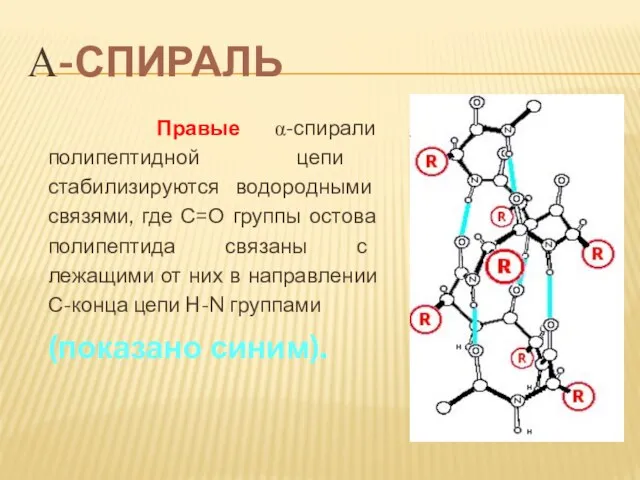
- 62. Α-СПИРАЛЬ Правые α-спирали полипептидной цепи стабилизируются водородными связями, где С=О группы остова полипептида связаны с лежащими
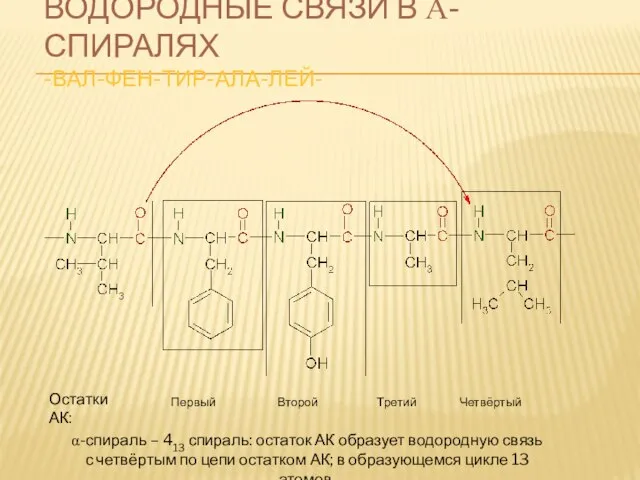
- 63. ВОДОРОДНЫЕ СВЯЗИ В Α-СПИРАЛЯХ -ВАЛ-ФЕН-ТИР-АЛА-ЛЕЙ- Первый Второй Третий Четвёртый Остатки АК: α-спираль – 413 спираль: остаток
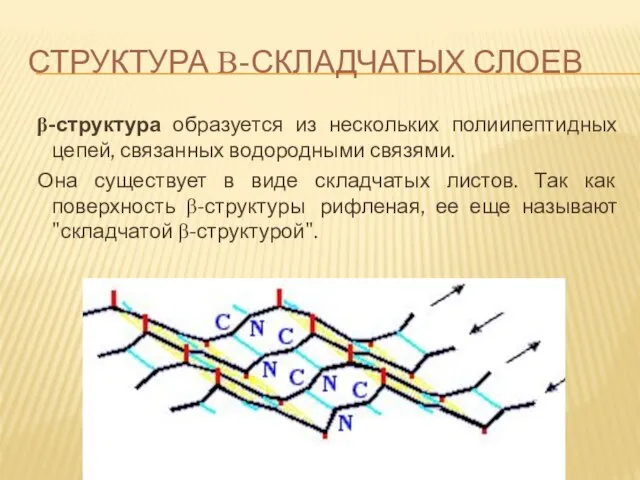
- 64. СТРУКТУРА Β-СКЛАДЧАТЫХ СЛОЕВ β-структура образуется из нескольких полиипептидных цепей, связанных водородными связями. Она существует в виде
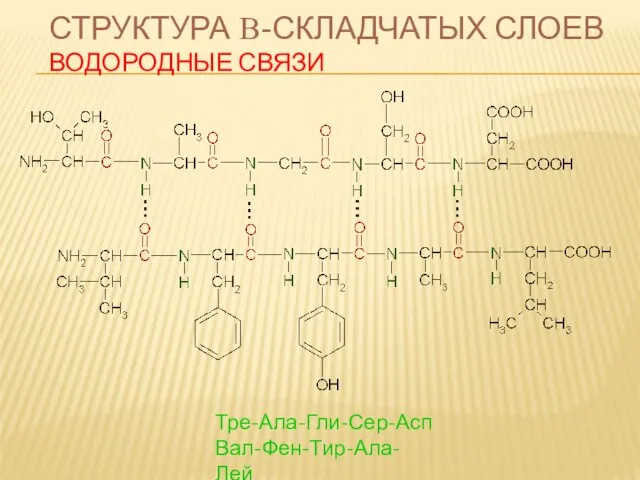
- 65. СТРУКТУРА Β-СКЛАДЧАТЫХ СЛОЕВ ВОДОРОДНЫЕ СВЯЗИ Тре-Ала-Гли-Сер-Асп Вал-Фен-Тир-Ала-Лей
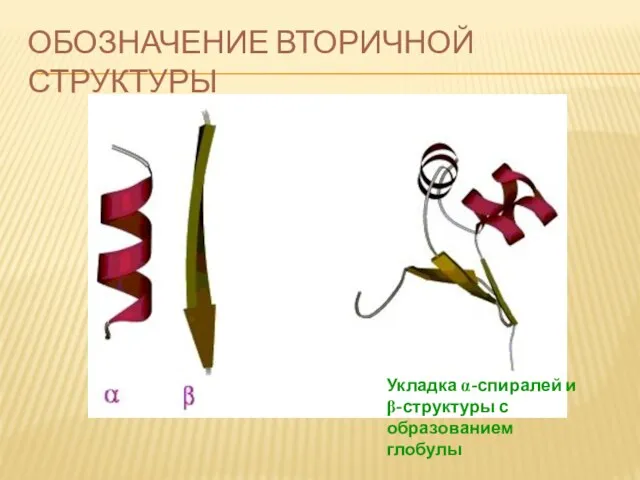
- 66. ОБОЗНАЧЕНИЕ ВТОРИЧНОЙ СТРУКТУРЫ Укладка α-спиралей и β-структуры с образованием глобулы
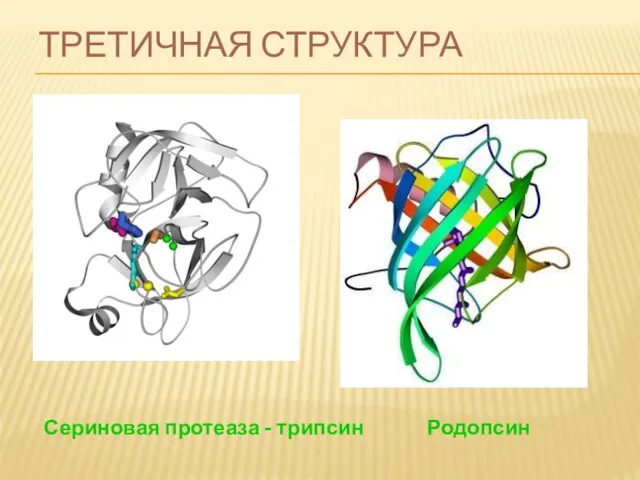
- 67. ТРЕТИЧНАЯ СТРУКТУРА третичная структура – форма белковой молекулы; трёхмерная структура белка. Укладка нерегулярных областей и α
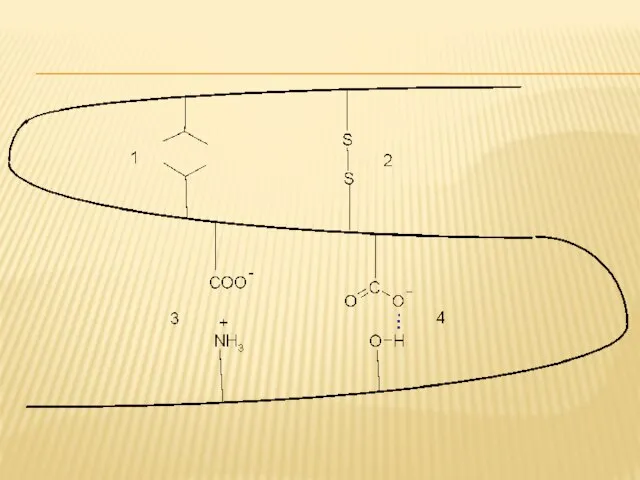
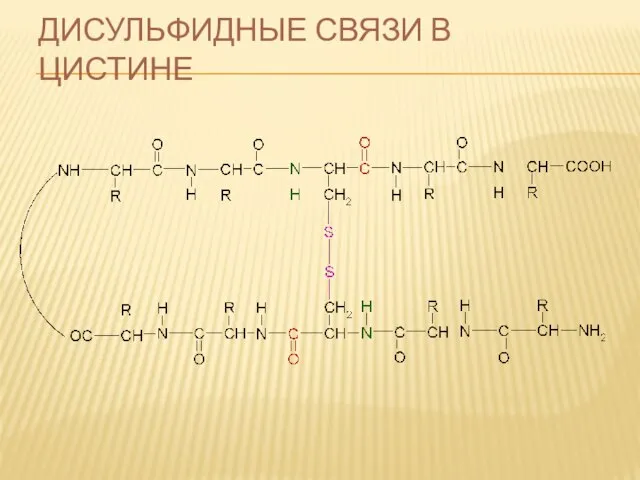
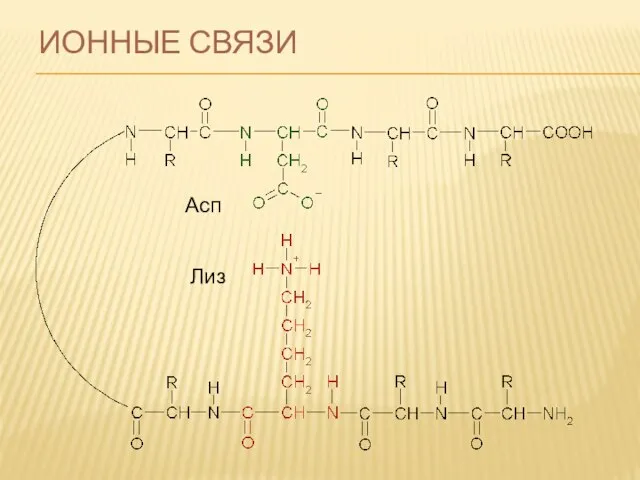
- 68. ВЗАИМОДЕЙСТВИЯ ОСТАТКОВ АК В ТРЕТИЧНОЙ СТРУКТУРЕ Остатки АК в белковой глобуле взаимодействуют за счёт: Гидрофобных взаимодействий
- 70. ДИСУЛЬФИДНЫЕ СВЯЗИ В ЦИСТИНЕ
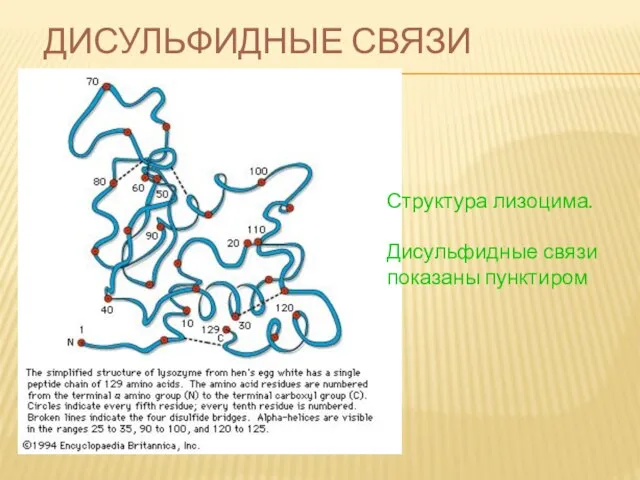
- 71. ДИСУЛЬФИДНЫЕ СВЯЗИ Структура лизоцима. Дисульфидные связи показаны пунктиром
- 72. ИОННЫЕ СВЯЗИ Асп Лиз
- 73. ТРЕТИЧНАЯ СТРУКТУРА Сериновая протеаза - трипсин Родопсин
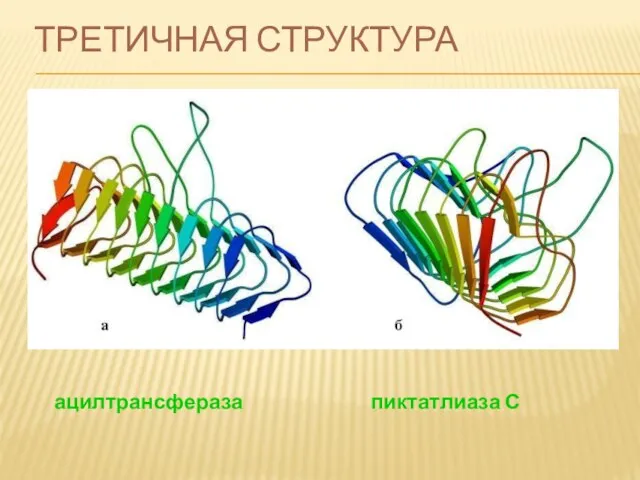
- 74. ТРЕТИЧНАЯ СТРУКТУРА ацилтрансфераза пиктатлиаза С
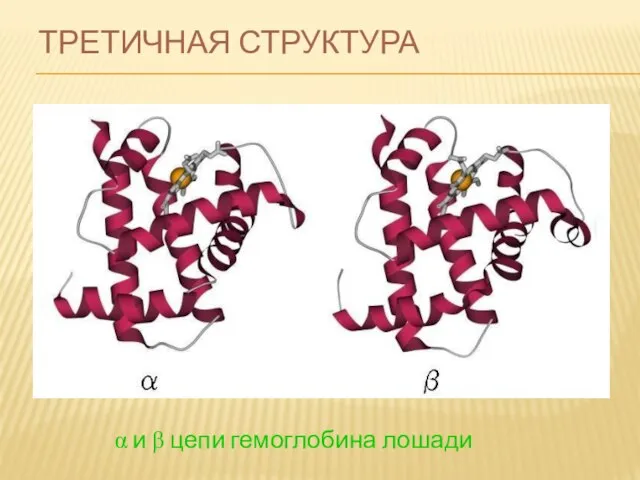
- 75. ТРЕТИЧНАЯ СТРУКТУРА α и β цепи гемоглобина лошади
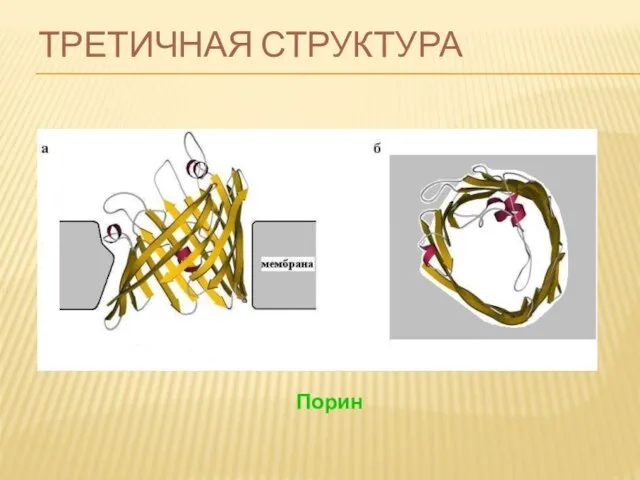
- 76. ТРЕТИЧНАЯ СТРУКТУРА Порин
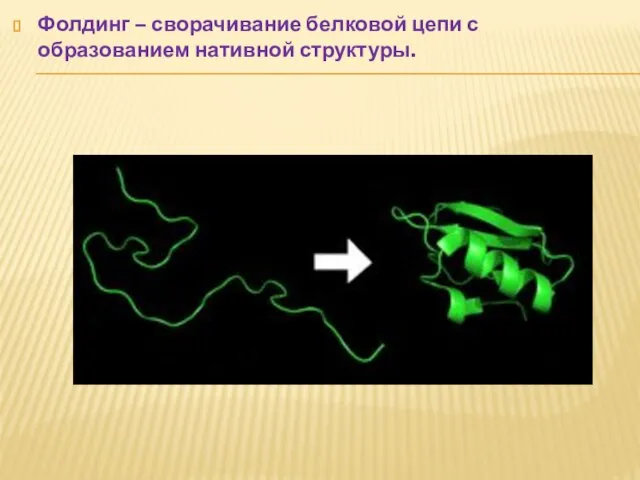
- 77. Фолдинг – сворачивание белковой цепи с образованием нативной структуры.
- 78. Неправильный фолдинг может привести к различным болезням, например к губчатым энцефалопатиям: Синдром Крейцфельда-Якоба Новый вариант Крейцфельда-Якоба
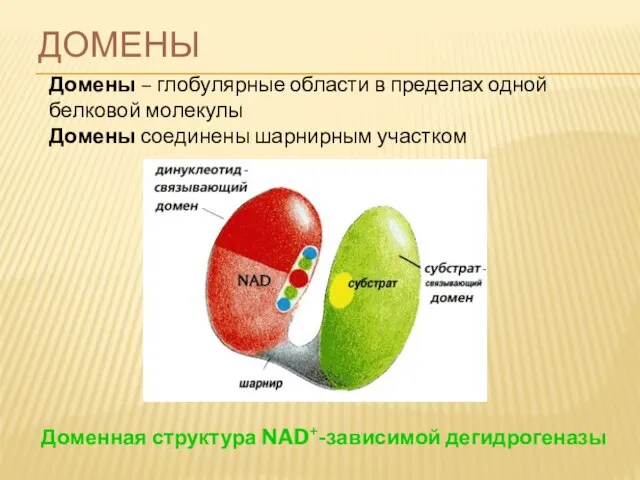
- 79. ДОМЕНЫ Домены – глобулярные области в пределах одной белковой молекулы Домены соединены шарнирным участком Доменная структура
- 80. ЧЕТВЕРТИЧНАЯ СТРУКТУРА Четвертичная структура- агрегат нескольких белковых молекул образующих одну структуру Взаимодействия: ионные, водородные, гидрофобные, ковалентные
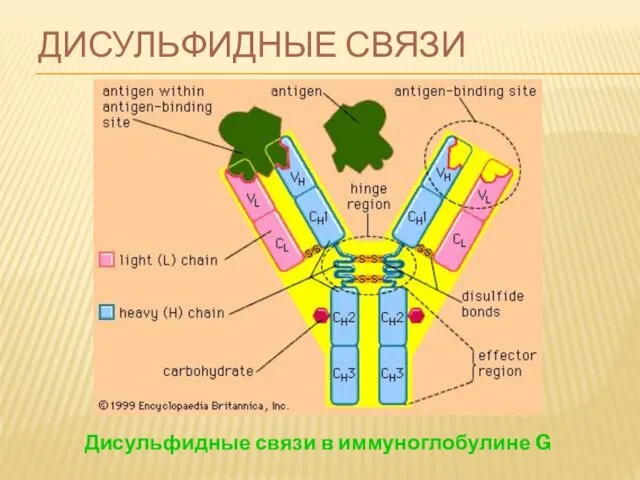
- 81. ДИСУЛЬФИДНЫЕ СВЯЗИ Дисульфидные связи в иммуноглобулине G
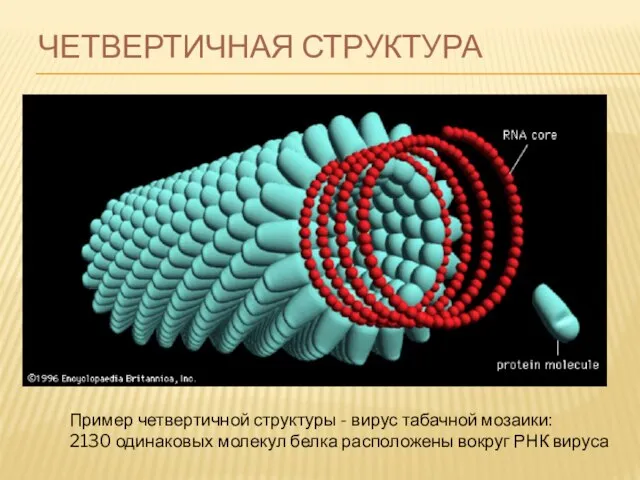
- 82. ЧЕТВЕРТИЧНАЯ СТРУКТУРА Пример четвертичной структуры - вирус табачной мозаики: 2130 одинаковых молекул белка расположены вокруг РНК
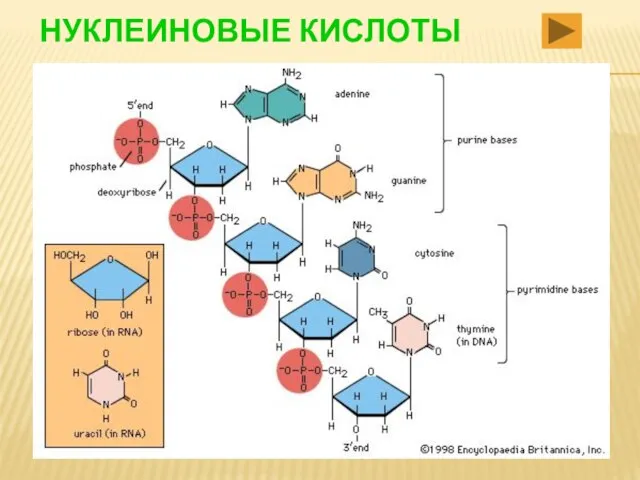
- 83. НУКЛЕИНОВЫЕ КИСЛОТЫ НК- это полинуклеотиды, т.е. биополимеры, мономерами которых являются нуклеотиды. Нуклеотиды-фосфорные эфиры нуклеозидов Нуклеозиды –
- 84. НУКЛЕИНОВЫЕ КИСЛОТЫ
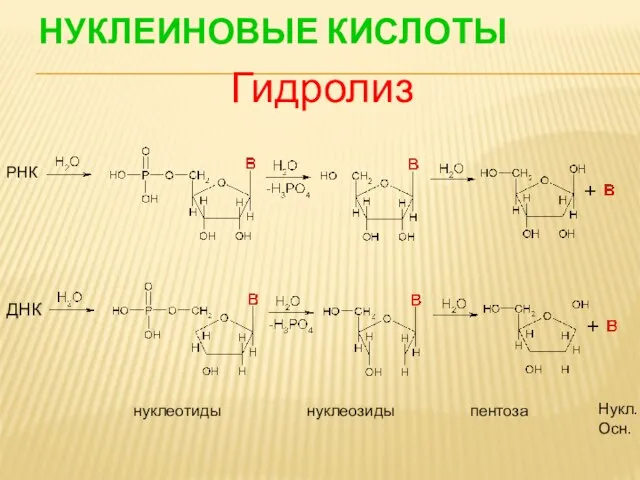
- 85. НУКЛЕИНОВЫЕ КИСЛОТЫ РНК ДНК нуклеотиды нуклеозиды пентоза Нукл. Осн. Гидролиз
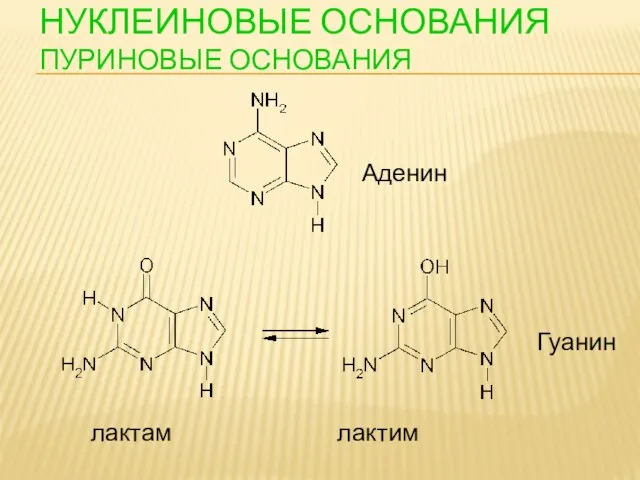
- 86. НУКЛЕИНОВЫЕ ОСНОВАНИЯ ПУРИНОВЫЕ ОСНОВАНИЯ Аденин Гуанин лактам лактим
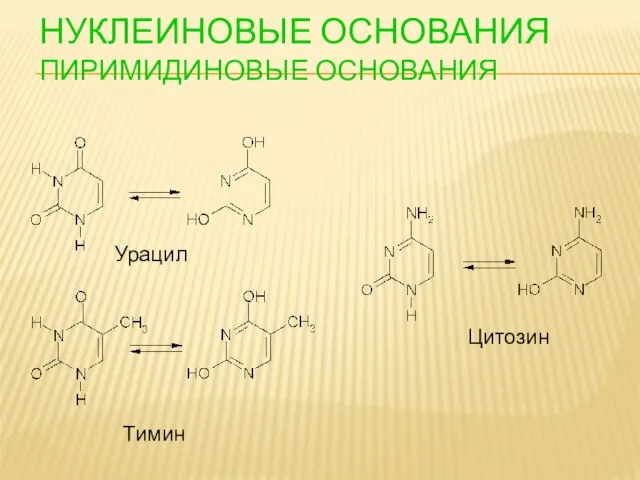
- 87. НУКЛЕИНОВЫЕ ОСНОВАНИЯ ПИРИМИДИНОВЫЕ ОСНОВАНИЯ Урацил Тимин Цитозин
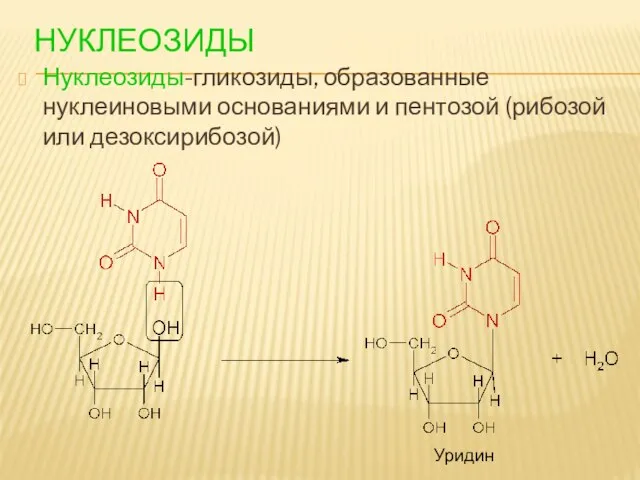
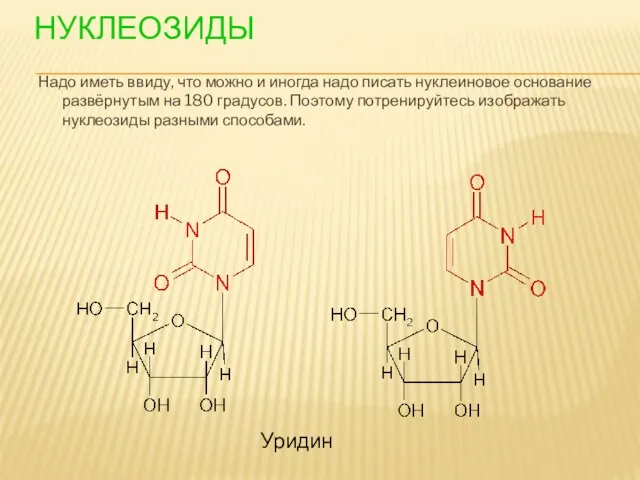
- 88. НУКЛЕОЗИДЫ Нуклеозиды-гликозиды, образованные нуклеиновыми основаниями и пентозой (рибозой или дезоксирибозой) Уридин
- 89. НУКЛЕОЗИДЫ Надо иметь ввиду, что можно и иногда надо писать нуклеиновое основание развёрнутым на 180 градусов.
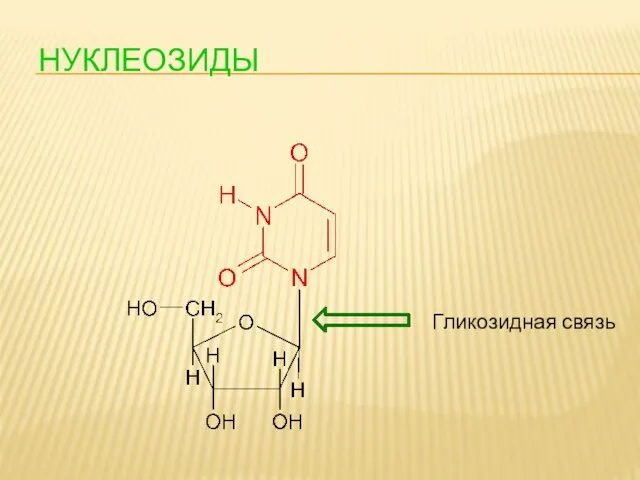
- 90. НУКЛЕОЗИДЫ Гликозидная связь
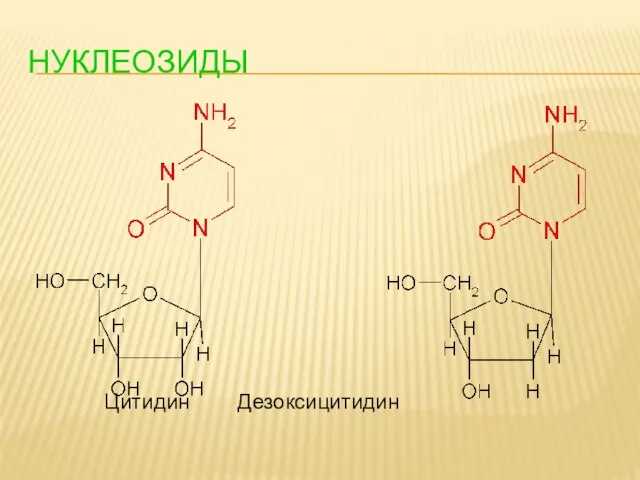
- 91. НУКЛЕОЗИДЫ Цитидин Дезоксицитидин
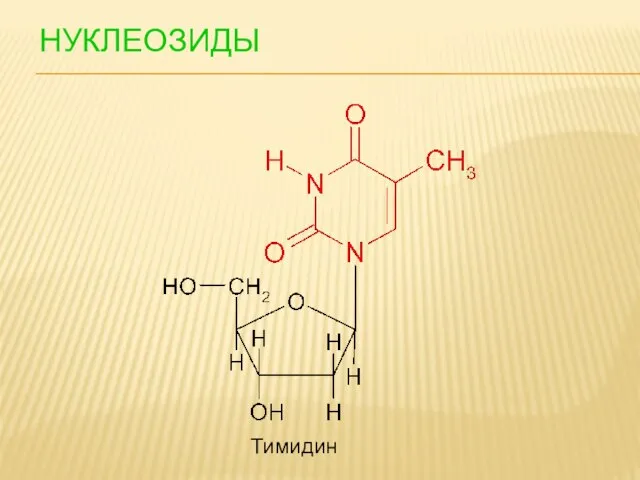
- 92. НУКЛЕОЗИДЫ Тимидин
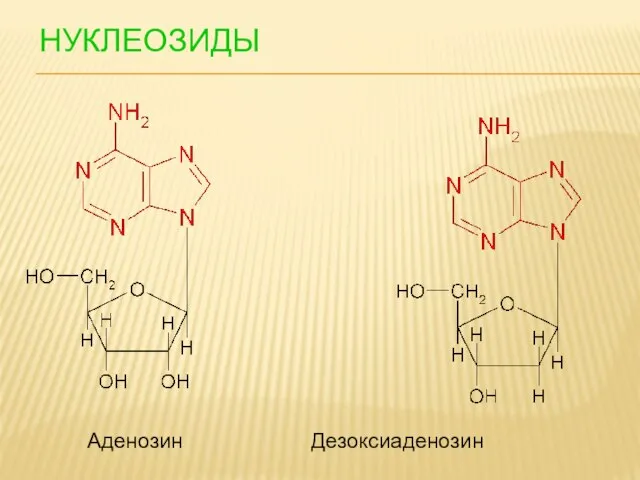
- 93. НУКЛЕОЗИДЫ Аденозин Дезоксиаденозин
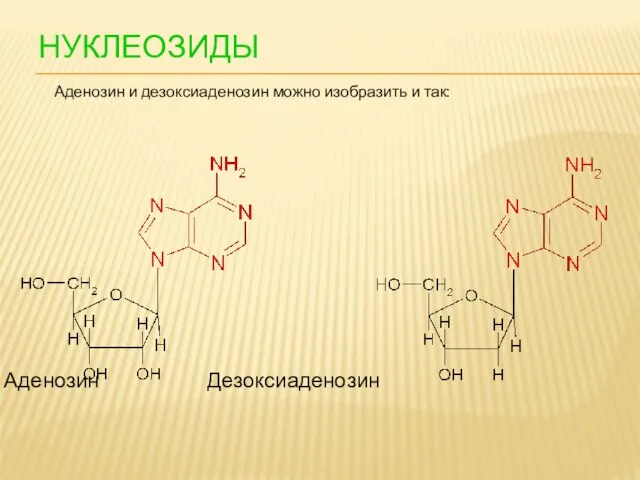
- 94. НУКЛЕОЗИДЫ Аденозин Дезоксиаденозин Аденозин и дезоксиаденозин можно изобразить и так:
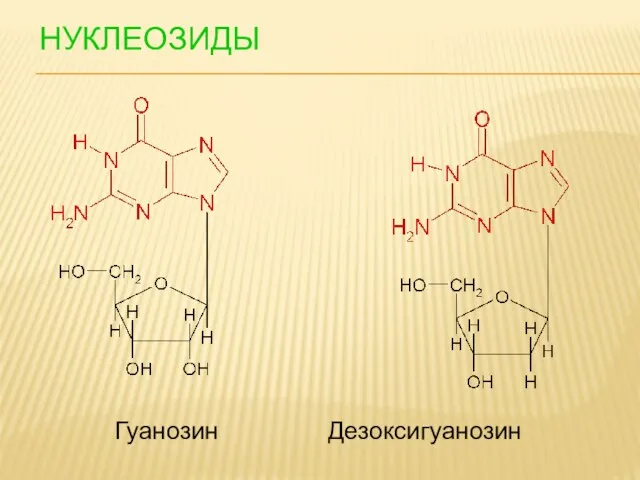
- 95. НУКЛЕОЗИДЫ Гуанозин Дезоксигуанозин
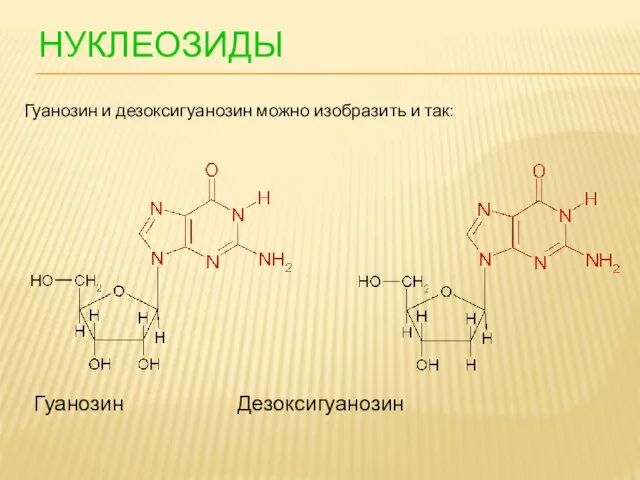
- 96. НУКЛЕОЗИДЫ Гуанозин Дезоксигуанозин Гуанозин и дезоксигуанозин можно изобразить и так:
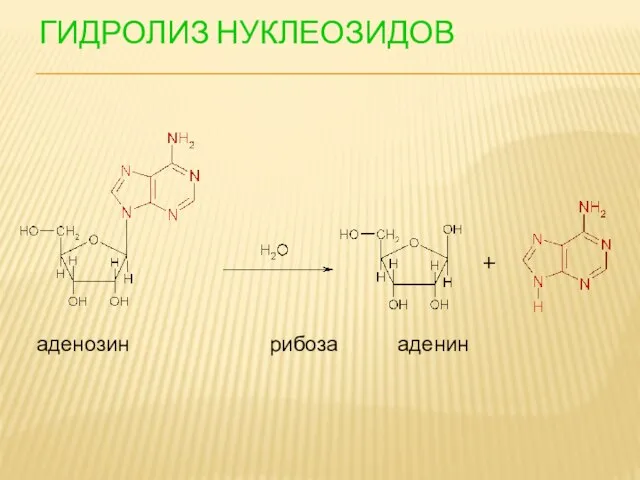
- 97. ГИДРОЛИЗ НУКЛЕОЗИДОВ аденозин рибоза аденин
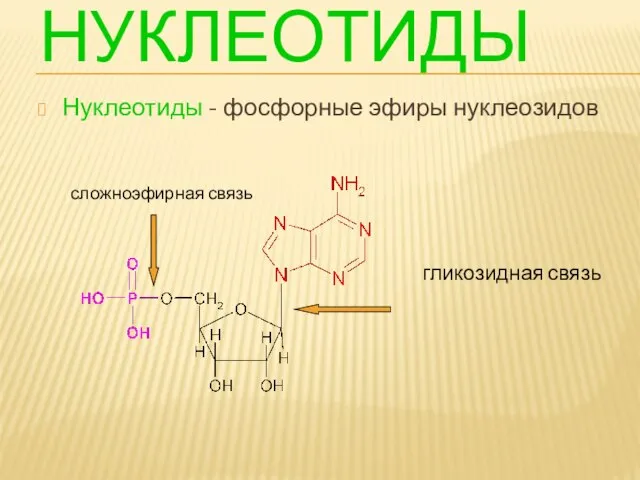
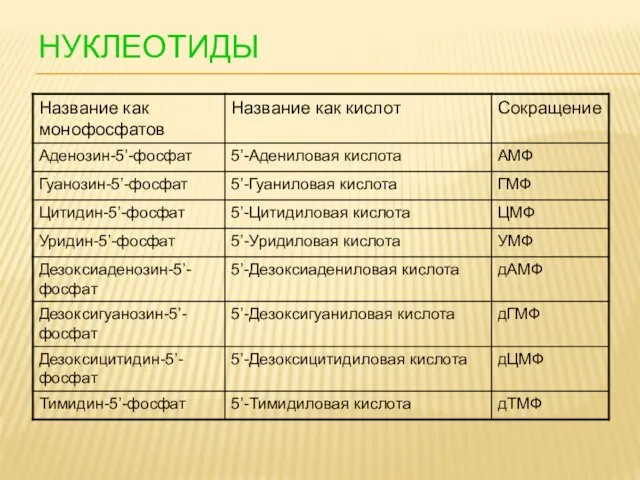
- 98. НУКЛЕОТИДЫ Нуклеотиды - фосфорные эфиры нуклеозидов гликозидная связь сложноэфирная связь
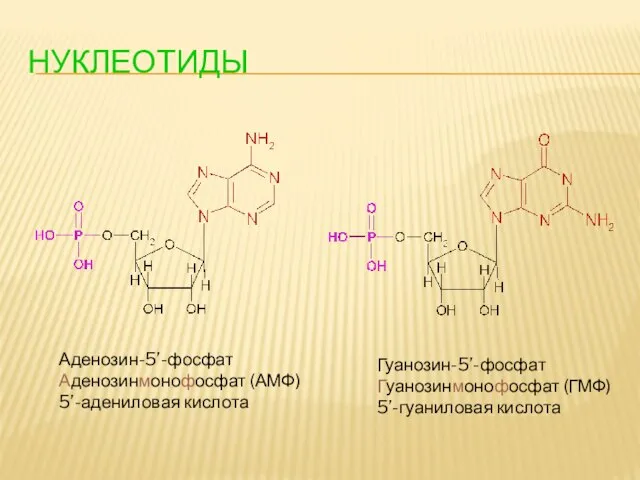
- 99. НУКЛЕОТИДЫ Аденозин-5’-фосфат Аденозинмонофосфат (АМФ) 5’-адениловая кислота Гуанозин-5’-фосфат Гуанозинмонофосфат (ГМФ) 5’-гуаниловая кислота
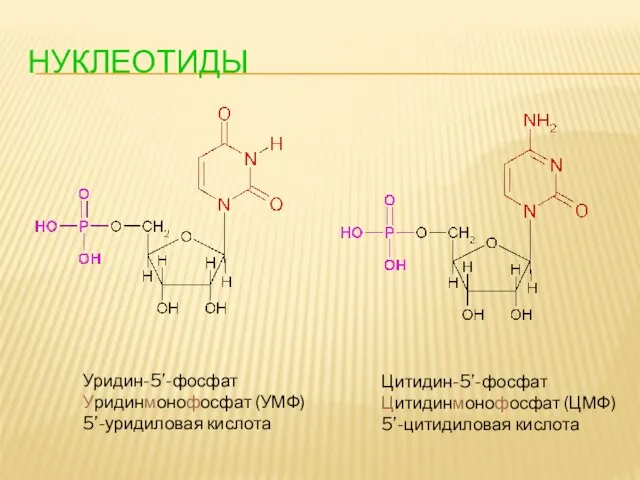
- 100. НУКЛЕОТИДЫ Уридин-5’-фосфат Уридинмонофосфат (УМФ) 5’-уридиловая кислота Цитидин-5’-фосфат Цитидинмонофосфат (ЦМФ) 5’-цитидиловая кислота
- 101. НУКЛЕОТИДЫ
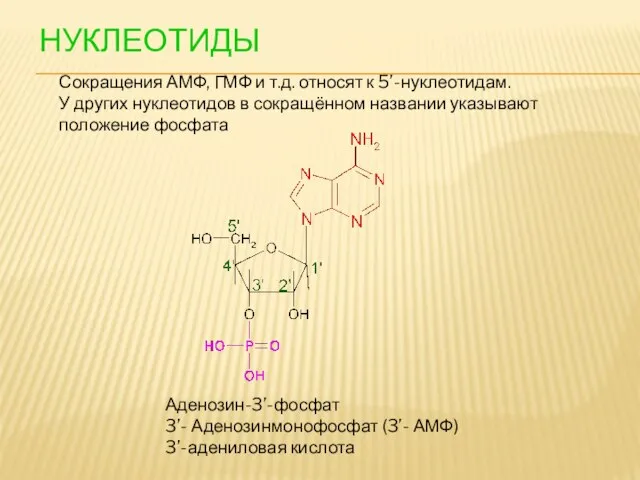
- 102. НУКЛЕОТИДЫ Сокращения АМФ, ГМФ и т.д. относят к 5’-нуклеотидам. У других нуклеотидов в сокращённом названии указывают
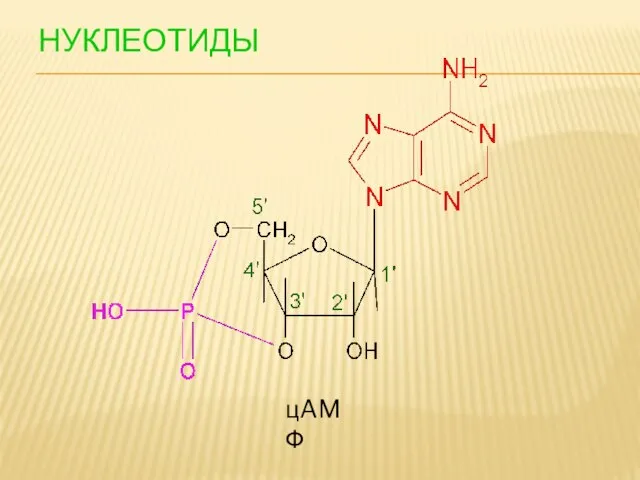
- 103. НУКЛЕОТИДЫ цAMФ
- 104. Циклический аденозинмонофосфат (циклический AMФ, цAMФ, cAMP) — Циклический нуклеотид, играющий роль вторичного посредника некоторых гормонов (глюкагона
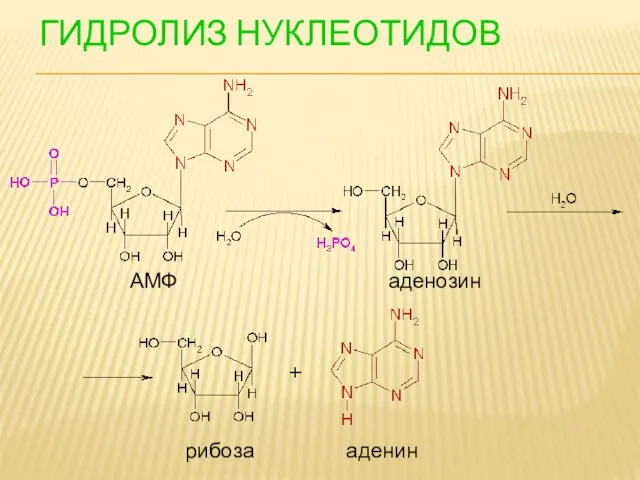
- 105. ГИДРОЛИЗ НУКЛЕОТИДОВ АМФ аденозин рибоза аденин
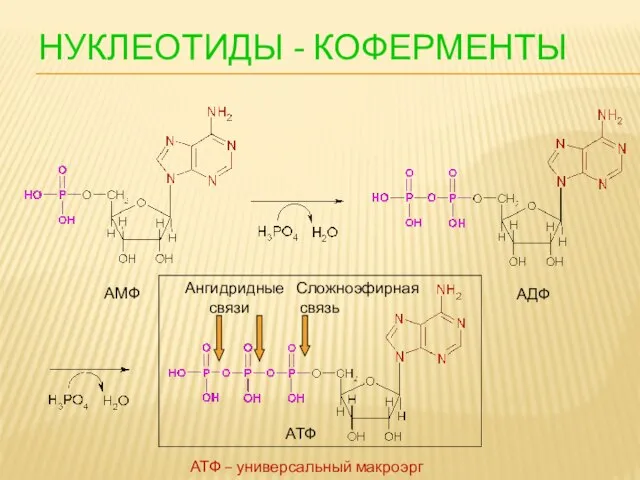
- 106. НУКЛЕОТИДЫ - КОФЕРМЕНТЫ АМФ АДФ АТФ Ангидридные связи Сложноэфирная связь АТФ – универсальный макроэрг
- 107. Образование АТФ происходит 1. В результате субстратного фосфорилирования (гликолиз, одна реакция ЦТК) 2. Окислительное фосфорилирование (в
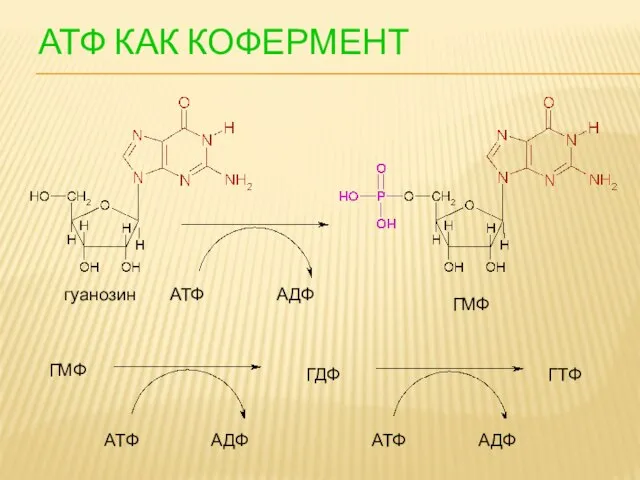
- 108. АТФ КАК КОФЕРМЕНТ АТФ АДФ АТФ АДФ АТФ АДФ ГМФ ГДФ ГТФ ГМФ гуанозин
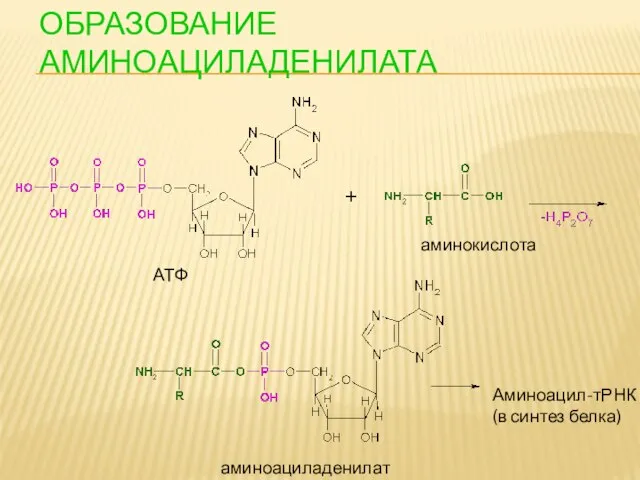
- 109. ОБРАЗОВАНИЕ АМИНОАЦИЛАДЕНИЛАТА АТФ аминокислота аминоациладенилат Аминоацил-тРНК (в синтез белка)
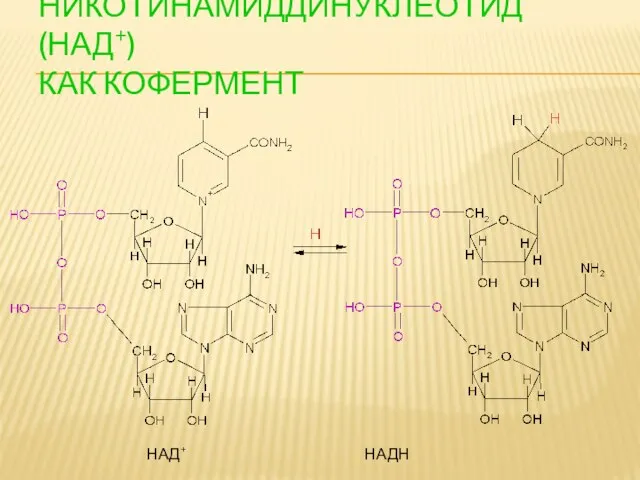
- 110. НИКОТИНАМИДДИНУКЛЕОТИД (НАД+) КАК КОФЕРМЕНТ НАД+ НАДН
- 111. ПЕРВИЧНАЯ СТРУКТУРА НК Первичная структура НК - последовательность нуклеотидов 5’- конец ТГАЦТААГТАЦЦ 3’-конец (ф-конец) (OH-конец)
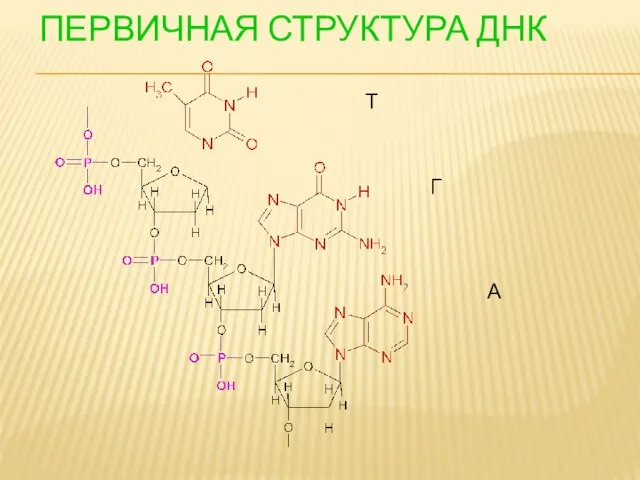
- 112. ПЕРВИЧНАЯ СТРУКТУРА ДНК Т Г А
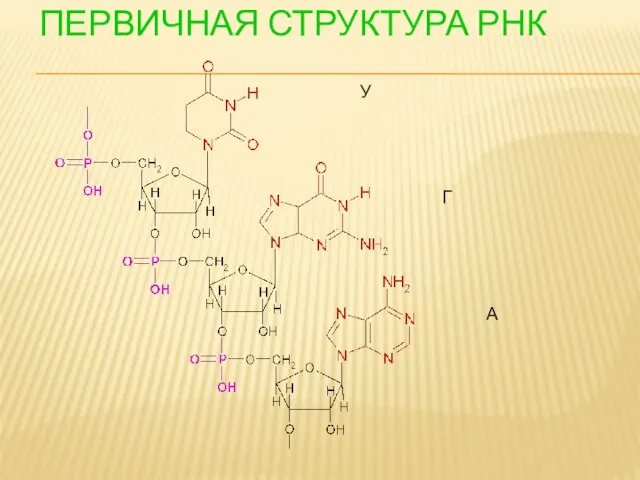
- 113. ПЕРВИЧНАЯ СТРУКТУРА РНК У Г А
- 114. ВТОРИЧНАЯ СТРУКТУРА Вторичная структура ДНК – двойная правая спираль (Уотсон, Крик, 1953) Две цепи антипараллельны друг
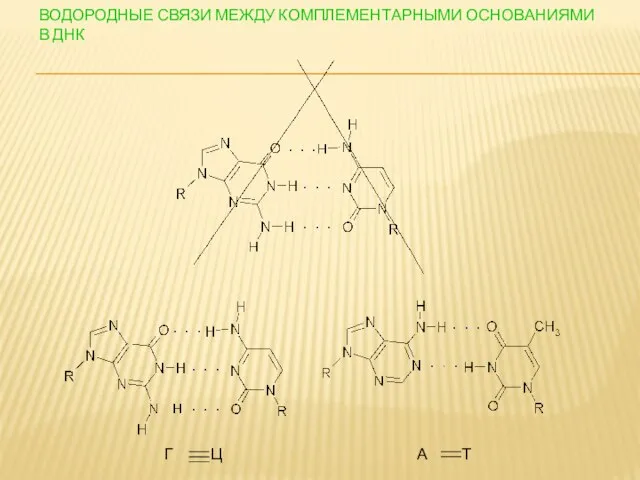
- 115. ВОДОРОДНЫЕ СВЯЗИ МЕЖДУ КОМПЛЕМЕНТАРНЫМИ ОСНОВАНИЯМИ В ДНК Г Ц А Т
- 117. Скачать презентацию





![СОДЕРЖАЩИЕ АМИНОГРУППУ Лизин α,ε-диаминокапроновая кислота 2,6-диаминогексановая кислота Lys, Лиз Аргинин α-амино-δ-гуанидилвалериановая кислота 2-амино-5-[амино(имино)метил]аминопентановая к-та Arg, Арг](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/426661/slide-9.jpg)













![Orig Life Evol Biosph. 2011 Apr 12. [Epub ahead of print] Catalytic](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/426661/slide-40.jpg)



















 Презентация на тему Растительный мир тундры
Презентация на тему Растительный мир тундры Псалом 134. Славы Господней
Псалом 134. Славы Господней Презентация на тему Русь в правление Ивана Грозного (1533-1584) 10 класс
Презентация на тему Русь в правление Ивана Грозного (1533-1584) 10 класс «Бабушки ON-line» социально-экономический проект
«Бабушки ON-line» социально-экономический проект История блокады Ленинграда
История блокады Ленинграда Основы экологии и экологические проблемы природопользования
Основы экологии и экологические проблемы природопользования Презентация на тему Семейство Зонтичные
Презентация на тему Семейство Зонтичные  Современные подходы в организации деятельности по развитию кадрового потенциала сотрудников
Современные подходы в организации деятельности по развитию кадрового потенциала сотрудников  "Карагайский бор"
"Карагайский бор" Схема работы четырехтактного дизеля на судне. Центробежно-вихревой насос. Система управления котла-утилизатор
Схема работы четырехтактного дизеля на судне. Центробежно-вихревой насос. Система управления котла-утилизатор Историческое прошлое веера
Историческое прошлое веера Edem. Проблема
Edem. Проблема Фьючерсный контракт и его актуальность
Фьючерсный контракт и его актуальность Соединения химических элементов. Степень окисления
Соединения химических элементов. Степень окисления Москва
Москва АРЕНДА В КРАСНОГОРСКЕ !!!
АРЕНДА В КРАСНОГОРСКЕ !!! Пролетарская культура
Пролетарская культура Перу Республика
Перу Республика первоночальные сведения о строении вещества
первоночальные сведения о строении вещества Презентация на тему Библейские мотивы лирики А.С.Пушкина
Презентация на тему Библейские мотивы лирики А.С.Пушкина Разработка методологических основ мониторинга и прогнозирования влияния геоастрофизических факторов на характер возникновения
Разработка методологических основ мониторинга и прогнозирования влияния геоастрофизических факторов на характер возникновения  Распространенность наркомании и современные подходы к профилактике медико-социальных последствий «проблемного» потребления нар
Распространенность наркомании и современные подходы к профилактике медико-социальных последствий «проблемного» потребления нар ТМ Фрекен БОК, Россия
ТМ Фрекен БОК, Россия Краевой конкурс детского фольклорного творчества «Солнцеворот»
Краевой конкурс детского фольклорного творчества «Солнцеворот» Литературная викторина по творчеству А.П. Чехова 7 – 8 классы 2 тур
Литературная викторина по творчеству А.П. Чехова 7 – 8 классы 2 тур ФГОС начального общего образования: нормативно-методологические основания и новые образовательные результаты
ФГОС начального общего образования: нормативно-методологические основания и новые образовательные результаты Гимназия № 12
Гимназия № 12 Презентация на тему Романтизм в музыке
Презентация на тему Романтизм в музыке