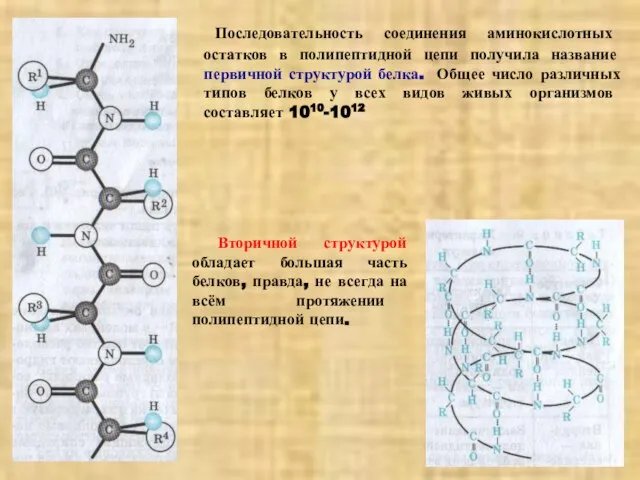
набухают, их масса и объём увеличиваются. Набухание белка сопровождается его частичным растворением. Гидрофильность отдельных белков зависит от их строения. Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные амидные (СО-NH-, пептидная связь), аминные (NH2) и карбоксильные (СООН) группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы. Окружающая белковые глобулы гидратная (водная) оболочка препятствует агрегации и осаждению, а следовательно способствует устойчивости раствора белка.
При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями. Студни не текучи, упруги, обладают пластичностью, определенной механической прочностью, способны сохранять свою форму. Глобулярные белки могут полностью гидратироваться, растворяясь в воде (например, белки молока), образуя растворы с невысокой концентрацией.
Гидрофильность белков зерна и муки играет большую роль при хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, представляет собой набухший в воде белок, концентрированный студень, содержащий зёрна крахмала.
Гидратация














 Летательные аппараты
Летательные аппараты Политическая система и политический режим
Политическая система и политический режим Организм человека
Организм человека Полтава
Полтава EA-ID6D
EA-ID6D Я играю роль
Я играю роль Новогодний стол за 2000 рублей на 8 человек
Новогодний стол за 2000 рублей на 8 человек Ударно-тяговые приборы
Ударно-тяговые приборы УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ ПО СТОМАТОЛОГИЧЕСКОМУ МАТЕРИАЛОВЕДЕНИЮ
УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ ПО СТОМАТОЛОГИЧЕСКОМУ МАТЕРИАЛОВЕДЕНИЮ Тема: Род имен существительных. Тип урока: Закрепление. 3 класс (Школа ХХI века)
Тема: Род имен существительных. Тип урока: Закрепление. 3 класс (Школа ХХI века) Измерение информации объемный подход (10 класс)
Измерение информации объемный подход (10 класс) Красота и разнообразие растений
Красота и разнообразие растений Презентация на тему Гражданские принципы в статье 1 ГК РФ
Презентация на тему Гражданские принципы в статье 1 ГК РФ Презентация на тему Понятие одночлена стандартный вид одночлена (7 класс)
Презентация на тему Понятие одночлена стандартный вид одночлена (7 класс)  Стек технологий Apache Hadoop. Распределённая файловая система HDFS
Стек технологий Apache Hadoop. Распределённая файловая система HDFS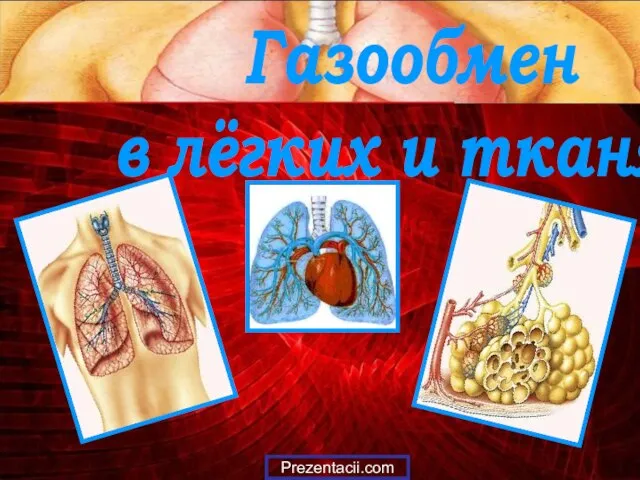 Газообмен в лёгких и тканях
Газообмен в лёгких и тканях Биологическая газета «Жизнь»
Биологическая газета «Жизнь» Пушкин в лицее
Пушкин в лицее Аномальные реакции рынков
Аномальные реакции рынков Презентация на тему Углерод Carboneum
Презентация на тему Углерод Carboneum  Тинькофф бизнес ПРЕЗЕНТАЦИЯ (1)
Тинькофф бизнес ПРЕЗЕНТАЦИЯ (1) 1С:Предприятие 8 + Microsoft Office 2010
1С:Предприятие 8 + Microsoft Office 2010 Танцы древнего Египта и Греции
Танцы древнего Египта и Греции 07 Психология внимания и памяти
07 Психология внимания и памяти Числительные
Числительные Презентация на тему Коррекция эмоций
Презентация на тему Коррекция эмоций 1С:Процессное производство.Химия
1С:Процессное производство.Химия Право, его роль в жизни общества и государства
Право, его роль в жизни общества и государства