Содержание
- 2. Хотите научиться решать задачки? Тогда смелее вперед! Какой тип задач вас интересует сегодня? примеси избыток-недостаток выход
- 3. Напишите уравнение реакции, обязательно расставьте коэффициенты. Вычислите количество вещества по указанным в условии массе или объему.
- 4. Вычислите массу серы, которая вступит в реакцию с 8,1г алюминия. Для начала запишем условие задачи: Попробуем
- 5. 1 этап Напишем уравнение реакции: Al + S ? Al2S3 Вы заметили, чего здесь не хватает?
- 6. 2 этап Вспомним формулу для вычисления количества вещества: ν (Al) = m/M = 8,1г/27г/моль =0,3моль Итак,
- 7. 3 этап Посмотрите на уравнение реакции: 2 Al + 3 S ? Al2S3 Коэффициенты в уравнении
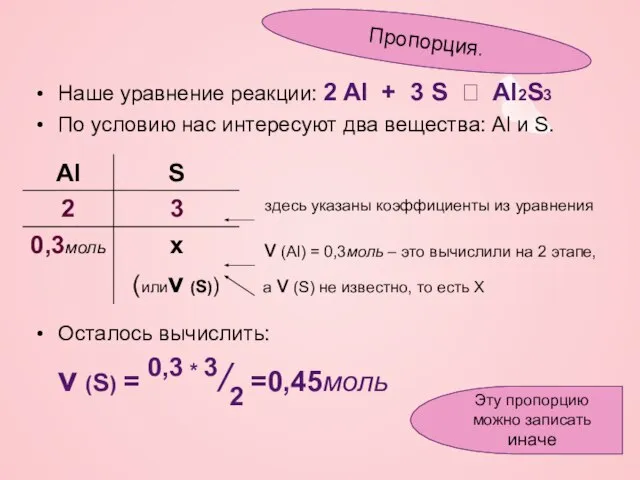
- 8. Наше уравнение реакции: 2 Al + 3 S ? Al2S3 По условию нас интересуют два вещества:
- 9. Наше уравнение реакции: 2 Al + 3 S ? Al2S3 По условию нас интересуют два вещества:
- 10. Наше уравнение реакции: 2 Al + 3 S ? Al2S3 Вы можете придумать свою форму записи
- 11. 4 этап Вспомним формулу для вычисления массы вещества, если известно его количество: m(S) = ν (S)
- 12. Хочу еще раз просмотреть решение по стадиям. Завершить работу Хотите решить аналогичную задачу?
- 13. Вычислите массу алюминия, вступившего в реакцию с соляной кислотой, если известно, что в результате выделилось 33,6л
- 14. При решении задачи используйте план: Напишите уравнение, не забудьте расставить коэффициенты. Вычислите количество вещества по указанным
- 15. Решение задачи будет выглядеть так: Завершить работу Хочу просмотреть решение других, более сложных задач.
- 16. Уравнение реакции выглядит так: 2Al + 6HCl ? 2AlCl3 + 3H2 Не забудьте, что молекула водорода
- 17. Объем и количество вещества связаны формулой: ν = V/Vм ; V = Vм * ν Масса
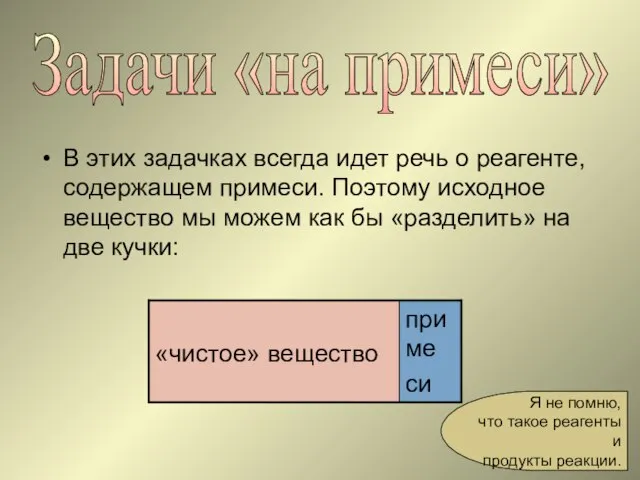
- 18. Задачи «на примеси» В этих задачках всегда идет речь о реагенте, содержащем примеси. Поэтому исходное вещество
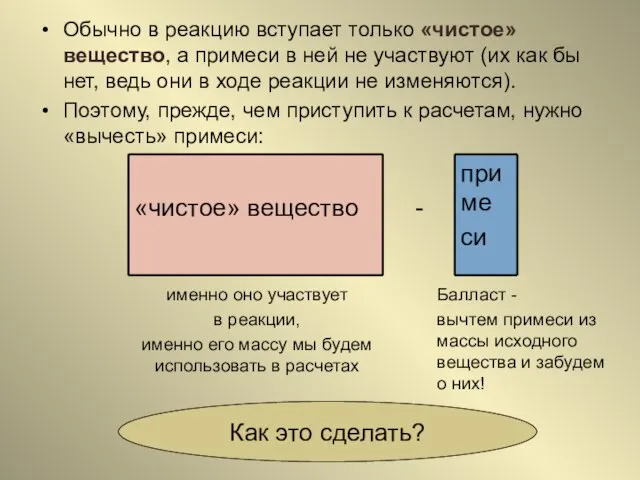
- 19. Обычно в реакцию вступает только «чистое» вещество, а примеси в ней не участвуют (их как бы
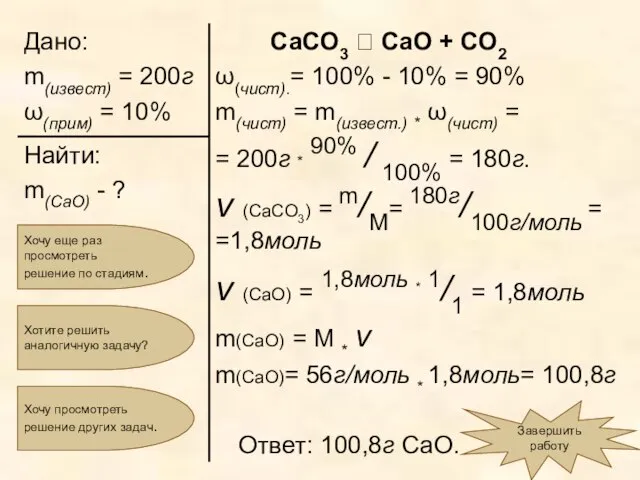
- 20. «Вычислите массу оксида кальция, которую можно получить при термическом разложении 200г известняка, содержащего 10% примесей.» Для
- 21. Мы уже нашли, что ω чист. составляет 90% от массы «грязного», то есть 90% от 200г.
- 22. СаСО3 ? СаО + СО2 Мы нашли, что масса вещества, вступившего в реакцию (это карбонат кальция)
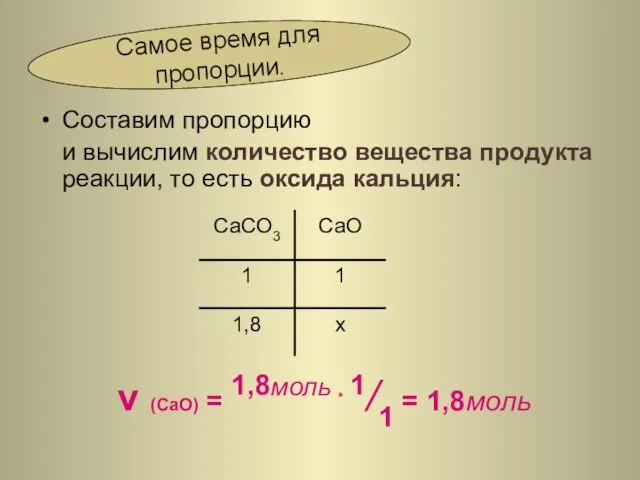
- 23. Составим пропорцию и вычислим количество вещества продукта реакции, то есть оксида кальция: ν (CaO) = 1,8моль
- 24. Осталось вычислить массу продукта реакции, то есть оксида кальция: m(CaO) = M * ν m(CaO) =
- 25. Хочу еще раз просмотреть решение по стадиям. Завершить работу Хочу просмотреть решение других задач. Хотите решить
- 26. Вычислите массу кремния, которая должна образоваться при восстановлении углем 150 г оксида кремния (IV), если содержание
- 27. При решении задачи используйте план: Напишите уравнение, не забудьте расставить коэффициенты. Теперь надо «вычесть примеси» и
- 28. Решение задачи будет выглядеть так: Завершить работу Хочу просмотреть решение других задач.
- 29. Уравнение реакции выглядит так: SiO2 + 2C ? 2CO + Si Массу чистого вещества находят по
- 30. В этих задачках продукт реакции всегда получается в меньших количествах, чем ожидалось, то есть меньше, чем
- 31. В этих задачах фигурируют две массы продукта: Масса теоретическая – максимально возможное количество продукта. mтеор рассчитывают
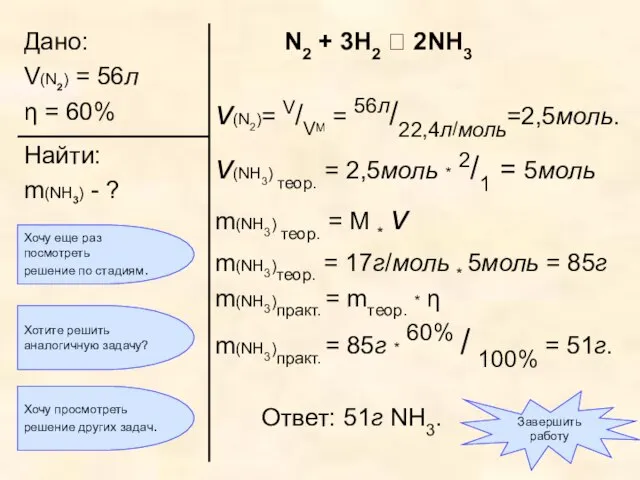
- 32. «Азот объемом 56л (н.у.) прореагировал с водородом, взятым в избытке. Массовая доля выхода аммиака составила 60%.
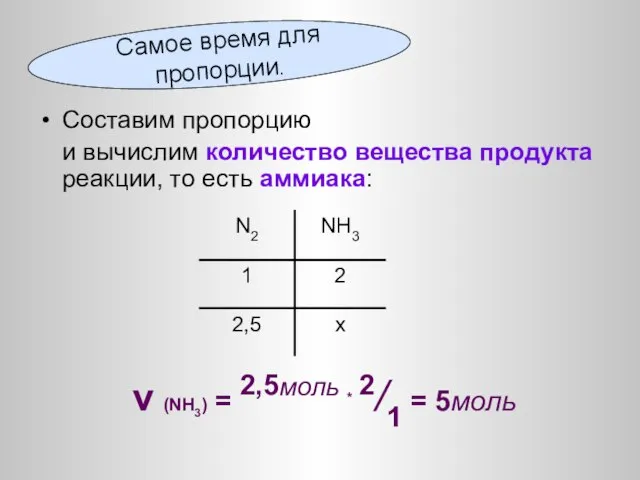
- 33. Как обычно, по объему реагента вычислим количество вещества азота: ν (N2) = V/VM = 56л/22,4л/моль =2,5моль
- 34. Составим пропорцию и вычислим количество вещества продукта реакции, то есть аммиака: ν (NH3) = 2,5моль *
- 35. Теперь мы можем вычислить массу продукта реакции, то есть аммиака: m(NH3) = M * ν m(NH3)
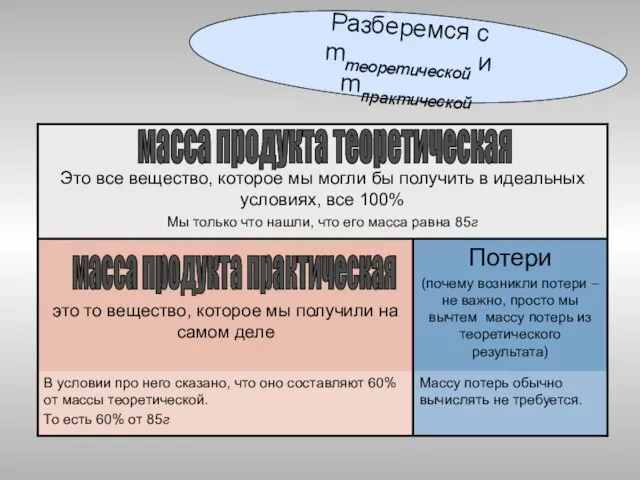
- 36. Та масса продукта реакции, которую мы рассчитали по уравнению, называется ТЕОРЕТИЧЕСКОЙ, или расчетной, или ожидаемой. Та
- 37. Разберемся с mтеоретической и mпрактической масса продукта теоретическая масса продукта практическая
- 38. В условии сказано, что массовая доля выхода продукта η составляет 60% от теоретического, то есть 60%
- 39. Хочу еще раз посмотреть решение по стадиям. Завершить работу Хочу просмотреть решение других задач. Хотите решить
- 40. Вычислите объем аммиака, который можно получить при нагревании 21,4г хлорида аммония с избытком гидроксида кальция, если
- 41. При решении задачи используйте план: Напишите уравнение, не забудьте расставить коэффициенты. Вычислите количество вещества хлорида аммония
- 42. Завершить работу Хочу просмотреть решение других задач. 2NH4Cl + Ca(OH)2 ? CaCl2 + 2H2O + 2NH3
- 43. Уравнение реакции выглядит так: 2NH4Cl + Ca(OH)2 ? CaCl2 + 2H2O + 2NH3 Масса и количество
- 44. В этих задачках всегда даны массы двух реагентов, причем один из реагентов имеется в избытке, а
- 45. Безусловно, полностью расходуется тот реагент, который дан в недостатке. Только как узнать, какой из реагентов дан
- 46. «К раствору, в котором находится 42,6г нитрата алюминия, прилили раствор, содержащий 16г гидроксида натрия. Рассчитайте массу
- 47. По массе реагентов вычислим количества вещества нитрата алюминия: ν(Al(NO3)3) = m/M = 42,6г/213г/моль =0,2моль и гидроксида
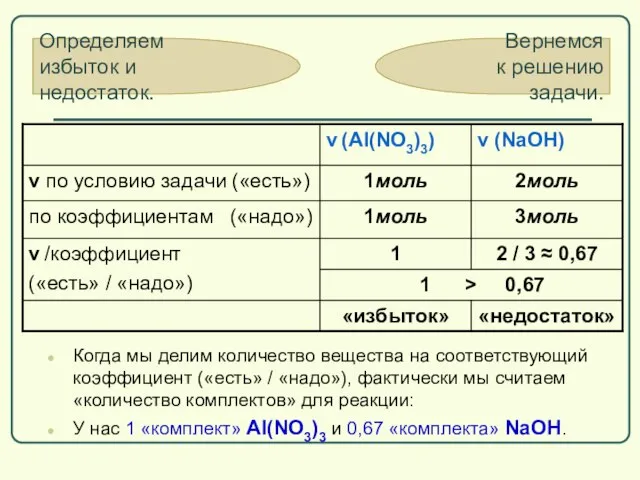
- 48. Теперь надо определить, какой из реагентов дан в избытке, а какой – в недостатке. Сначала посмотрим,
- 49. по коэффициентам (надо) ν(Al(NO3)3) : ν(NaOH)=1:3 по условию (есть) ν(Al(NO3)3) : ν(NaOH) = 1:2 Мы видим,
- 50. Al(NO3)3+3NaOH?Al(OH)3↓+3NaNO3 Составим пропорцию: ν (Al(OH)3) = 0,4моль * 1/3 = 0,13моль Продолжим решать задачу как обычно
- 51. Теперь мы можем вычислить массу осадка, то есть гидроксида алюминия: m(Al(ОH)3) = M * ν m(Al(OH)3)
- 52. Хочу еще раз посмотреть решение по стадиям. Завершить работу Хочу просмотреть решение других задач. Хотите решить
- 53. Какой объем газа (н.у.) выделится, если к 53г карбоната натрия прилить раствор, содержащий 84г азотной кислоты?
- 54. При решении задачи используйте план: Напишите уравнение, не забудьте коэффициенты. Вычислите количества вещества реагентов: карбоната натрия
- 55. Завершить работу Хочу просмотреть решение других задач. Решение задачи будет выглядеть так:
- 56. Уравнение реакции выглядит так: Nа2CО3 + 2HNO3 ? 2NaNO3 + H2O + CO2 Масса и
- 57. Для составления формулы надо знать степени окисления элементов. Al –III группа (главная подгруппа). 3 внешних электрона
- 58. Что это такое, загадочное «Н.У.»? «Н.У.» - это Нормальные Условия Нормальными называются условия, при которых давление
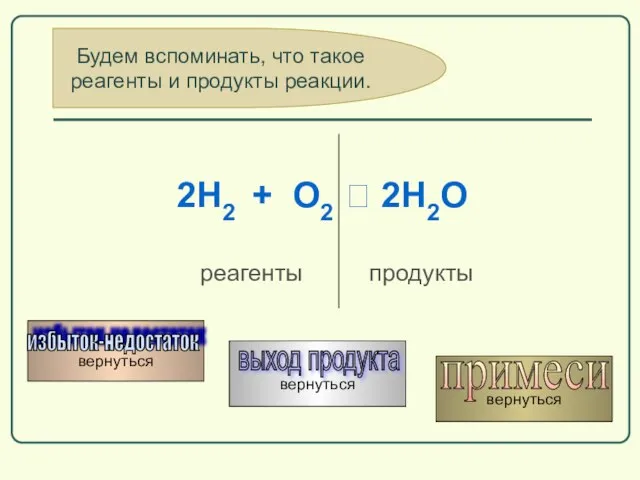
- 59. Будем вспоминать, что такое реагенты и продукты реакции. вернуться выход продукта вернуться примеси вернуться избыток-недостаток
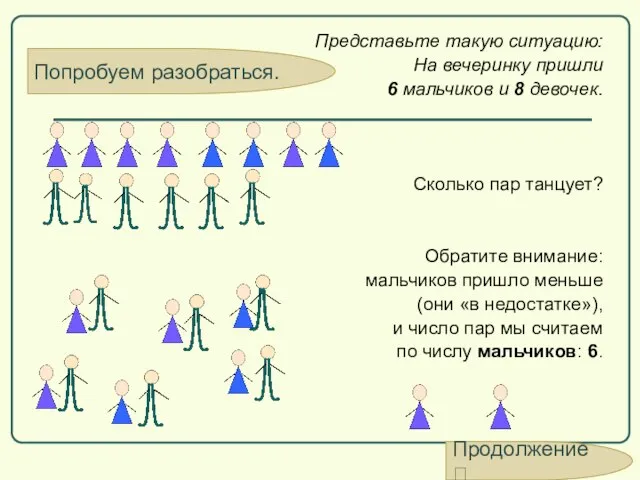
- 60. Попробуем разобраться. Представьте такую ситуацию: На вечеринку пришли 6 мальчиков и 8 девочек. Сколько пар танцует?
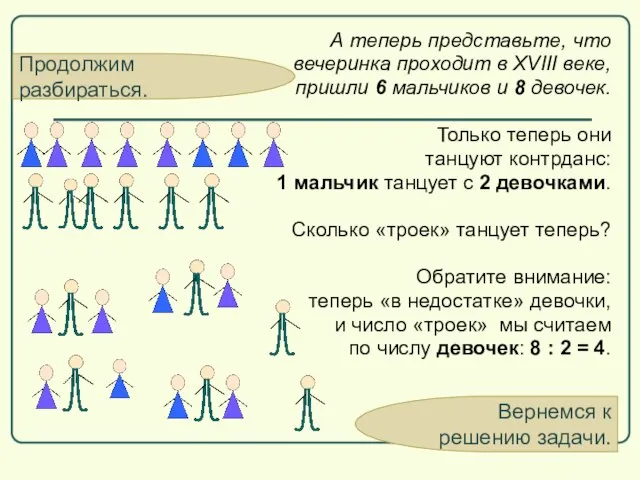
- 61. Продолжим разбираться. А теперь представьте, что вечеринка проходит в XVIII веке, пришли 6 мальчиков и 8
- 62. Почему надо сравнивать количество вещества (моли)? Посмотрите на уравнение реакции: Коэффициенты в уравнении показывают, что 2моль
- 63. Когда мы делим количество вещества на соответствующий коэффициент («есть» / «надо»), фактически мы считаем «количество комплектов»
- 65. Скачать презентацию


















































 Студенческий научный кружок кафедры фармакогнозии с курсом ботаники
Студенческий научный кружок кафедры фармакогнозии с курсом ботаники Психология личности преступника
Психология личности преступника Презентация на тему: Последовательное и параллельное соединение проводников
Презентация на тему: Последовательное и параллельное соединение проводников Вальс
Вальс Jagermeister. Дегустация в Виталюр
Jagermeister. Дегустация в Виталюр Презентация на тему Радиационный фон школьных помещений
Презентация на тему Радиационный фон школьных помещений  КАК ЗАЩИТИТЬСЯ
КАК ЗАЩИТИТЬСЯ КТО? ЧТО? ГДЕ? КОГДА? КТО? ООО «Деловая Россия» и Интернет-компания «АПСЕЛФ» приглашает талантливых креативных людей к участию в отк
КТО? ЧТО? ГДЕ? КОГДА? КТО? ООО «Деловая Россия» и Интернет-компания «АПСЕЛФ» приглашает талантливых креативных людей к участию в отк Организация образовательного процесса в инклюзивном детском саду
Организация образовательного процесса в инклюзивном детском саду ABM Art-Business-Moda. Показ одежды
ABM Art-Business-Moda. Показ одежды Образ Санкт-Петербурга в произведениях Достоевского
Образ Санкт-Петербурга в произведениях Достоевского Конституция Республики Татарстан
Конституция Республики Татарстан Презентация на тему Мое педагогическое кредо
Презентация на тему Мое педагогическое кредо Теория оптимальной фильтрации и управления
Теория оптимальной фильтрации и управления Сочинение по роману в стихах «Евгений Онегин» А. С. Пушкина
Сочинение по роману в стихах «Евгений Онегин» А. С. Пушкина СОВРЕМЕННОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАНИЕДЛЯ РОССИЙСКОЙ ИННОВАЦИОННОЙ СИСТЕМЫВ ОБЛАСТИ ЭЛЕКТРОНИКИ
СОВРЕМЕННОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАНИЕДЛЯ РОССИЙСКОЙ ИННОВАЦИОННОЙ СИСТЕМЫВ ОБЛАСТИ ЭЛЕКТРОНИКИ ДИПЛОМНАЯ РАБОТАФерменты и механизмы регуляции ферментативной активности в организме
ДИПЛОМНАЯ РАБОТАФерменты и механизмы регуляции ферментативной активности в организме CIVIL LAW Tort Law
CIVIL LAW Tort Law ГОТОВИМСЯ К ЕГЭ
ГОТОВИМСЯ К ЕГЭ Простые числа
Простые числа Вкусные числа
Вкусные числа Северный Инвестиционный Банк:Финансирование энергосберегающих проектов в России
Северный Инвестиционный Банк:Финансирование энергосберегающих проектов в России Аквалія Термаль Річ. Насичений крем для глибокого зволоження шкіри обличчя
Аквалія Термаль Річ. Насичений крем для глибокого зволоження шкіри обличчя Звук и буква «Ш»
Звук и буква «Ш» Правовые основы финансов. Финансовое право. Бюджетный и налоговый кодексы
Правовые основы финансов. Финансовое право. Бюджетный и налоговый кодексы Нулевая декларация в Латвии
Нулевая декларация в Латвии Реализация требований закона №152-ФЗ при развертывании системы защиты персональных данныхв отдельно взятом муниципальном обра
Реализация требований закона №152-ФЗ при развертывании системы защиты персональных данныхв отдельно взятом муниципальном обра Продукты Gyproc
Продукты Gyproc