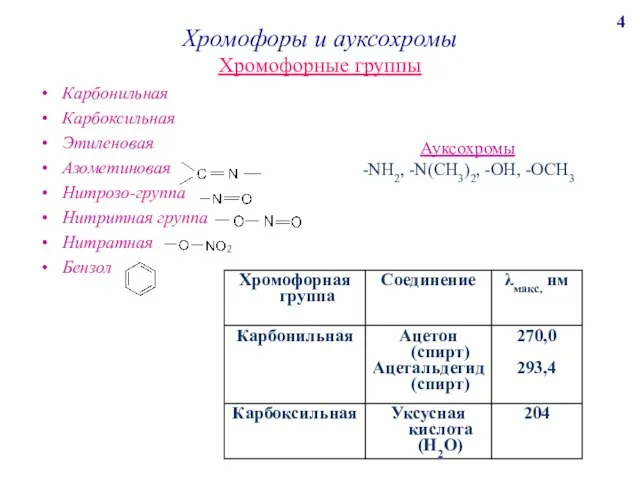
поглощения любой системы при данной длине волны; отражает индивидуальные свойства окрашенных соединений и является их определяющей характеристикой.
Физический смысл: молярный коэффициент светопоглощения представляет собой оптическую плотность раствора с концентрацией 1 моль/л, помещенного в кювету с толщиной поглощающего слоя 1 см; имеет размерность см2/моль.
Молярный коэффициент светопоглощения зависит от:
длины волны падающего света;
температуры раствора;
природы растворенного вещества.
Молярный коэффициент светопоглощения является мерой чувствительности данной фотометрической реакции.
Молярный коэффициент светопоглощения бывает истинным и кажущимся.
Значение ε характеризует два существенно важных свойства поглощающей системы:
постоянство значения ε говорит о соблюдении основного закона поглощения в определенном интервале концентраций;
значение ε удобно использовать для сравнительной оценки чувствительности фотометрической реакции
9










![Влияние концентрации [H+] на формы существования частиц 1 – CrO4-; 1 – Cr2O72-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/278914/slide-13.jpg)
 Обучение слоговому чтению в основной период обучения грамоте
Обучение слоговому чтению в основной период обучения грамоте Олимпийские игры и математика
Олимпийские игры и математика Результативное управление
Результативное управление ООО ПКФ
ООО ПКФ Новый год со смешариками
Новый год со смешариками Rock music
Rock music  Инновационная компания Promwad Инструменты для разработки ПО приставок цифрового телевидения (дистрибутив STLinux и среда разработки STW
Инновационная компания Promwad Инструменты для разработки ПО приставок цифрового телевидения (дистрибутив STLinux и среда разработки STW Generation Z
Generation Z Презентация на тему «Основы стереометрии»
Презентация на тему «Основы стереометрии» Тренингтік бөлменің жабық болуы, топты қалыптастыру, кеңестік – уақытты ұйымдастыру қай принциптің талаптары
Тренингтік бөлменің жабық болуы, топты қалыптастыру, кеңестік – уақытты ұйымдастыру қай принциптің талаптары 22 МАРТА 1943 ГОДА.
22 МАРТА 1943 ГОДА. Научно-практическая конференция Светильник из прищепок
Научно-практическая конференция Светильник из прищепок «Формирование у дошкольников знаний посредством использования проектной деятельности» Во
«Формирование у дошкольников знаний посредством использования проектной деятельности» Во Мыльные пузыри по-научному
Мыльные пузыри по-научному ИВАШУТИН ДМИТРИЙ АЛЕКСАНДРОВИЧ
ИВАШУТИН ДМИТРИЙ АЛЕКСАНДРОВИЧ Презентация на тему Внешнеэкономические связи ведущих развитых стран
Презентация на тему Внешнеэкономические связи ведущих развитых стран  Урок 15 Агрегатні стани речовини
Урок 15 Агрегатні стани речовини Профилактика деструктивного и асоциального поведения
Профилактика деструктивного и асоциального поведения Животные Красной книги Иркутской области
Животные Красной книги Иркутской области Иновационные центры в Великобритаии
Иновационные центры в Великобритаии Горы суши
Горы суши На пути к демократической России
На пути к демократической России Универсальные варианты платьев для Новогоднего корпоратива
Универсальные варианты платьев для Новогоднего корпоратива Николай Пирогов
Николай Пирогов Звуки [д] , [д,]. Буквы «Д, д»
Звуки [д] , [д,]. Буквы «Д, д» АВТО СОБЕСЕДОВАНИЕ.
АВТО СОБЕСЕДОВАНИЕ. Организация работы по профилактике злоупотребления ПАВ с обучающимися подросткового возраста
Организация работы по профилактике злоупотребления ПАВ с обучающимися подросткового возраста День победы! 9 мая
День победы! 9 мая