Содержание
- 2. Учебная цель: закрепить практические навыки ординаторов детских кардиологов по разделу “Генетические основы диагностики сердечно-сосудистых заболеваний”
- 3. Задачи Знать основные типы генных мутаций и полимофизмов, обуславливающих риски развития и неблагоприятного течения кардиоваскулярных заболеваний
- 4. Генетическая диагностика. В настоящее время описано около 2,5 тысяч моногенных наследственных синдромов, при которых наблюдается вовлечение
- 5. Генетическая диагностика. Известно около сотни наследственных заболеваний, при которых поражение сердца и сосудов являются ведущими в
- 6. Генетическая диагностика. Из общей структуры даже таких классических мультифакториальных заболеваний, как ишемическая болезнь сердца и артериальная
- 7. По сравнению с применяемыми функциональными методами диагностики сердечно-сосудистых заболеваний, данный метод позволяет более точно спрогнозировать вероятность
- 8. С учетом результатов генотипирования возможно проводить эффективную целевую профилактику заболевания сердечно-сосудистой системы.
- 9. направлена на регистрацию непосредственной причины заболевания в виде изменения нуклеотидной последовательности ДНК. ДНК-диагностика
- 10. Выявление мутации в конкретном гене напрямую свидетельствует о наличии заболевания, независимо от степени выраженности клинических симптомов,
- 11. Пресимптоматическая диагностика позволяет сформировать оптимальную тактику наблюдения для каждого пациента, с учетом генетических, анамнестических и электрокардиографических
- 12. В зависимости от пораженного гена, по-разному оценивается влияние пола и возраста на риск кардио-васкулярной смерти .
- 13. Описаны мутации, ассоциированные как с относительно благоприятным течением заболевания, так и с очень тяжелым прогнозом. Данные
- 14. Современные подходы к оценке риска внезапной смерти у таких пациентов и выбору тактики лечения в значительной
- 16. Ген ангиотензин I-превращающего фермента (ACE). Полиморфизм Alu Ins/Del. Активность фермента в крови связана с наличием варианта
- 17. Ген ангиотензин I-превращающего фермента (ACE). Полиморфизм Alu Ins/Del. Показания к анализу. Коронарная болезнь сердца, ишемическая болезнь
- 18. AGTR1 (рецептор типа I ангиотензина-II) Полиморфизм -1166 A>C Рецептор типа I ангиотензина-II (AGTR1) обуславливает основные кардиоваскулярные
- 19. AGTR1 (рецептор типа I ангиотензина-II) Полиморфизм -1166 A>C Показания к анализу: гипертония, диабетическая нефропатия, ишемическая болезнь
- 20. AGT (ангиотензиноген) Полиморфизмы T174M (C>T) и M235T (T>C) Ангиотензиноген (AGT) производится печенью и служит предшественником ангиотензина-II,
- 21. AGT (ангиотензиноген) Полиморфизмы T174M (C>T) и M235T (T>C) Показания к анализу: гипертония, старшая возрастная группа (>45
- 22. NOS3 (синтаза окиси азота) Полиморфизм E298D (G->T) Синтаза окиси азота (NOS3) синтезирует окись азота, принимающую участие
- 23. NOS3 (синтаза окиси азота) Полиморфизм E298D (G->T) Показания к анализу: инфаркт миокарда, сердечно-сосудистые заболевания, нарушение артериальной
- 24. ApoE (аполипопротеин Е) Полиморфизмы L28P (3100 T->C), ApoE*2 (Arg158Cys) и ApoE*4 (Cys112Arg) Физиология и генетика. Аполипопротеин
- 25. ApoE (аполипопротеин Е) Полиморфизмы L28P (3100 T->C), ApoE*2 (Arg158Cys) и ApoE*4 (Cys112Arg) Физиология и генетика. Участвует
- 26. ApoE (аполипопротеин Е) Полиморфизмы L28P (3100 T->C), ApoE*2 (Arg158Cys) и ApoE*4 (Cys112Arg) Показания к анализу: инфаркт
- 28. Ген метилентетрагидрофолатредуктазы (MTHFR). Метилентетрагидрофолатредуктаза (MTHFR) играет ключевую роль в метаболизме фолиевой кислоты. Фермент катализирует восстановление 5,10-метилентетрагидрофолята
- 29. Ген метилентетрагидрофолатредуктазы (MTHFR). Метилентетрагидрофолатредуктаза (MTHFR) играет ключевую роль в метаболизме фолиевой кислоты. Фермент катализирует восстановление 5,10-метилентетрагидрофолята
- 30. Ген MTHFR локализован на хромосоме 1р36.3. Известно около двух десятков мутаций этого гена, нарушающих функцию фермента.
- 31. Ген MTHFR полиморфизм MTHFR обозначается как мутация C677T. У лиц, гомозиготных по данной мутации (генотип Т/Т),
- 32. Ген MTHFR Показания к анализу: ИБС, инфаркт миокарда, атеросклероз, атеротромбоз.
- 33. Ген MTHFR
- 34. PPARD (рецептор активатора пролиферации пероксисом) Полиморфизм T(–87)C (T294C) PPARs - это группа ядерных рецепторов, которые выступают
- 35. PPARD (рецептор активатора пролиферации пероксисом) Полиморфизм T(–87)C (T294C) Показано, что PPARD играет роль в β-окислении жирных
- 36. PPARD (рецептор активатора пролиферации пероксисом) Полиморфизм T(–87)C (T294C) Показания к анализу: Сердечно-сосудистые заболевания в семейном анамнезе,
- 37. ITGA2 (Интегрин альфа-2) Аббревиатуры GPIa (гликобелок Ia), CD49B, VLA-2 (англ. «very late activation antigen 2») относятся
- 38. Ген хемокинового рецептора (CCR2). Полиморфизм Ile64Val Ген CCR2 кодирует 2 изоформы рецептора для моноцитов. Данный рецептор
- 39. Но у некоторых ВИЧ – инфицированных больных число лимфоцитов CD4+ не снижается и СПИД не развивается
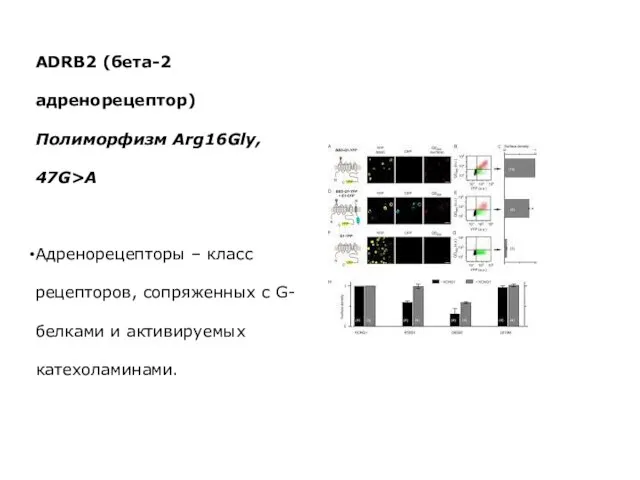
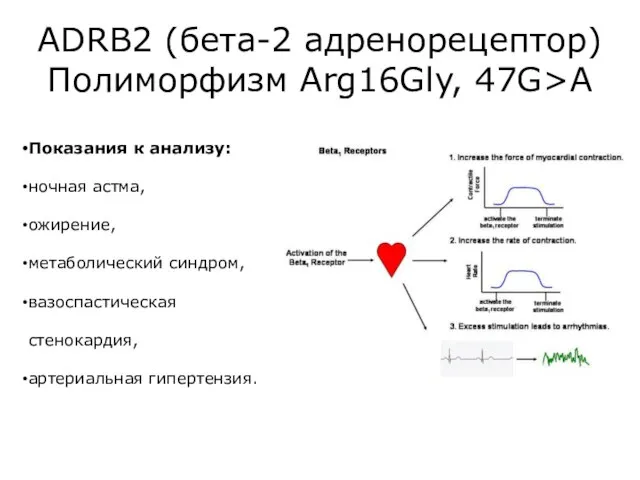
- 40. ADRB2 (бета-2 адренорецептор) Полиморфизм Arg16Gly, 47G>A Адренорецепторы – класс рецепторов, сопряженных с G-белками и активируемых катехоламинами.
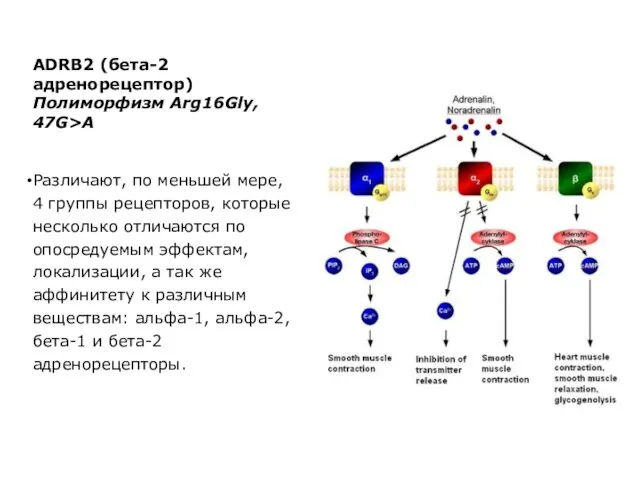
- 41. ADRB2 (бета-2 адренорецептор) Полиморфизм Arg16Gly, 47G>A Различают, по меньшей мере, 4 группы рецепторов, которые несколько отличаются
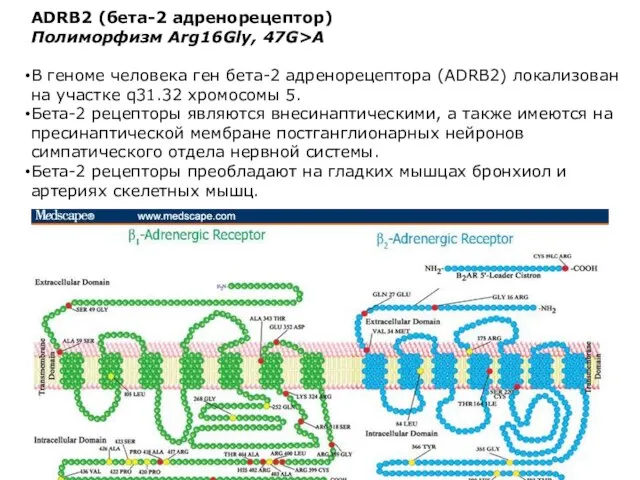
- 43. ADRB2 (бета-2 адренорецептор) Полиморфизм Arg16Gly, 47G>A В геноме человека ген бета-2 адренорецептора (ADRB2) локализован на участке
- 44. При их возбуждении обеспечивается тормозной эффект: расширение сосудов (коронарных, скелетных мышц), расслабление гладких мышц, дыхательных путей,
- 45. Показания к анализу: ночная астма, ожирение, метаболический синдром, вазоспастическая стенокардия, артериальная гипертензия. ADRB2 (бета-2 адренорецептор) Полиморфизм
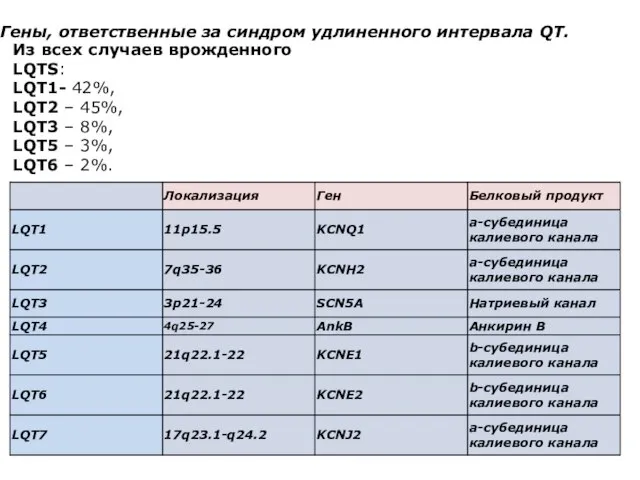
- 47. Гены, ответственные за синдром удлиненного интервала QT. Из всех случаев врожденного LQTS: LQT1- 42%, LQT2 –
- 49. Скачать презентацию




































 "Сон" кислицы
"Сон" кислицы 266562
266562 Overview of Network Security
Overview of Network Security  Raspiska
Raspiska Презентация на тему Казаков Юрий Павлович
Презентация на тему Казаков Юрий Павлович  РЯДЫ ДИНАМИКИ
РЯДЫ ДИНАМИКИ Связь популярности онлайн-курсов по изучению языков программирования и популярности самих языков
Связь популярности онлайн-курсов по изучению языков программирования и популярности самих языков Воспитательно – образовательная деятельность в дошкольной образовательной организации в соответствии с требованиями ФГОС ДО
Воспитательно – образовательная деятельность в дошкольной образовательной организации в соответствии с требованиями ФГОС ДО Табличний процесор MICROSOFT EXCEL
Табличний процесор MICROSOFT EXCEL  Стихийные и природные явления в литосфере
Стихийные и природные явления в литосфере Мой род, мое имя, моя фамилия
Мой род, мое имя, моя фамилия ИСС Аюдар Инфо. Информационно-справочная система для бухгалтера коммерческой организации государственного учреждения
ИСС Аюдар Инфо. Информационно-справочная система для бухгалтера коммерческой организации государственного учреждения 123
123 История создания алфавита
История создания алфавита Использование метода агрессии
Использование метода агрессии Анализ рекламных роликов
Анализ рекламных роликов Учимся писать цифры
Учимся писать цифры Презентация на тему Арктика 4 класс
Презентация на тему Арктика 4 класс  Десять шагов к открытию собственного бизнеса
Десять шагов к открытию собственного бизнеса Международная валютная система. Лекция 3
Международная валютная система. Лекция 3 Презентация на тему Молодёжь против наркотиков
Презентация на тему Молодёжь против наркотиков  Сообщение от аналитической группыпо итогам работы 1-го дня семинара
Сообщение от аналитической группыпо итогам работы 1-го дня семинара Экстремальные виды спорта для людей с ОЗВ
Экстремальные виды спорта для людей с ОЗВ Жилой дом с энергосберегающими технологиями и использованием альтернативных источников энергии в г.Барнауле
Жилой дом с энергосберегающими технологиями и использованием альтернативных источников энергии в г.Барнауле E-mail etiquette
E-mail etiquette Витамины, функции, взаимодействие с организмом человека
Витамины, функции, взаимодействие с организмом человека Прыжок в высоту способом перешагивание
Прыжок в высоту способом перешагивание Гражданская оборона
Гражданская оборона