Содержание
- 2. Ионная химическая связь Ионная химическая связь – это связь, образовавшаяся за счет электрического притяжения катионов к
- 3. Атомы, присоединившие свои электроны, превращаются в отрицательные ионы, или анионы, а атомы, отдавшие электроны – в
- 4. Два разноименно заряженных иона, связанные силами притяжения, не теряют способности взаимодействовать с противоположно заряженными ионами, вследствие
- 5. В ионном соединении ионы представлены как бы в виде электрических зарядов со сферической симметрией электрического поля,
- 6. Ковалентная химическая связь Ковалентная химическая связь – это связь, возникающая между атомами за счет общих электронных
- 7. 1)Связь возникает благодаря образованию общей электронной пары s-электронами атомов H2 (перекрыванию s-орбиталей)
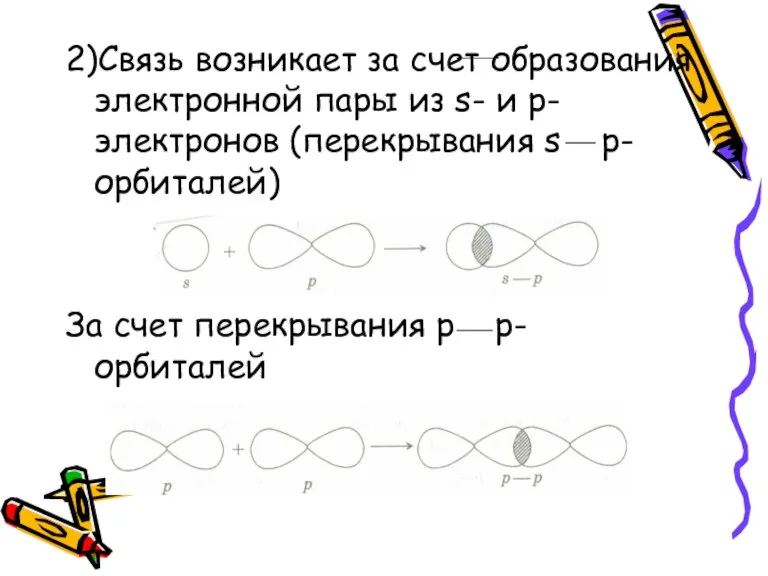
- 8. 2)Связь возникает за счет образования электронной пары из s- и p-электронов (перекрывания s p-орбиталей) За счет
- 9. Донорно-акцепторный механизм образования ковалентной связи рассмотрим на классическом примере образования иона аммония NH4 Донор имеет электронную
- 10. По способу перекрывания электронных орбиталей различают σ и π-ковалентные связи (сигма- и пи- ) 1). σ
- 11. σ-связи могут образовываться за счет перекрывания электронных орбиталей: S S (H2) S P (HCl) P P
- 12. По числу общих электронных пар, связывающих атомы, то есть по кратности, различают связи: Одинарные H2 H
- 13. По степени смещённости общих электронных пар к одному из связанных ими атомов ковалентная связь может быть
- 14. Вещества с ковалентной связью характеризуются кристаллической решеткой двух типов: Атомной – очень прочной (алмаз, графит, кварц
- 15. Металлическая связь Это связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов
- 16. Это связь ненаправленная, ненасыщенная, характеризуется небольшим числом валентных электронов и большим числом свободных орбиталей, что характерно
- 17. Водородная связь Химическая связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно
- 18. Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер.
- 19. В биополимерах – белках имеется внутримолекулярная водородная связь между карбонильным кислородом и водородом аминогруппы C Oδ-…δ+H
- 20. Единая природа химической связи Деление химических связей на группы носит условный характер. Ионную связь можно рассматривать
- 21. Различные типы связей могут содержаться в одних и тех же веществах. Например: В основаниях – между
- 22. В солях аммония, метиламмония и т.д. – между атомами азота и водорода – ковалентная полярная, а
- 23. Различные типы связей могут переходить одна в другую При электролитической диссоциации в воде ковалентных соединений ковалентная
- 25. Скачать презентацию





















 В. Гинуков. Условный портрет автора Слова
В. Гинуков. Условный портрет автора Слова Кафедра естественных наук
Кафедра естественных наук 249175
249175 Голосовой помощник Маруся
Голосовой помощник Маруся Девять предметов в системе счисления
Девять предметов в системе счисления Саморегулирующиеся организации «СРО Телеком» и СРО Телеком-Про»
Саморегулирующиеся организации «СРО Телеком» и СРО Телеком-Про» «Страницы семейного архива»
«Страницы семейного архива» Статистика терроризма
Статистика терроризма Социальные, этнические, конфессиональные и культурные различия личности
Социальные, этнические, конфессиональные и культурные различия личности Опиливание заготовок из сортового проката.Резание металла слесарной ножовкой.
Опиливание заготовок из сортового проката.Резание металла слесарной ножовкой. Гай Юлий Цезарь
Гай Юлий Цезарь Презентация на тему Новогодние игры со Снегурочкой и Дедом Морозом
Презентация на тему Новогодние игры со Снегурочкой и Дедом Морозом Презентация на тему Ёлочка из перьев
Презентация на тему Ёлочка из перьев Структура спонсорского пакета для чемпионата Санкт-Петербурга по водному поло.u
Структура спонсорского пакета для чемпионата Санкт-Петербурга по водному поло.u Заголовок Название раздела 1 Ленвендо Кто мы www.lenvendo.ru.
Заголовок Название раздела 1 Ленвендо Кто мы www.lenvendo.ru. ПОЛЯРИЗАЦИЯ И ДИФРАКЦИЯ СВЕТА
ПОЛЯРИЗАЦИЯ И ДИФРАКЦИЯ СВЕТА Тема урока: «Тайны поэзии Н.Гумилева»
Тема урока: «Тайны поэзии Н.Гумилева» Презентация на тему Лингвистический проект
Презентация на тему Лингвистический проект Цифровые автоматы, кодирование сигнала
Цифровые автоматы, кодирование сигнала Самодержавие Алексея Михайловича Тишайшего
Самодержавие Алексея Михайловича Тишайшего Презентация на тему Рулевое управление автомобиля
Презентация на тему Рулевое управление автомобиля Евгений Замятин. Роман-антиутопия "Мы“ как предупреждение потомкам
Евгений Замятин. Роман-антиутопия "Мы“ как предупреждение потомкам Модель управления имущественными комплексами вузов и вопросы распоряжения имуществом
Модель управления имущественными комплексами вузов и вопросы распоряжения имуществом Техника построения эллипсов во фронтальной плоскости проекций
Техника построения эллипсов во фронтальной плоскости проекций Нательные кресты XI – конца XIX вв. в экспозиции музея им. 1000-летия Брянска
Нательные кресты XI – конца XIX вв. в экспозиции музея им. 1000-летия Брянска Запатентован первый кассовый аппарат (1879)
Запатентован первый кассовый аппарат (1879) Система права
Система права Тест по рыбе
Тест по рыбе