Содержание
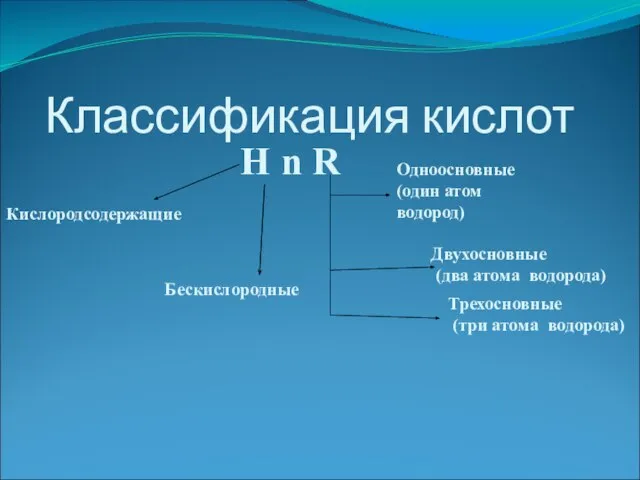
- 2. Классификация кислот H n R Кислородсодержащие Бескислородные Одноосновные (один атом водород) Двухосновные (два атома водорода) Трехосновные
- 3. Сильные кислоты HCl – HI – HNO3 – H2SO4 – HBr – соляная кислота иодоводородная кислота
- 4. Слабые кислоты -H2S -HNO2 -H2SO 3 SO2 H2O -H2CO3 CO2 H2O -H2SiO3 Сероводородная кислота Азотистая кислота
- 5. HCl H2S HNO2 H2SiO3 H2CO3 H3PO4
- 6. H2S H2SiO3 H3PO4 H2CO3 HCl HNO2
- 7. Кислотные оксиды -> Кислоты N 2O 5 -> HNO3 +5 +5 Оксид азота (V)-> Азотная кислота
- 8. Индикаторы – вещества, которые в растворах кислот изменяют свой цвет. ЛАКМУС в р-ре кислоты – красный
- 9. Химические свойства кислот 1. Взаимодействие с металлами ( стоящими до Н ) 2. Взаимодействие с основными
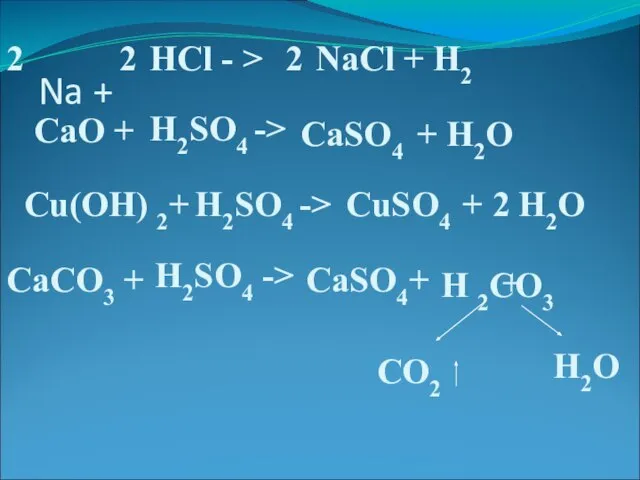
- 10. Na + NaCl + H2 HCl - > 2 2 2 CaO + H2SO4 -> CaSO4
- 11. Закончите уравнения реакций. Са + HNO2 -> Са (NO2) 2+ H2 2 FeO + HNO2 ->
- 13. Скачать презентацию








 Презентация на тему Наука и философия Естественно-научные и социально-гуманитарные знания
Презентация на тему Наука и философия Естественно-научные и социально-гуманитарные знания  partіynі-sistemi-ta-їh-tipologіya
partіynі-sistemi-ta-їh-tipologіya Мини-музей "В гостях у сказки"
Мини-музей "В гостях у сказки" Грин стар
Грин стар Тип Членистоногие
Тип Членистоногие Цифровая трансформация госуправления, цифровой двойник
Цифровая трансформация госуправления, цифровой двойник Великие Российские Математики
Великие Российские Математики Проекты для КСС
Проекты для КСС Общественное движение в 80-90-х годах
Общественное движение в 80-90-х годах Работа с текстом Закона О защите прав потребителей
Работа с текстом Закона О защите прав потребителей Деятельность человечества и глобальные экологические проблемы
Деятельность человечества и глобальные экологические проблемы МОУ СОШ №7 Г. Моздока
МОУ СОШ №7 Г. Моздока Абстракционизм в изобразительном искусстве XX века
Абстракционизм в изобразительном искусстве XX века Оценивание результатов деятельности организаций в государственном секторе науки
Оценивание результатов деятельности организаций в государственном секторе науки Два положения 2-го закона термодинамики. Круговые процессы тепловых машин. 2. Термический КПД цикла. Холодильный коэффициент. 3. Прям
Два положения 2-го закона термодинамики. Круговые процессы тепловых машин. 2. Термический КПД цикла. Холодильный коэффициент. 3. Прям O’QUVCHILAR BILIMINI O’ZLASHTIRISH SAMARADORLIGINI ANIQLASH METODI !
O’QUVCHILAR BILIMINI O’ZLASHTIRISH SAMARADORLIGINI ANIQLASH METODI ! Java Script Examples
Java Script Examples Основы конститутционного строя РБ
Основы конститутционного строя РБ Любительское художественное творчество XVIII - начала XX века
Любительское художественное творчество XVIII - начала XX века Tibbi-Sosial Ekspertiza Komissiyalarının həkim heyətinin imtahan nəticələrinin analizi
Tibbi-Sosial Ekspertiza Komissiyalarının həkim heyətinin imtahan nəticələrinin analizi Рождественская история: Роль и значение человеческого фактора в управлении
Рождественская история: Роль и значение человеческого фактора в управлении Моделирование поведения сложных динамических систем
Моделирование поведения сложных динамических систем Презентация на тему Эукариотическая клетка. Ядро
Презентация на тему Эукариотическая клетка. Ядро Сельское и городское население РК
Сельское и городское население РК Мероприятия, организованные ГБУ "ОЦРИ", в рамках Добровольческой акции"10 000 добрых дел в один день"
Мероприятия, организованные ГБУ "ОЦРИ", в рамках Добровольческой акции"10 000 добрых дел в один день" Нервная система
Нервная система ТВОРЧЕСКИЙ ОТЧЕТ
ТВОРЧЕСКИЙ ОТЧЕТ Презентация на тему Фармакология
Презентация на тему Фармакология