Содержание
- 2. Кислоты вокруг нас Состав кислот Свойства важнейших кислот Химические свойства кислот Способы получения Применение кислот Экологические
- 3. Яблочная кислота – в яблоках и ревене В природе существует множество различных кислот
- 4. Лимонная кислота – в лимонах
- 5. Кислый вкус листьев щавеля, шпината и томатов обусловлен щавелевой кислотой
- 6. Молочная кислота – в мышцах
- 7. Уксусная кислота – в уксусе
- 8. Винная кислота – в винограде
- 9. Муравьиная кислота – в яде муравьев и пчел
- 10. Кроме природных кислот, существуют и такие, которые получают промышленным путем для использования их в производстве и
- 11. Твердые кислоты: лимонная кислота, пальмитиновая кислота, борная кислота и другие.
- 12. Кислоты – это сложные вещества, в состав которых входят атомы водорода, способные замещаться металлами, и кислотные
- 13. Хлороводородная (соляная) кислота HCl – бесцветная жидкость. Она имеет запах хлороводорода. Соляная кислота ”дымит” на воздухе
- 14. Химическая формула серной кислоты – H2SO4. Плотность серной кислоты – 1,84 г /см3,плотность воды – 1
- 15. Концентрированная серная кислота разрушает ткани,
- 16. …обугливает бумагу,
- 17. …обугливает сахар.
- 18. При смешивании концентрированной серной кислоты с водой выделяется большое количество теплоты, и температура смеси повышается.
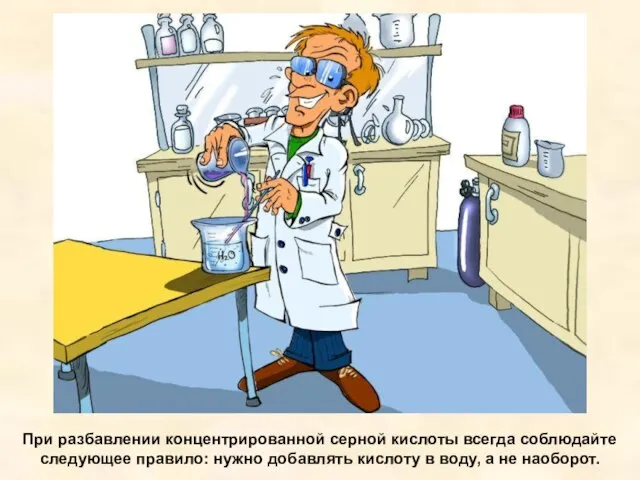
- 19. При разбавлении концентрированной серной кислоты всегда соблюдайте следующее правило: нужно добавлять кислоту в воду, а не
- 20. Хлороводородная кислота – едкое вещество, она повреждает ткань, бумагу и древесину. При попадании на кожу вызывает
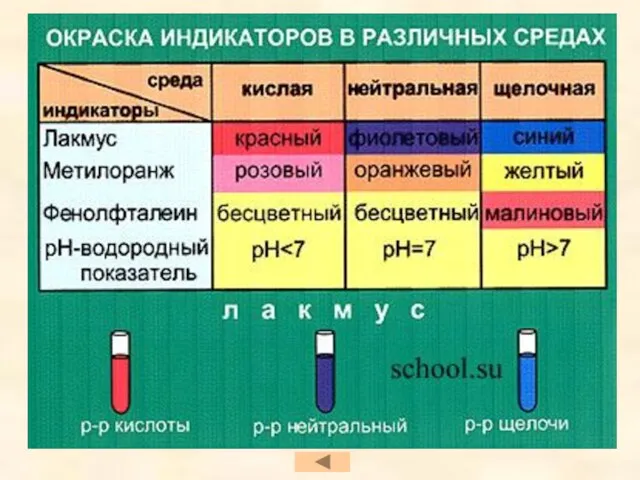
- 21. Химические свойства кислот Изменение окраски индикаторов Взаимодействие с металлами Взаимодействие с основными оксидами Взаимодействие с основаниями
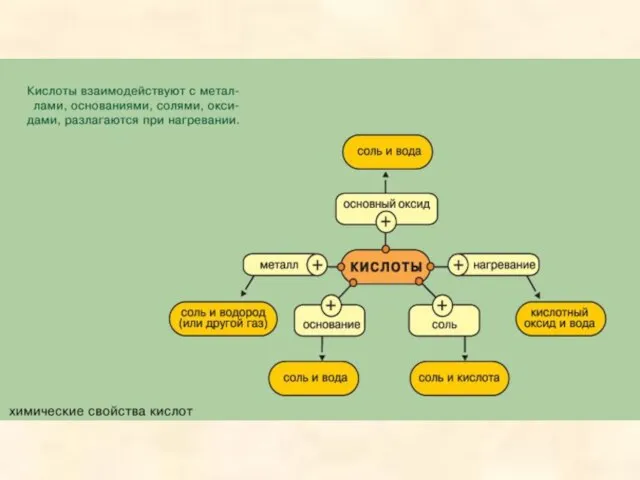
- 23. Металлы имеют разную реакционную активность, поэтому в присутствии кислот разные металлы ведут себя неодинаково. Кислоты взаимодействуют
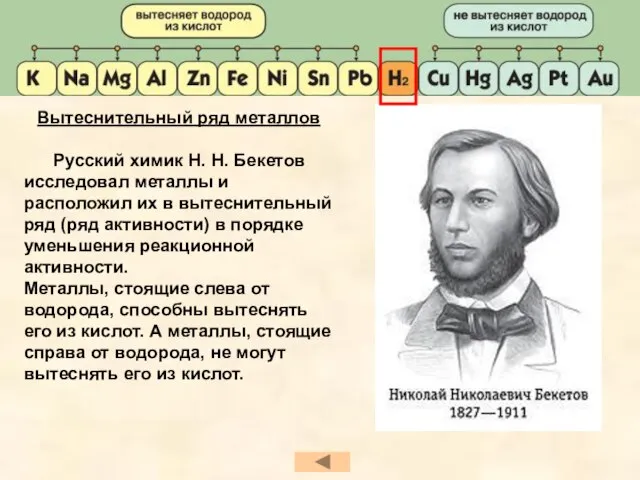
- 24. Вытеснительный ряд металлов Русский химик Н. Н. Бекетов исследовал металлы и расположил их в вытеснительный ряд
- 25. При взаимодействии кислот с оксидами металлов (основными и амфотерными оксидами) образуются соль и вода. Химическая реакция
- 26. При взаимодействии кислот с основаниями образуется соль и вода. Реакция нейтрализации. H2SO4 + 2KOH = K2SO4
- 28. Основные способы получения кислот: 1- Кислородсодержащие кислоты могут быть получены реакцией соответствующих оксидов неметаллов (кислотных оксидов)
- 29. Применение кислот разнообразно –химическая и пищевая промышленность, лабораторные и медицинские исследования, получение энергии (аккумуляторы).
- 30. Кислоты в вашей аптечке В своей домашней аптечке вы также можете найти некоторые кислоты, например: Борная
- 35. Кислотные дожди Загрязнение воздуха оксидами неметаллов, особенно оксидами серы и азота, приводит к образованию кислотных дождей.
- 40. Кислоты попадают на землю вместе с дождем, снегом или градом (так называемое «влажное осаждение»). Даже на
- 41. Кислотная среда ускоряет рост грибков и бактерий, оказывая при этом вредное влияние на растения. Некоторые растения
- 43. Кислотные дожди также разрушают здания, памятники и металлические конструкции.
- 47. Скачать презентацию








































 Тема: «Спортивные игры зимой»
Тема: «Спортивные игры зимой» Список детей на получение кроватей и полотенец
Список детей на получение кроватей и полотенец Тепловые двигатели. Паровая турбина.
Тепловые двигатели. Паровая турбина. Система образования в Англии
Система образования в Англии Геометрические паркеты
Геометрические паркеты Подходы к системному целеполаганию. Лекция 2
Подходы к системному целеполаганию. Лекция 2 Конституция РФ
Конституция РФ Проект "Задачи на смеси и сплавы"
Проект "Задачи на смеси и сплавы" Раздел #. Дизайн интерьера
Раздел #. Дизайн интерьера Основы научных исследований
Основы научных исследований 000834aa-f5be4922
000834aa-f5be4922 Погружение
Погружение Невербальное общение
Невербальное общение Однородность керамзита
Однородность керамзита Презентация на тему Длина и меры ее измерения
Презентация на тему Длина и меры ее измерения Презентация на тему Экономика как наука
Презентация на тему Экономика как наука Кофемашина Yamaguchi CoffeeMann
Кофемашина Yamaguchi CoffeeMann Танковая викторина
Танковая викторина Петр Петрович Семёнов-Тян-Шанский
Петр Петрович Семёнов-Тян-Шанский Александр
Александр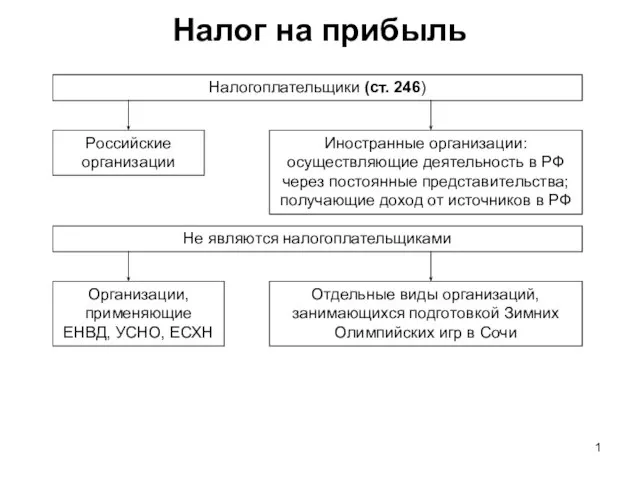 Налог на прибыль
Налог на прибыль SPORTS in Our Life
SPORTS in Our Life  Аудирование —цель и средство обучения
Аудирование —цель и средство обучения Отношения мужчины и женщины. Женская психология
Отношения мужчины и женщины. Женская психология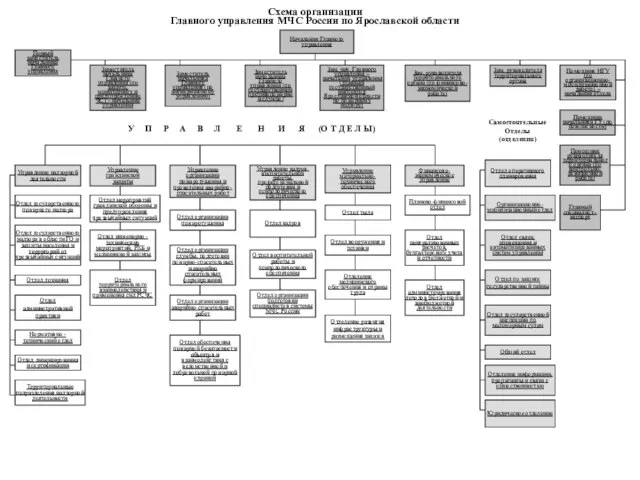 Схема организации Главного управления МЧС России по Ярославской области
Схема организации Главного управления МЧС России по Ярославской области Презентация на тему Афанасий Афанасьевич Фет (4 класс)
Презентация на тему Афанасий Афанасьевич Фет (4 класс) муниципальное образовательное учреждениеОбходская основная общеобразовательная школаУренского муниципального районаНижегор
муниципальное образовательное учреждениеОбходская основная общеобразовательная школаУренского муниципального районаНижегор куликовская битва
куликовская битва