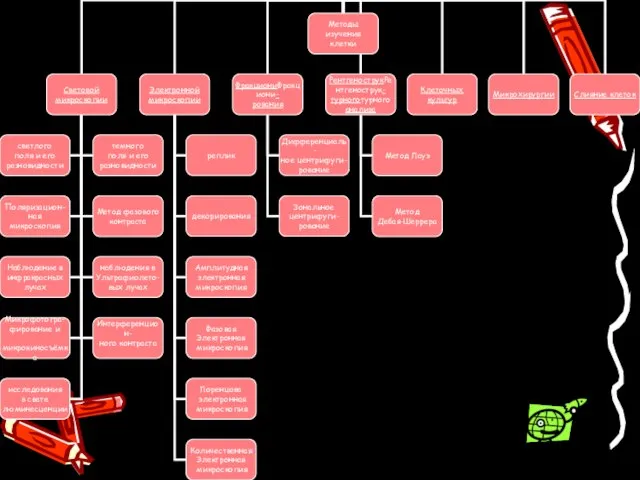
Содержание
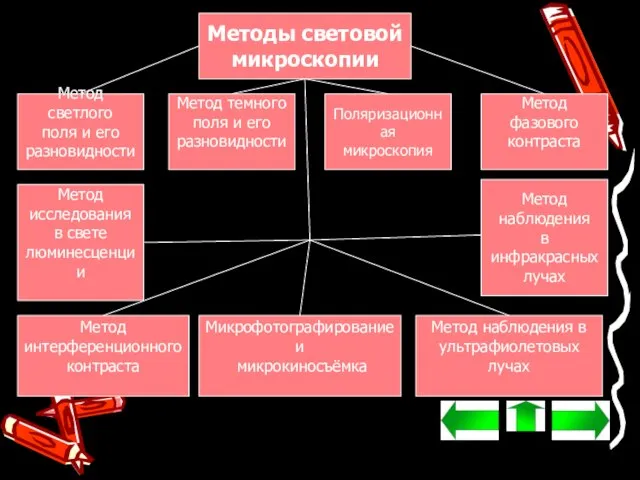
- 3. Методы световой микроскопии Метод светлого поля и его разновидности Метод темного поля и его разновидности Поляризационная
- 4. Метод световой микроскопии Методы микроскопии выбираются (и обеспечиваются конструктивно) в зависимости от характера и свойств изучаемых
- 5. Метод светлого поля и его разновидности Метод светлого поля в проходящем свете применяется при изучении прозрачных
- 6. Метод темного поля и его разновидности Метод тёмного поля в проходящем свете используется для получения изображений
- 7. Поляризационная микроскопия Поляризационная микроскопия – это метод наблюдения в поляризованном свете для микроскопического исследования препаратов, включающих
- 8. Метод фазового контраста Метод фазового контраста и его разновидность — т. н. метод «аноптрального» контраста предназначены
- 9. Типичная схема работы метода: в переднем фокусе конденсора устанавливается апертурная диафрагма, отверстие которой имеет форму кольца.
- 10. Метод наблюдения в инфракрасных лучах Метод наблюдения в инфракрасных (ИК) лучах также требует преобразования невидимого для
- 11. Метод наблюдения в ультрафиолетовых лучах Метод наблюдения в ультрафиолетовых (УФ) лучах делает возможным увеличение предельной разрешающей
- 12. Микрофотографирование и микрокиносъёмка Микрофотографирование и микрокиносъёмка – это получение с помощью микроскопа изображений на светочувствительных слоях.
- 13. Метод интерференционного контраста Метод интерференционного контраста (интерференционная микроскопия) состоит в том, что каждый луч раздваивается, входя
- 14. Метод исследования в свете люминесценции Метод исследования в свете люминесценции состоит в наблюдении под микроскопом зелено-оранжевого
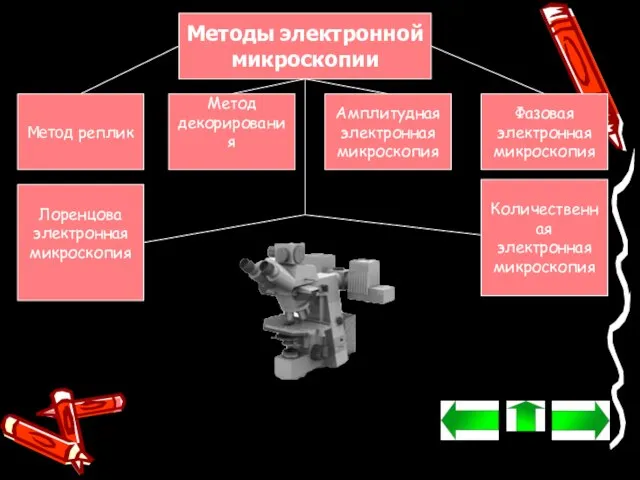
- 15. Методы электронной микроскопии Метод реплик Метод декорирования Амплитудная электронная микроскопия Фазовая электронная микроскопия Лоренцова электронная микроскопия
- 16. Метод реплик Метод реплик используют для изучения поверхностной геометрической структуры массивных тел. С поверхности такого тела
- 17. Метод декорирования Метод декорирования исследует не только геометрическую структуру поверхностей, но и микрополя, обусловленные наличием дислокаций,
- 18. Амплитудная электронная микроскопия Методы амплитудной электронной микроскопии могут быть использованы для обработки изображений аморфных и других
- 19. Фазовая электронная микроскопия Для расчёта контраста изображений кристаллических тел, имеющих регулярные структуры, а также для решения
- 20. Количественная электронная микроскопия Методы количественной электронной микроскопии — это точное измерение различных параметров образца или исследуемого
- 21. Лоренцова электронная микроскопия Областью исследования Лоренцовой электронной микроскопии, в которой изучают явления, обусловленные силой Лоренца, являются
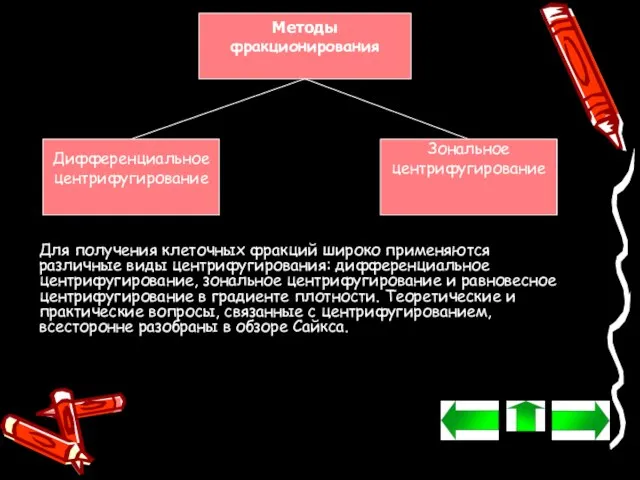
- 22. Методы фракционирования Дифференциальное центрифугирование Зональное центрифугирование Для получения клеточных фракций широко применяются различные виды центрифугирования: дифференциальное
- 23. Дифференциальное центрифугирование В случае дифференциального центрифугирования образцы центрифугируют определенное время при заданной скорости, после чего удаляют
- 24. Зональное центрифугирование Зональное центрифугирование представляет собой эффективный способ разделения структур, имеющих сходную плавучую плотность, но различающихся
- 25. Методы Рентгеноструктурного анализа Метод Лауэ Метод Дебая-Шеррера
- 26. Метод Лауэ применяется для монокристаллов. Образец облучается пучком с непрерывным спектром, взаимная ориентация пучка и кристалла
- 27. Метод Дебая-Шеррера используется для исследования поликристаллов и их смесей. Хаотическая ориентация кристаллов в образце относительно падающего
- 28. . Некоторые ткани удается разделить на отдельные клетки так, что клетки при этом остаются живыми и
- 29. С помощью микроманипулятора отдельные части клетки можно удалять, добавлять или каким-то образом видоизменять. Крупную клетку амебы
- 30. Другой тип искусственных клеток может быть получен в результате слияния клеток одного или разных видов. Чтобы
- 31. Список использованной литературы: http://www.mikroskopia.ru http://http://www.http://www.rdio.ru http://ru.wikipedia.org http://www. Google.соm http://www.krugosvet.ru 10
- 33. Скачать презентацию

























 Презентация на тему Животные леса
Презентация на тему Животные леса Государственные программы - инструмент повышения эффективности бюджетных расходов
Государственные программы - инструмент повышения эффективности бюджетных расходов Ты и твоё имя
Ты и твоё имя 7_КРЗ ЛЭП_ДЗ
7_КРЗ ЛЭП_ДЗ Презентация на тему Особо охраняемые территории России
Презентация на тему Особо охраняемые территории России От самоидентификации человека к самоуправлению и развитию. Занятие 3. Овладение методологией познания и творчества
От самоидентификации человека к самоуправлению и развитию. Занятие 3. Овладение методологией познания и творчества Презентация на тему Мотивация учебно-познавательной деятельности учащегося
Презентация на тему Мотивация учебно-познавательной деятельности учащегося  Тридцатилетняя война (1618-1648гг)
Тридцатилетняя война (1618-1648гг) Виды денег
Виды денег Анализ работы школьной научной кафедры учителей начальных классовза 2011-2012 учебный год
Анализ работы школьной научной кафедры учителей начальных классовза 2011-2012 учебный год Мини-музей Русская матрешка
Мини-музей Русская матрешка Студія Англійської мови I like English
Студія Англійської мови I like English Фонетика
Фонетика Назови одним словом. Игра
Назови одним словом. Игра Интеллектуальная система рекомендаций в принятии решений на основе реального распознавания психотипа человека (Автоматизирова
Интеллектуальная система рекомендаций в принятии решений на основе реального распознавания психотипа человека (Автоматизирова Значение нефти и газа в народном хозяйстве РФ
Значение нефти и газа в народном хозяйстве РФ Люди, которые живут в моей голове
Люди, которые живут в моей голове Может ли человек жить без растений?
Может ли человек жить без растений? Презентация на тему Формирование у детей представлений о здоровом образе жизни
Презентация на тему Формирование у детей представлений о здоровом образе жизни Театральные профессии
Театральные профессии 1432499
1432499 Люся Vs ИУ 7
Люся Vs ИУ 7 QeGamePe
QeGamePe СИД. Переписка
СИД. Переписка Внешние источники финансовых ресурсов. Состав и особенности формирования в рыночных условиях
Внешние источники финансовых ресурсов. Состав и особенности формирования в рыночных условиях Буква «Х»
Буква «Х» Пожары и взрывы
Пожары и взрывы Презентация на тему Дискретный анализ
Презентация на тему Дискретный анализ