Содержание
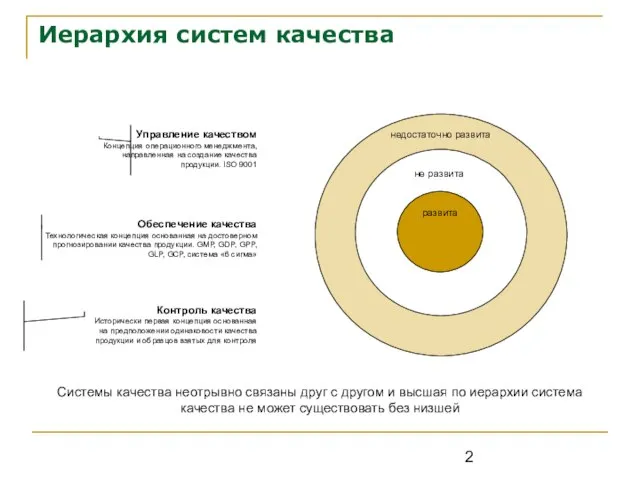
- 2. Иерархия систем качества Контроль качества Исторически первая концепция основанная на предположении одинаковости качества продукции и образцов
- 3. Система обеспечения качества производства - GMP Концепция была разработана в начале 70-х годов XX века и
- 4. Внедрение международных стандартов GMP как гарантия качества лекарственных средств. Кому необходимо GMP? Государству как гаранту прав
- 5. Общественные риски, связанные с качеством лекарственных средств Присутствие на российском фармацевтическом рынке недоброкачественных и фальсифицированных лекарственных
- 6. Обеспечение независимости и защищенности России в области лекарственного обеспечения Российские предприятия, имеющие производственную лицензию – 525
- 7. Группы предприятий, исходя из технической готовности к переходу на новые правила GMP Группа А – 47
- 8. Сроки и риски реализации проекта При условии комплексной реализации плана, окончательная дата внедрения систем обеспечения качества
- 9. Предлагаемая последовательность реализации проекта Публикация информации о начале реализации проекта, а также о графике и плане
- 10. Политика Росздравнадзора в области обеспечения качества лекарственных средств Совершенствование контроля в сфере обращения лекарственных средств должно
- 11. Повышение эффективности системы выявления и изъятия недоброкачественной продукции Субъекты обращения лекарственных средств должны проверяться на постоянной
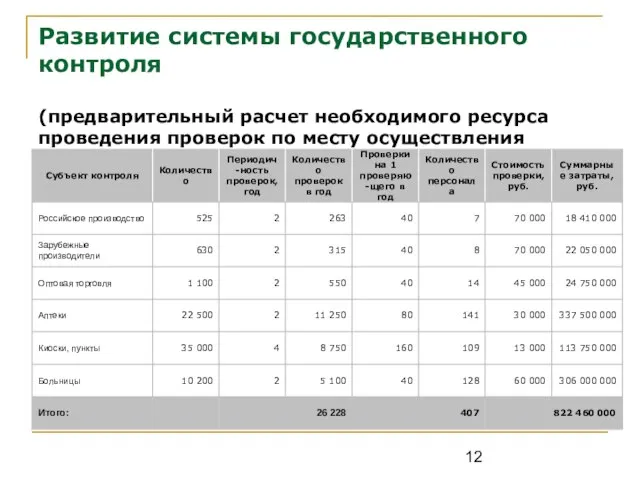
- 12. Развитие системы государственного контроля (предварительный расчет необходимого ресурса проведения проверок по месту осуществления деятельности)
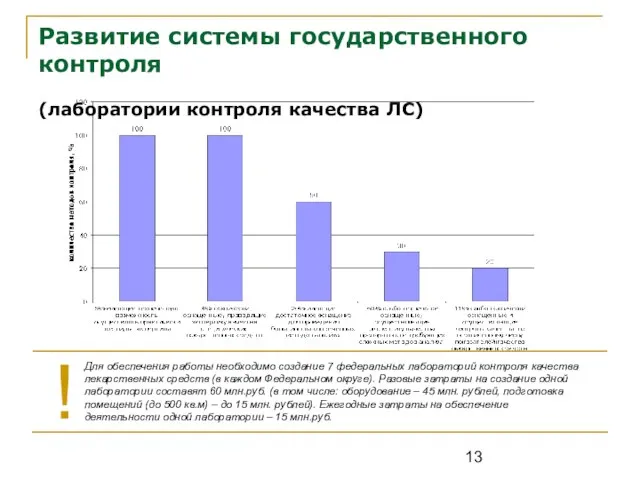
- 13. Развитие системы государственного контроля (лаборатории контроля качества ЛС) Для обеспечения работы необходимо создание 7 федеральных лабораторий
- 14. План перехода на международные стандарты производства и контроля качества ЛС Внесение соответствующих изменений в Федеральные законы
- 16. Скачать презентацию










 Когда не нужно получать согласие сотрудника на обработку его персональных данных
Когда не нужно получать согласие сотрудника на обработку его персональных данных Спортивные сборы по программе Олимпийская долина
Спортивные сборы по программе Олимпийская долина Самый лучший день-сегодня.Самый лучший отдых-работа.Самая лучшая работа та, которую ты любишь.Самая большая потр
Самый лучший день-сегодня.Самый лучший отдых-работа.Самая лучшая работа та, которую ты любишь.Самая большая потр Презентация на тему "Современные методы обучения чтению, как путь к расширению личности ребёнка" - скачать презентации по Пед
Презентация на тему "Современные методы обучения чтению, как путь к расширению личности ребёнка" - скачать презентации по Пед Презентация на тему Народ России СААМЫ
Презентация на тему Народ России СААМЫ Здравствуй, школа!
Здравствуй, школа! Использование ИКТ для повышения качества обучения учащихся на уроках в начальных классах
Использование ИКТ для повышения качества обучения учащихся на уроках в начальных классах Положительное и отрицательное влияние сети Интернет
Положительное и отрицательное влияние сети Интернет ОТЧЕТ ПО ТЕМЕ: «РАЗРАБОТКА КОНЦЕПЦИИ ФОРМИРОВАНИЯ И РАЗВИТИЯ СТРУКТУРЫ СЕТИ МАГИСТРАЛЬНЫХ ГАЗОПРОВОДОВ РФ В УСЛОВИЯХ ЛИБЕРАЛИЗА
ОТЧЕТ ПО ТЕМЕ: «РАЗРАБОТКА КОНЦЕПЦИИ ФОРМИРОВАНИЯ И РАЗВИТИЯ СТРУКТУРЫ СЕТИ МАГИСТРАЛЬНЫХ ГАЗОПРОВОДОВ РФ В УСЛОВИЯХ ЛИБЕРАЛИЗА Архивация файлов. Файлы и файловая система
Архивация файлов. Файлы и файловая система Архитектура модерна
Архитектура модерна Издержки и результаты хозяйственной деятельности, ее экономическая эффективность
Издержки и результаты хозяйственной деятельности, ее экономическая эффективность  Написание "ь" после шипящих
Написание "ь" после шипящих Международный трибунал
Международный трибунал Школа обучения. Стратегическое управление современной организацией
Школа обучения. Стратегическое управление современной организацией Merry christmas and happy new year
Merry christmas and happy new year Обзор ключевых изменений в Федеральные государственные образовательные стандарты начального и основного общего образования
Обзор ключевых изменений в Федеральные государственные образовательные стандарты начального и основного общего образования ООО «Белвнешреклама» Рекламные конструкции в гипермаркете «Вестер» Тел./факс: (017) 233 97 37
ООО «Белвнешреклама» Рекламные конструкции в гипермаркете «Вестер» Тел./факс: (017) 233 97 37  Презентация на тему Растровое кодирование графической информации
Презентация на тему Растровое кодирование графической информации  Оценки достижений учащихся через личностные компетенции учащихся
Оценки достижений учащихся через личностные компетенции учащихся Христианская семья
Христианская семья Государство и гражданское общество
Государство и гражданское общество МАДОУ детский сад «Надежда» г.Кирово-Чепецк Кировская область Коррекционно-педагогическая работа с использованием ло
МАДОУ детский сад «Надежда» г.Кирово-Чепецк Кировская область Коррекционно-педагогическая работа с использованием ло GLOBAL SIM
GLOBAL SIM Король. Шахматы в школе
Король. Шахматы в школе Твір. Українська мова. 8 клас
Твір. Українська мова. 8 клас Реализация проекта по персонифицированному финансированию дополнительного образования детей
Реализация проекта по персонифицированному финансированию дополнительного образования детей Вечер чая
Вечер чая