Содержание
- 2. Краткий обзор стандартов GхP Рассматриваемые вопросы: Система обеспечения качества в сфере обращения лекарственных средств Нормы надлежащей
- 3. Качество – это совокупность характеристик объекта, относящихся к его особенности удовлетворять установленные и предполагаемые потребности (ISO
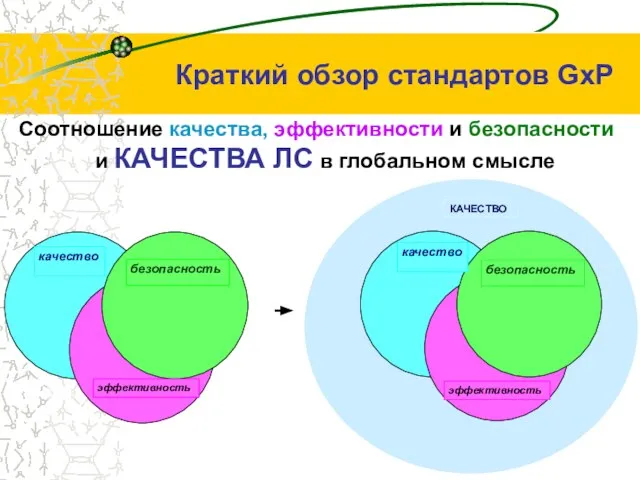
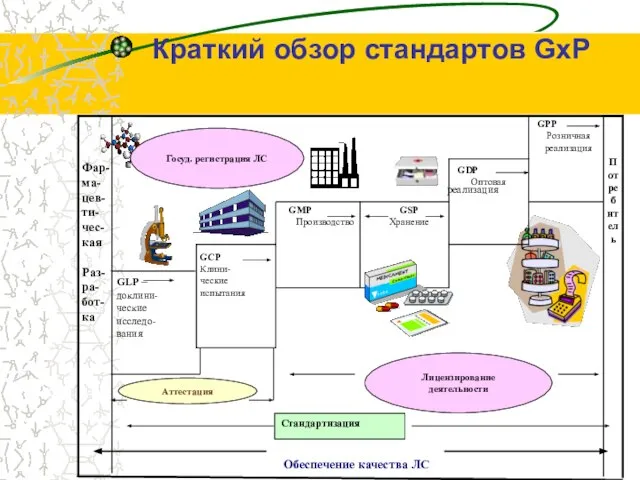
- 4. КАЧЕСТВО Соотношение качества, эффективности и безопасности и КАЧЕСТВА ЛС в глобальном смысле эффективность безопасность качество Краткий
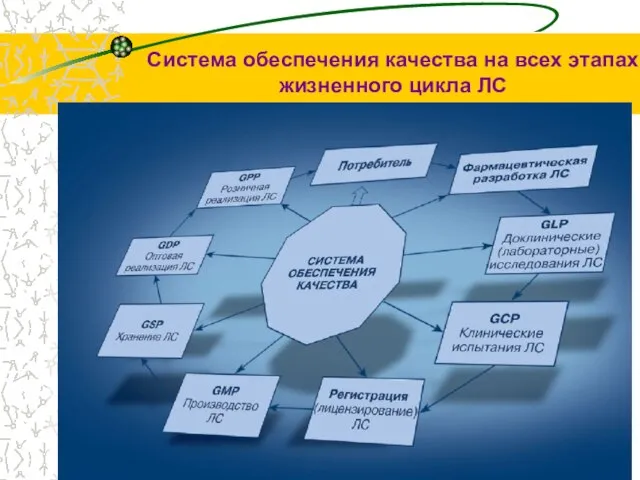
- 5. Система обеспечения качества на всех этапах жизненного цикла ЛС
- 6. реализация Краткий обзор стандартов GхP
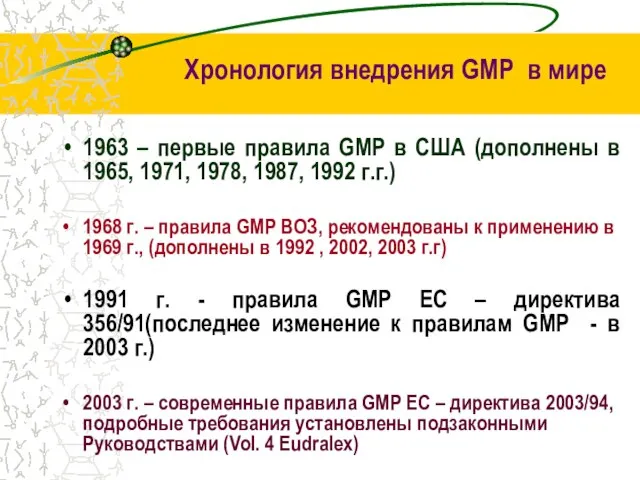
- 7. Хронология внедрения GMP в мире 1963 – первые правила GMP в США (дополнены в 1965, 1971,
- 8. Сейчас более 150 стран признают стандарты GMP, используя систему ВОЗ сертификации лекарственных средств для международной торговли
- 9. 1991 г. - правила GMP в СССР (РД 64-125-91) Правила GMP в России ОСТ 42-510-98 ГОСТы
- 10. Требования GMP при производстве лекарственных средств в ЕС Требования GMP устанавливаются Директовой ЕС (общий Закон для
- 11. Необходимость введения требований GMP вызвана следующим: 1. Реструктуризация в сфере обращения лекарственных средств: Производство лекарственных средств
- 12. Необходимость введения требований GMP вызвана следующим: 2. Экономическая интеграция, планирующееся вступление в ВТО 3. Создание систем
- 13. Необходимость введения требований GMP вызвана следующим: 5. Реформирование системы лицензирования производства лекарственных средств, оптовой, розничной реализации
- 14. Необходимость введения требований GMP вызвана следующим: 7. Создание и введение в действие Государственных Фармакопей в странах
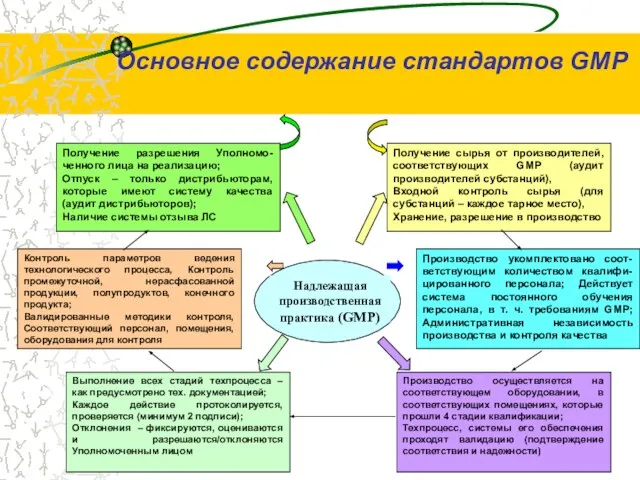
- 15. Основное содержание стандартов GМP Надлежащая производственная практика (GMP) Получение сырья от производителей, соответствующих GMP (аудит производителей
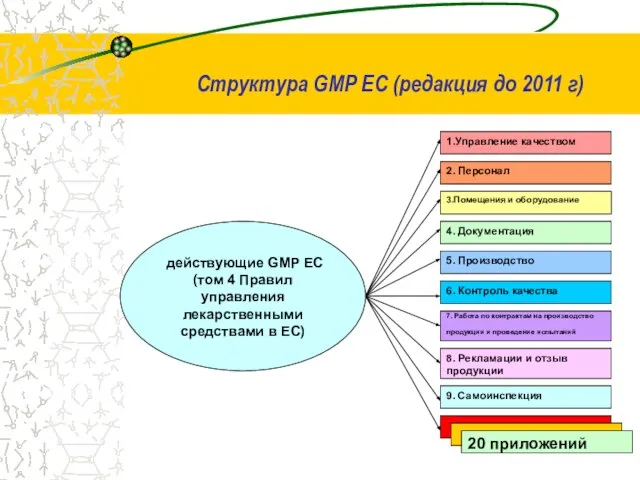
- 16. Структура GMP ЕС (редакция до 2011 г)
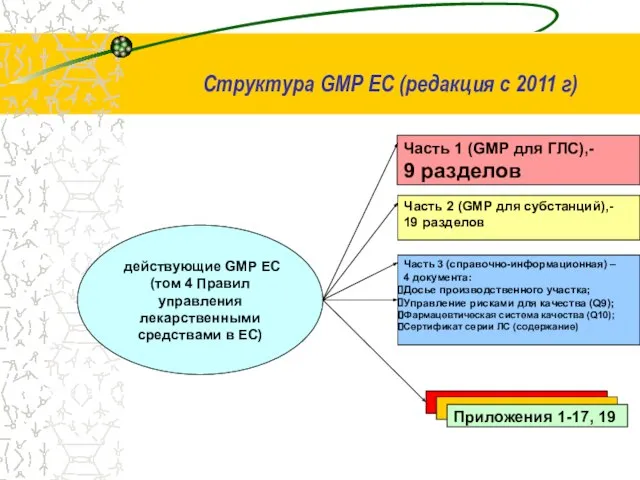
- 17. Структура GMP ЕС (редакция с 2011 г) Часть 1 (GMP для ГЛС),- 9 разделов Часть 2
- 18. Содержание GMP EU (1) Часть I Основные требования к надлежащему производству лекарственных средств Управление качеством (Quality
- 19. Содержание GMP EU (2) Часть II Основные требования к активным фармацевтических ингредиентам (AФИ), используемым как исходное
- 20. Содержание GMP EU (3) Часть III Связанные документы Досье производственного участка; Управление рисками для качества (Q9);
- 21. Содержание GMP EU (4) Приложения 1. Производство стерильных лекарственных средств 2. Производство биологических лекарственных средств 3.
- 22. Правила GDP EU (Directive 94/С63/03) Надлежащая дистрибьюторская практика Принцип Персонал Документация Помещения и оборудование Поставки заказчикам
- 23. 1. Создание нормативно-технических документов (стандартов, руководств) 2. Создание нормативно-правового поля (приказы, процедуры инспектирования) 3. Организация Инспектората
- 24. 1. Создание нормативно-технических документов (стандартов, руководств) Нормативно-технический документ, гармонизированный с GMP EU (Vol. 4 EudraLex) в
- 25. 2. Создание нормативно-правового поля (приказы, процедуры инспектирования) Ситуация в РФ GMP не являются лицензионными требованиям при
- 26. 3. Организация Инспектората GMP/GDP в составе уполномоченного регуляторного органа(ов) c соответствующими полномочиями Ситуация в РФ Инспекторат
- 27. 4. Обучение инспекторов, внедрение системы качества инспектората Ситуация в РФ Система качества инспектората GMP/GDP отсутствует, т.к.
- 28. Состояние фармпромышленности в РФ: Более 700 предприятий, имеющих лицензии на промышленное производство ЛС; Соответствует GMP –
- 29. Документ (стандарт), гармонизированный с GMP ЕС появился в 2001 г, был пересмотрен в 2008, 2010, 2011
- 30. Гармонизация процедур инспектирования: 1. Периодичность инспектирования (не чаще 1 раза в год, не реже 1 раза
- 31. Наиболее принципиальные изменения в Лицензионных условиях - п.1.4. : «Промышленное производство лекарственных средств проводится с соблюдением
- 32. Добровольная сертификация на соответствие GMP в Украине существует с 2002 года (приказ МЗ Украины №391, зарегистированный
- 33. Результаты GMP- сертификации в 2009 г.: Имплементация стандартов GМP в Украине
- 34. Процедуры лицензирования производства ЛС и сертификации по GMP: Лицензирование - обязательно; Сертификация – добровольно! Для получения
- 35. Сертификация (подтверждение соот-ветствия требованиям GMP) нужна: При экспорте (по требованию страны-импортера) При контрактном производстве Для достижения
- 36. Система сотрудничества фармацевтических инспекций PIC/S – глобальная мировая организация, объединяющая регуляторные органы в сфере обращения лекарственных
- 37. Членство PIC/S дает следующие главные преимущества: Гармонизация стандартов и процедур инспектирования в сфере производства лекарственных средств;
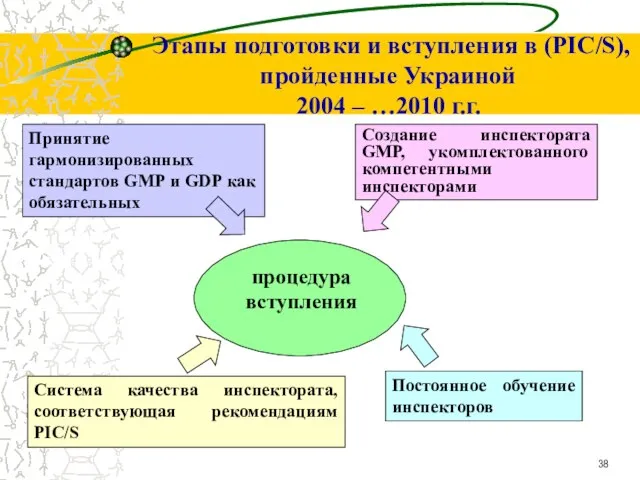
- 38. Этапы подготовки и вступления в (PIC/S), пройденные Украиной 2004 – …2010 г.г. Принятие гармонизированных стандартов GMP
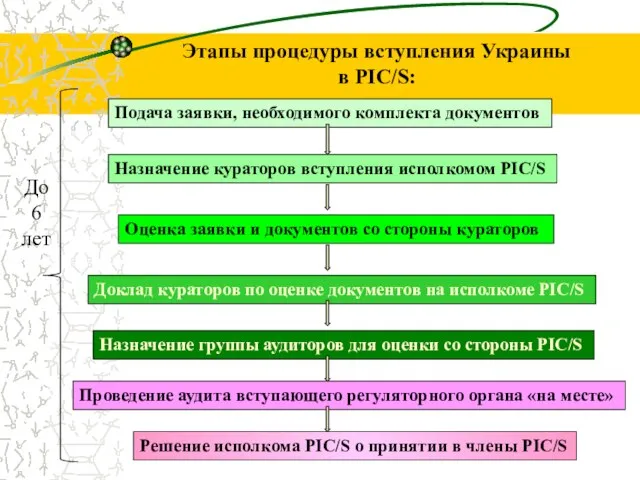
- 39. Этапы процедуры вступления Украины в PIC/S: Подача заявки, необходимого комплекта документов Оценка заявки и документов со
- 40. 8 ноября 2010 г. на заседании Исполнительного Комитета PIC/S принято решение о вступлении Гослекинспекции МЗ Украины
- 41. Наиболее проблемные требования GMP: 1. Валидация процессов, квалификация оборудования. 2. Предупреждение перекрестной контаминации. 3. Препараты для
- 42. Проблема: Проведение квалификации оборудования, валидации техпроцессов, аналитических методик. Путь решения: Участие в семинарах, тренинговых курсах, привлечение
- 43. Проблема: Уполномоченные лица не соответствуют квалификационным требованиям. Путь решения: Повышение квалификации Уполномоченных лиц по специальной программе,
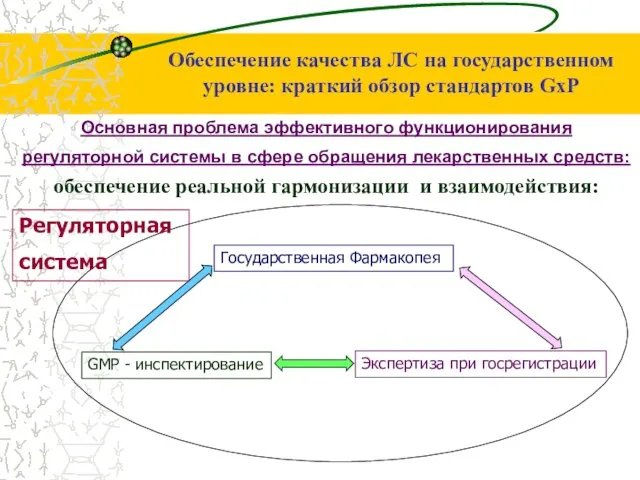
- 44. Основная проблема эффективного функционирования регуляторной системы в сфере обращения лекарственных средств: обеспечение реальной гармонизации и взаимодействия:
- 46. Скачать презентацию

































 Конструкторская и технологическая документация изучение стандартов ЕСКД
Конструкторская и технологическая документация изучение стандартов ЕСКД Средства физической культуры в регулировании работоспособности
Средства физической культуры в регулировании работоспособности Финансовая грамотность. 10 советов по управлению личными финансами
Финансовая грамотность. 10 советов по управлению личными финансами Равнины суши и о том как их готовить.
Равнины суши и о том как их готовить. Управление качеством образования на основе выявленных профессиональных дефицитов
Управление качеством образования на основе выявленных профессиональных дефицитов Салат из свежих огурцов с яйцом
Салат из свежих огурцов с яйцом Государственное устройство в Российской Федерации и Санкт-Петербурге: система разделения ветвей власти
Государственное устройство в Российской Федерации и Санкт-Петербурге: система разделения ветвей власти Дача на Севере
Дача на Севере Определение арифметического корня п-ой степени
Определение арифметического корня п-ой степени CashFlow
CashFlow Презентация на тему Стресс и пути его преодоления
Презентация на тему Стресс и пути его преодоления  Предмет химии. Вещества
Предмет химии. Вещества Homeless Pets
Homeless Pets ЗАДАЧИ РЕАЛИЗАЦИИ ПРОЕКТОВ ПОВЫШЕНИЯ НАДЕЖНОСТИ РАСПРЕДЕЛИТЕЛЬНЫХ ЭЛЕКТРИЧЕСКИХ СЕТЕЙ ЗА СЧЕТ НОРМАЛИЗАЦИИ ПОТОКОВВ РЕАКТИВНОЙ
ЗАДАЧИ РЕАЛИЗАЦИИ ПРОЕКТОВ ПОВЫШЕНИЯ НАДЕЖНОСТИ РАСПРЕДЕЛИТЕЛЬНЫХ ЭЛЕКТРИЧЕСКИХ СЕТЕЙ ЗА СЧЕТ НОРМАЛИЗАЦИИ ПОТОКОВВ РЕАКТИВНОЙ «Истории из малахитовой шкатулки» (по сказу Павла Бажова «Хрупкая веточка»)
«Истории из малахитовой шкатулки» (по сказу Павла Бажова «Хрупкая веточка») Новый канал стимулирования электронных покупок на примере проекта "Парк Подарков"
Новый канал стимулирования электронных покупок на примере проекта "Парк Подарков" перевыборы
перевыборы Місцеве самоврядування та його роль
Місцеве самоврядування та його роль 20140929_prezentatsiya_k_issledovatelskoy_rabote
20140929_prezentatsiya_k_issledovatelskoy_rabote Презентация на тему Печоро-Илычский заповедник
Презентация на тему Печоро-Илычский заповедник kakuyu_rol_igraet_priroda_v_razvitii_kultury
kakuyu_rol_igraet_priroda_v_razvitii_kultury Юношество
Юношество Лидерство в тестировании: 5 шагов Александр Орлов Happy-PM.com, Stratoplan.ru
Лидерство в тестировании: 5 шагов Александр Орлов Happy-PM.com, Stratoplan.ru Литература по праву интеграционных объединений
Литература по праву интеграционных объединений Вытягивающая система производства арта в RTS
Вытягивающая система производства арта в RTS Программа коррекционной работы
Программа коррекционной работы Презентация на тему Плоскость. Прямая. Луч
Презентация на тему Плоскость. Прямая. Луч Основные факторы, влияющие на электоральное поведение граждан
Основные факторы, влияющие на электоральное поведение граждан