Содержание
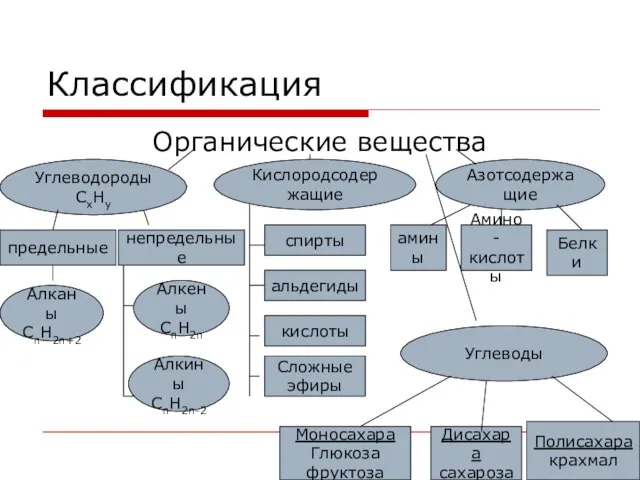
- 2. Классификация Органические вещества Углеводороды СхНу Кислородсодержащие Азотсодержащие Углеводы предельные непредельные Алканы СnH2n+2 Алкины СnH2n-2 Алкены СnH2n
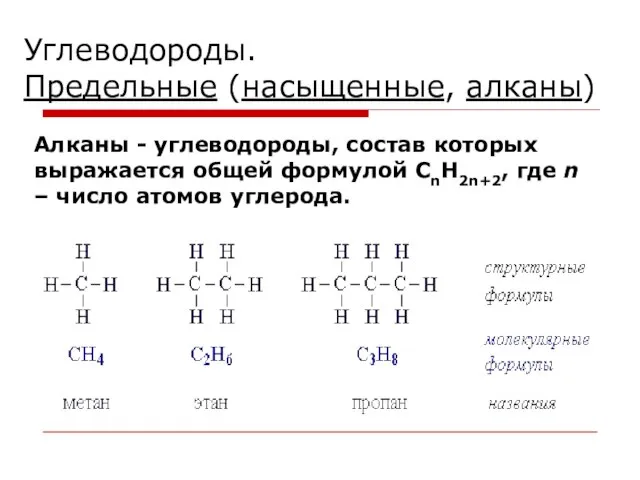
- 3. Углеводороды. Предельные (насыщенные, алканы) Алканы - углеводороды, состав которых выражается общей формулой CnH2n+2, где n –
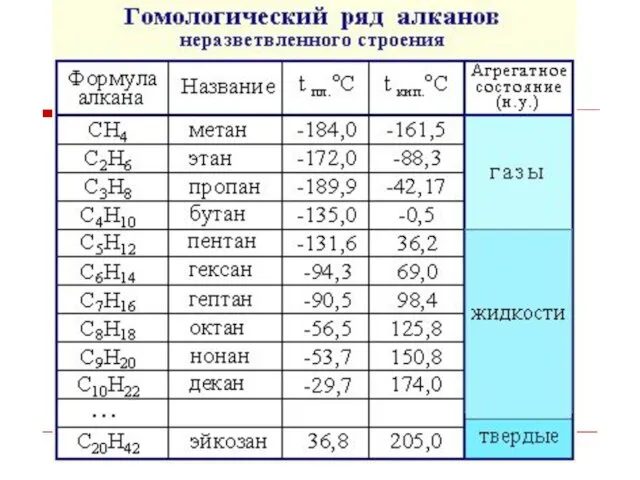
- 5. Гомологи – вещества одного класса, отличающиеся друг от друга на одну или несколько групп – СН2
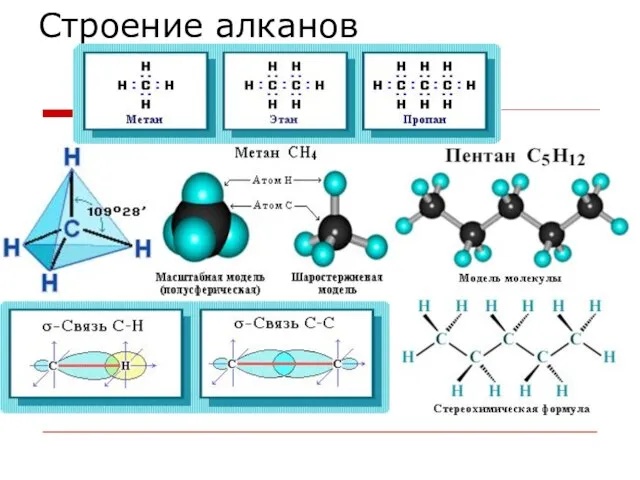
- 6. Строение алканов
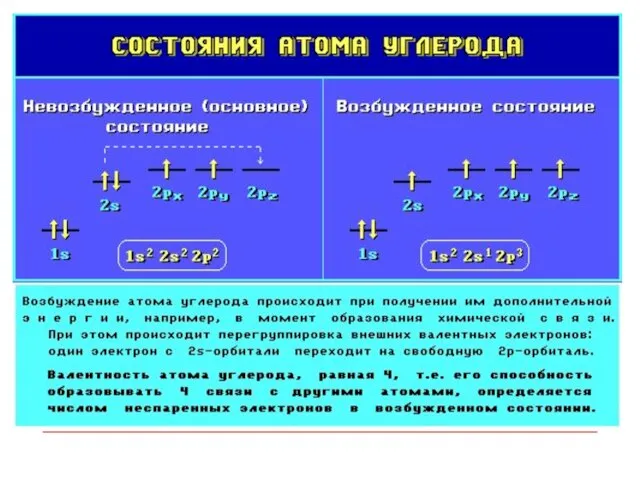
- 8. Атомные орбитали Атомная орбиталь (АО) - область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле
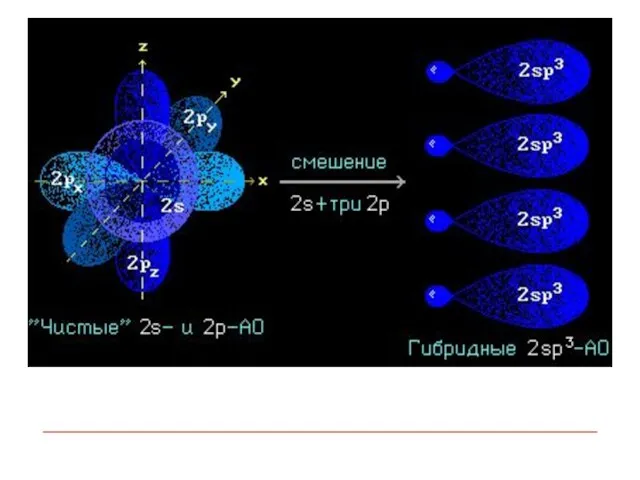
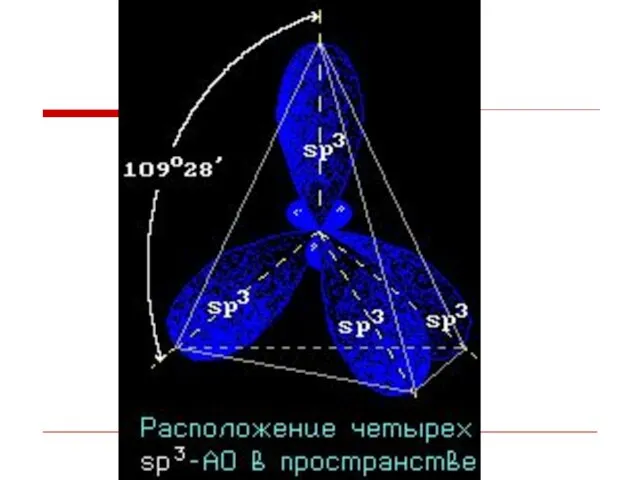
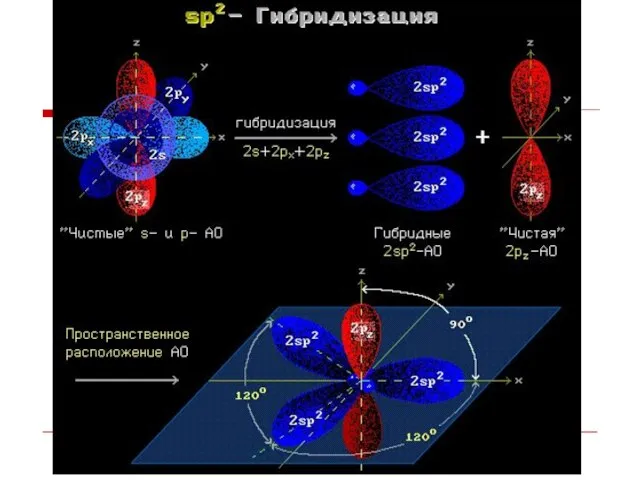
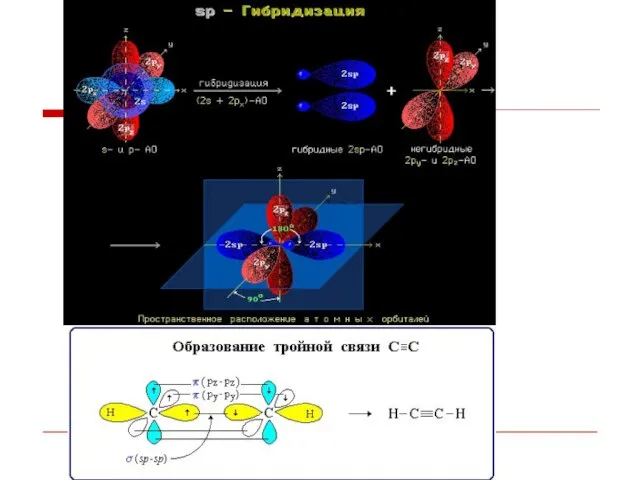
- 9. Гибридизация АО - это взаимодействие (смешение) разных по типу, но близких по энергии атомных орбиталей данного
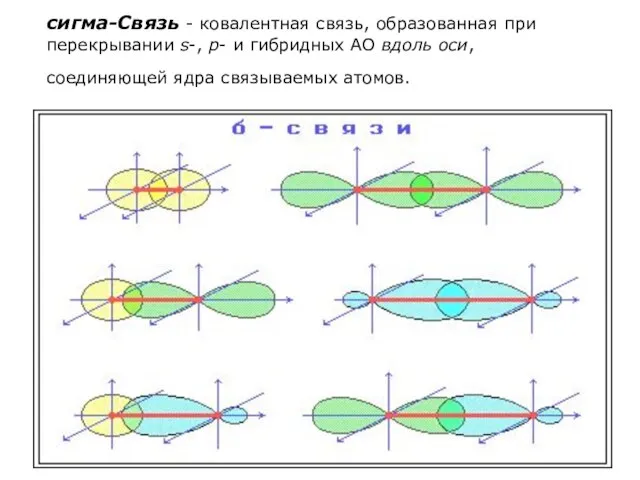
- 11. сигма-Связь - ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра
- 13. Задание. Построить и назвать изомеры для гексана.
- 14. Алгоритм построения изомеров для алканов По корню слова строят углеродный скелет (гекса – 6 атомов углерода)
- 15. Пускают разветвление с другой стороны С – С – С – С С С это третий
- 16. Доставить атомы водорода с учётом, что углерод 4-хвалентен СН3 – СН2 – СН2 – СН2 –
- 17. Порядок построения названия 1.Выбрать в молекуле главную углеродную цепь. Во-первых, она должна быть самой длинной. Во-вторых,
- 18. Порядок построения названия 2. Пронумеровать атомы углерода в главной цепи с той стороны, к которой ближе
- 19. Порядок построения названия 3. Указать в префиксе (приставке) положение (номер атома углерода) и название радикала, заместителя,
- 20. Порядок построения названия 4. Записать корень, соответствующий числу атомов углерода в главной цепи. 5. Если есть
- 21. Таким образом, в названии разветвленного алкана корень+суффикс – название нормального алкана (греч. числительное+суффикс "ан"), приставки –
- 22. Назовём полученные изомеры СН3 – СН2 – СН2 – СН2 – СН2 – СН3 СН3 –
- 23. Химические свойства алканов Так как все связи насыщены до предела, для алканов характерны реакции Замещение СН4
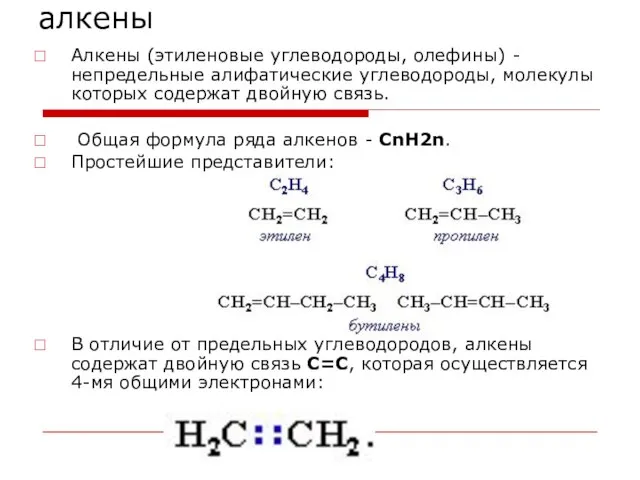
- 24. алкены Алкены (этиленовые углеводороды, олефины) - непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула
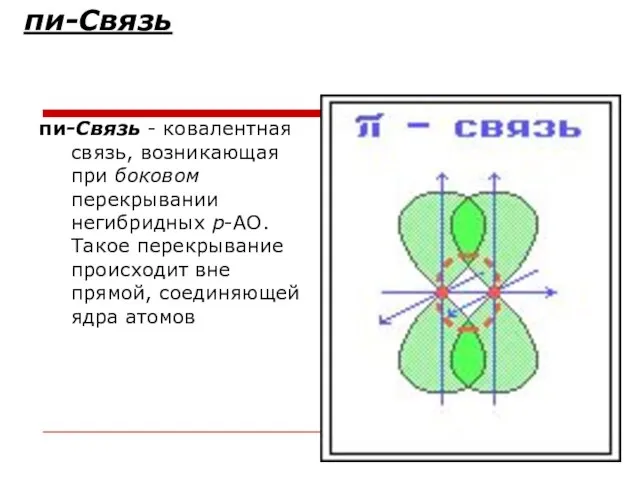
- 26. пи-Связь пи-Связь - ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой,
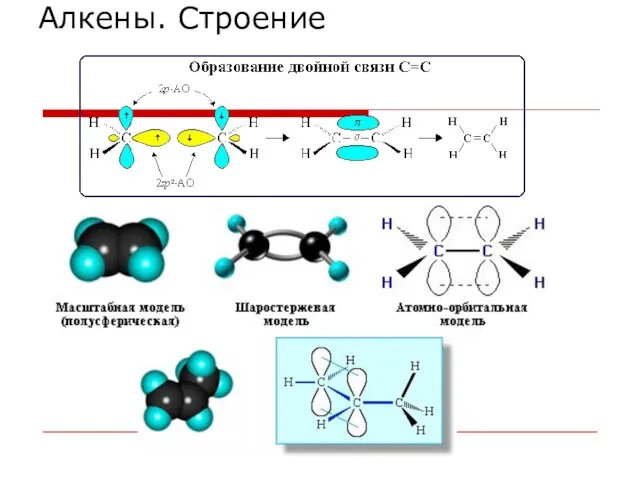
- 27. Алкены. Строение
- 28. Номенклатура алкенов По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом
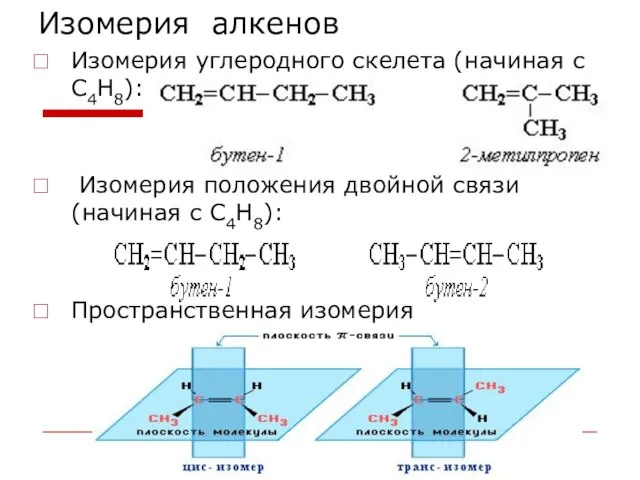
- 29. Изомерия алкенов Изомерия углеродного скелета (начиная с С4Н8): Изомерия положения двойной связи (начиная с С4Н8): Пространственная
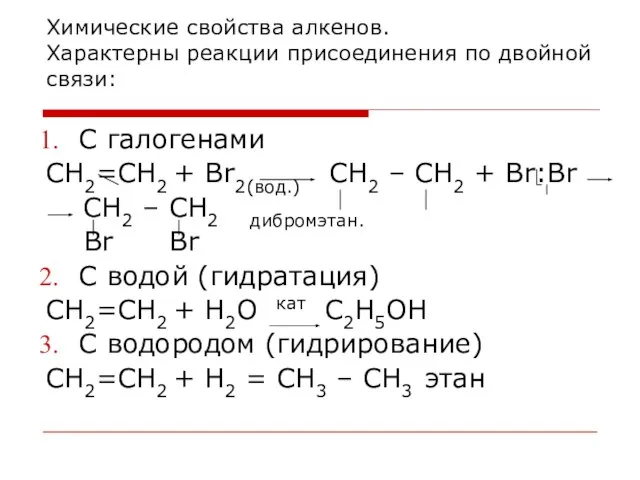
- 30. Химические свойства алкенов. Характерны реакции присоединения по двойной связи: С галогенами CH2=CH2 + Br2(вод.) СH2 –
- 31. Реакция полимеризации CH2=CH2 + CH2=CH2 + CH2=CH2 + … -СH2 – CH2- + -СH2 – CH2-
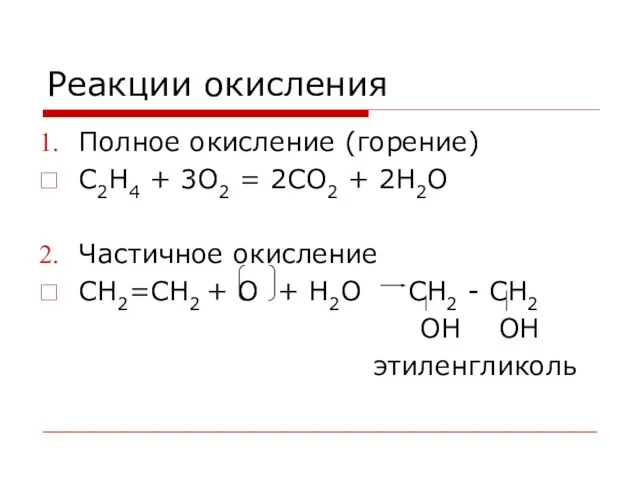
- 32. Реакции окисления Полное окисление (горение) С2Н4 + 3O2 = 2CO2 + 2H2O Частичное окисление CH2=CH2 +
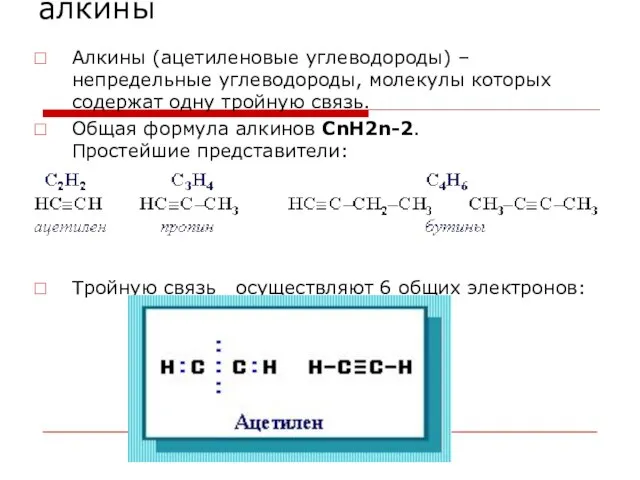
- 33. алкины Алкины (ацетиленовые углеводороды) – непредельные углеводороды, молекулы которых содержат одну тройную связь. Общая формула алкинов
- 35. Номенклатура алкинов По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же
- 36. Химические свойства алкинов Как и для этиленовых характерны реакции присоединения, окисления. Запишите в тетрадях уравнения реакций:
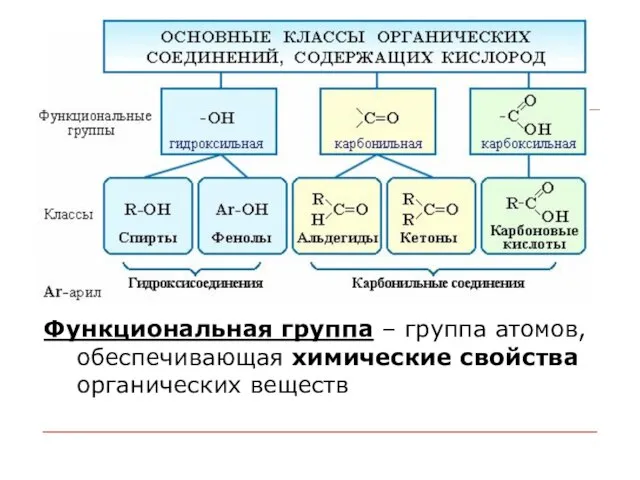
- 37. Функциональная группа – группа атомов, обеспечивающая химические свойства органических веществ
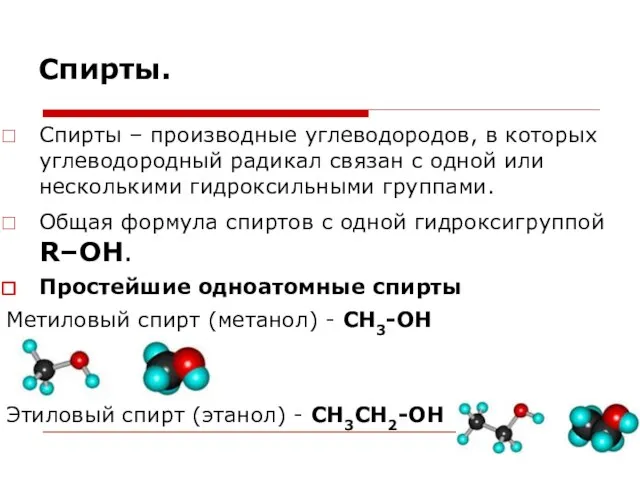
- 38. Спирты. Спирты – производные углеводородов, в которых углеводородный радикал связан с одной или несколькими гидроксильными группами.
- 39. Многоатомные спирты Этиленгликоль – двухатомный спирт СН2 – СН2 ОН ОН Как его можно получить? Бесцветная
- 40. Многоатомные спирты Глицерин – трёхатомный спирт СН2 – СН – СН2 ОН ОН ОН Густая сиропообразная
- 41. Химические свойства спиртов обусловлены наличием функциональной группы - ОН Взаимодействует: С кислотами С активными металлами Горит
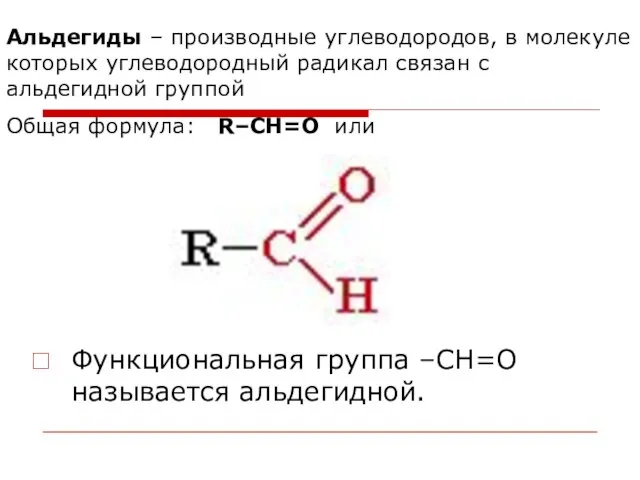
- 42. Альдегиды – производные углеводородов, в молекуле которых углеводородный радикал связан с альдегидной группой Общая формула: R–CН=O
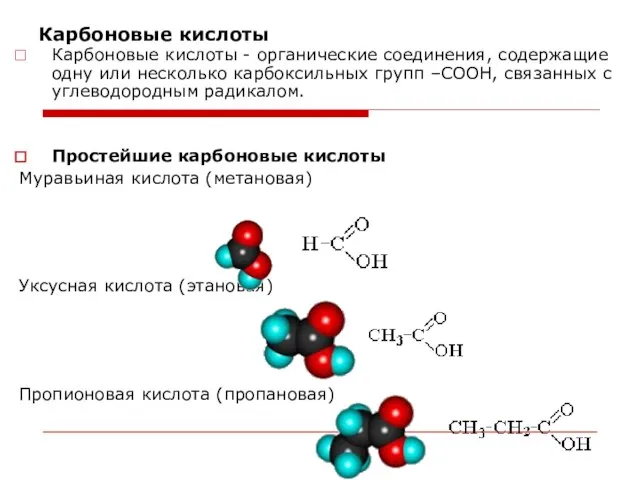
- 43. Карбоновые кислоты Карбоновые кислоты - органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с
- 44. Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота. HCOOH
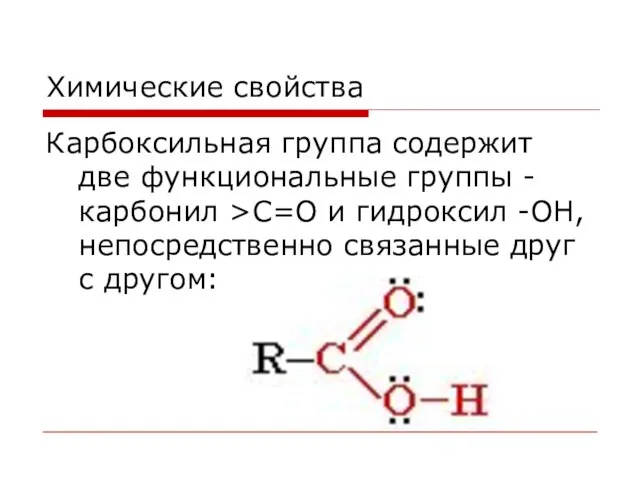
- 45. Химические свойства Карбоксильная группа содержит две функциональные группы - карбонил >С=О и гидроксил -OH, непосредственно связанные
- 46. Характерны реакции с: Со спиртами (реакция этерификации) Продуктом является сложный эфир Составьте уравнение реакции взаимодействия уксусной
- 47. С солями более слабых карбоновых кислот Составьте уравнение реакции взаимодействия уксусной кислоты и карбоната натрия, назовите
- 48. Жиры. Жиры - сложные эфиры глицерина и высших одноатомных карбоновых кислот. В состав природных триглицеридов входят
- 49. Жидкие жиры превращают в твердые путем реакции гидрирования. При этом водород присоединяется по двойной связи, содержащейся
- 50. Углеводы (сахара) - органические вещества, состав которых выражается формулой Cx(H2O)y, где x и y > 3.
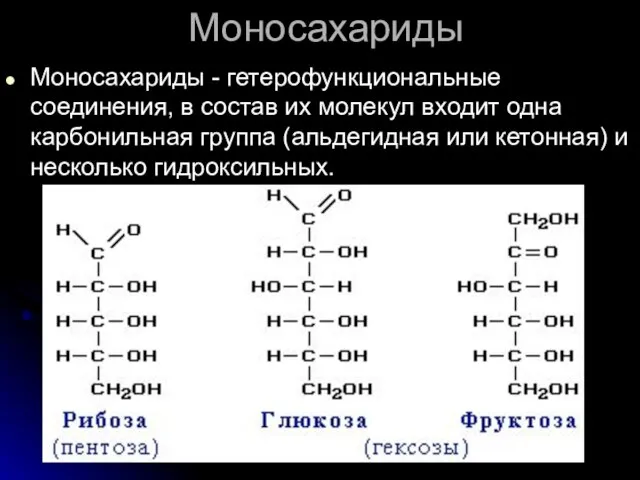
- 51. Моносахариды Моносахариды - гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (альдегидная или кетонная)
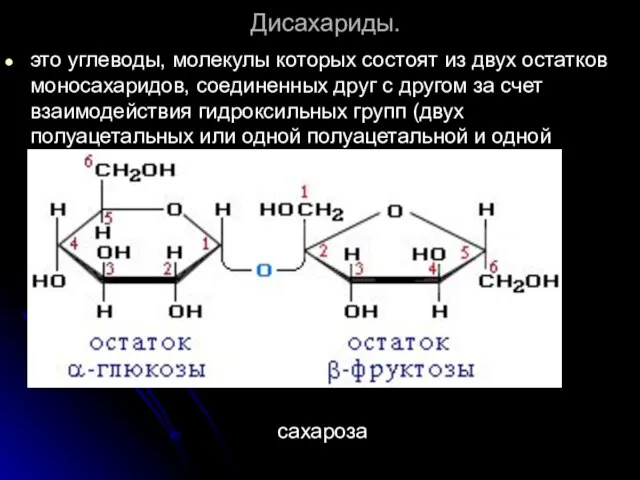
- 52. Дисахариды. это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет
- 53. Крахмал В его состав входят: амилоза (внутренняя часть крахмального зерна) - 10-20% амилопектин (оболочка крахмального зерна)
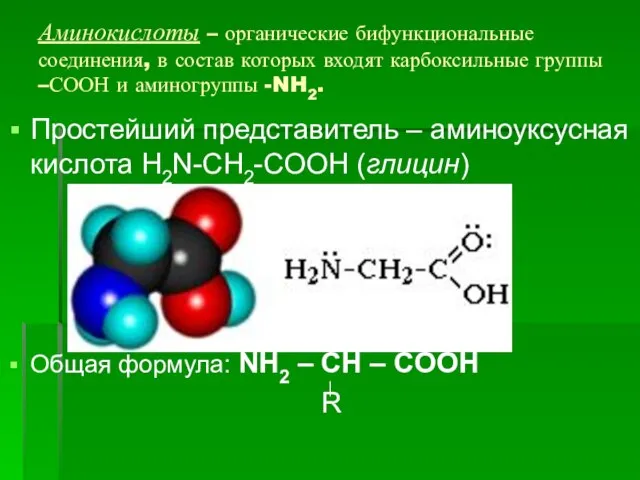
- 54. Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы -NH2. Простейший
- 55. Физические свойства Аминокислоты – твердые кристаллические вещества с высокой т.пл., при плавлении разлагаются. Хорошо растворимы в
- 56. Химические свойства Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы,
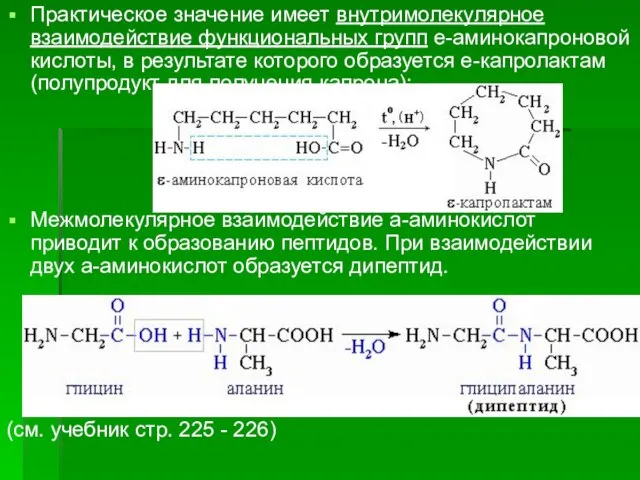
- 57. Практическое значение имеет внутримолекулярное взаимодействие функциональных групп e-аминокапроновой кислоты, в результате которого образуется e-капролактам (полупродукт для
- 58. Белки
- 59. Белки (полипептиды) - биополимеры, построенные из остатков a-аминокислот, соединённых пептидными (амидными) связями. Функции белков в природе
- 60. Уровни структурной организации белков.
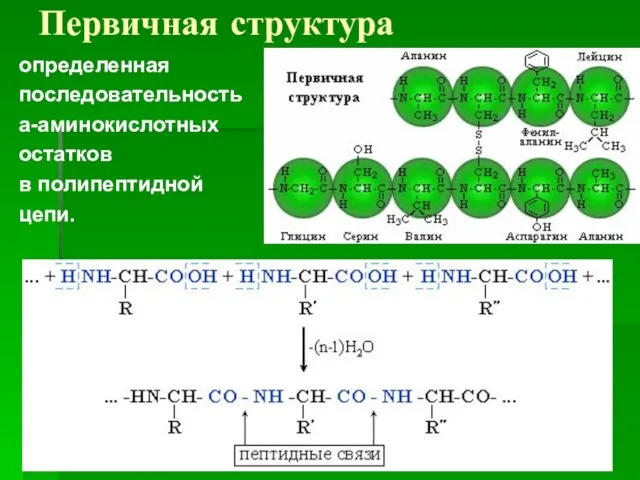
- 61. Первичная структура определенная последовательность a-аминокислотных остатков в полипептидной цепи.
- 62. Вторичная структура конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О. Одна из
- 63. Третичная структура - форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-,
- 64. Четвертичная структура - агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.
- 66. Скачать презентацию



































 Архитектура и живопись русского классицизма
Архитектура и живопись русского классицизма О ВЛИЯНИИ ЭКСПЕРИМЕНТАЛЬНЫХ УСТРОЙСТВ НА ФИЗИКУ И БЕЗОПАСНОСТЬ ИССЛЕДОВАТЕЛЬСКИХ РЕАКТОРОВ XIII ЕЖЕГОДНОЕ РОССИЙСКОЕ СОВЕЩАНИЕ «
О ВЛИЯНИИ ЭКСПЕРИМЕНТАЛЬНЫХ УСТРОЙСТВ НА ФИЗИКУ И БЕЗОПАСНОСТЬ ИССЛЕДОВАТЕЛЬСКИХ РЕАКТОРОВ XIII ЕЖЕГОДНОЕ РОССИЙСКОЕ СОВЕЩАНИЕ « Нанотехнологии - инвестиционный ресурс развития Удмуртской Республики
Нанотехнологии - инвестиционный ресурс развития Удмуртской Республики Правила санитарии, гигиены и безопасной работы
Правила санитарии, гигиены и безопасной работы Система аварийного ввода бора (СБВБ) на АЭС
Система аварийного ввода бора (СБВБ) на АЭС История эволюционных идей. Карл Линней
История эволюционных идей. Карл Линней Формирование исполнительского мастерства в условиях образовательной среды в ДШИ
Формирование исполнительского мастерства в условиях образовательной среды в ДШИ Документация как информационное обеспечение бухгалтерского учета
Документация как информационное обеспечение бухгалтерского учета Современная научная космология.
Современная научная космология. Расписание дня школьника
Расписание дня школьника Перспективы развития мультимодальных грузовых перевозок в Ульяновской области
Перспективы развития мультимодальных грузовых перевозок в Ульяновской области Почему невозможно утонуть в грязевом вулкане?
Почему невозможно утонуть в грязевом вулкане? Лекция 3Показатели энергосбережения и повышения энергетической эффективности
Лекция 3Показатели энергосбережения и повышения энергетической эффективности Образец бренда
Образец бренда Летняя оздоровительная кампания 2010год
Летняя оздоровительная кампания 2010год Компания Xerographic Print Service основана в 1994 г.в Нидерландах. Производственные филиалы работают в странах ЕС и Китае.
Компания Xerographic Print Service основана в 1994 г.в Нидерландах. Производственные филиалы работают в странах ЕС и Китае. Функциональное зонирование участка
Функциональное зонирование участка Һөйләмдең баш һәм эйәрсән киҫәктәре
Һөйләмдең баш һәм эйәрсән киҫәктәре Презентация на тему Поздравление с Новым годом
Презентация на тему Поздравление с Новым годом УМК для начальной школы
УМК для начальной школы Методическое объединение педагогов дополнительного образования и учителей художественно-эстетического цикла
Методическое объединение педагогов дополнительного образования и учителей художественно-эстетического цикла ЭКОЛОГ - Профессия XXI века?
ЭКОЛОГ - Профессия XXI века? Система контроля безопасности СКБ Dog
Система контроля безопасности СКБ Dog Детальный Углеводородный Анализ продуктов первичной переработки нефти, продуктов риформинга, готовой продукции
Детальный Углеводородный Анализ продуктов первичной переработки нефти, продуктов риформинга, готовой продукции Рекреационные ресурсы Луганщины
Рекреационные ресурсы Луганщины Filippovich_i_Bashkatova_1
Filippovich_i_Bashkatova_1 12 Декабря - День Конституции Российской Федерации
12 Декабря - День Конституции Российской Федерации Естественнонаучный турнир
Естественнонаучный турнир