Содержание
- 2. Цель урока: обобщить знание учащихся, полученные ранее при рассмотрении общих химических свойств металлов; повторить особенности протекания
- 3. Оборудование и реактивы: Mg (лента); Na; Cu; Zn; HCl (1:5); Fe; Al; CuSO4; MgCl2 ; спиртовка;
- 4. Девиз урока: «Для описания свойств вещества достаточно знать его электронную структуру».
- 5. Первая часть урока – обучающая. Проводится в форме лекции с элементами беседы. В атомах металлов на
- 6. На доске записываем общую схему, характеризующую основной процесс происходящий с металлами при химических реакциях:
- 7. 1. Металлы реагируют с неметаллами. Наиболее энергично с кислородом, хлором, серой (галогенами). Опыт! Горение магния.
- 8. Эти уравнения учащиеся составляют самостоятельно:
- 9. 2. Металлы реагируют с водой. Опыт! Взаимодействия натрия с водой. Взаимодействие меди с водой. Из опытов
- 10. а) Щелочные металлы и щелочноземельные Ca и Ba c водой образуют гидроксиды соответствующих металлов и водород!
- 11. б) Mg, Al, Mn, Zn, Cr, Fe, Ni, Pb с водой реагируют при нагревании с образованием
- 12. 3. Металлы способны реагировать с кислотами. Опыт! Взаимодействие соляной кислоты с магнием, цинком, железом, медью.
- 13. Если металл способен проявлять несколько степеней окисления, то при взаимодействии со слабым окислителем образуется соль, в
- 14. Дан натрий и раствор соляной кислоты. Как будет протекать реакция между этими двумя веществами. Составьте уравнение
- 15. Далее следует беседа с классом о взаимодействии металлов с концентрированной серной кислотой и о взаимодействии с
- 16. Взаимодействие 1) Fe; Al; Pb с раствором CuSO4 2) Fe; Zn; Cu с раствором MgCl2 4.Металлы
- 17. Данные факты позволяют сделать вывод, что металлы обладают различной восстановительной способностью.
- 18. Если учитывать только энергию отрыва валентных электронов от отдельных изолированных атомов (энергию ионизации), то металлы можно
- 19. Домашнее задание § 44 (9-11) стр. 119-120, задание 4 стр. 120.
- 20. 2 часть урока: контролирующая (5-7мин.) На доске заранее записаны или напечатаны на листах на каждый стол
- 21. Программа – А 1 вариант Закончите уравнения тех реакций, которые относятся к /Ox-Red/ окислительно-восстановительным: 2 вариант
- 22. Программа – B 1 вариант Закончите уравнения окислительно-восстановительных реакций: 2 вариант Какие реакции практически осуществимы? Допишите
- 24. Скачать презентацию





















 Тема: «Спортивные игры зимой»
Тема: «Спортивные игры зимой» Список детей на получение кроватей и полотенец
Список детей на получение кроватей и полотенец Тепловые двигатели. Паровая турбина.
Тепловые двигатели. Паровая турбина. Система образования в Англии
Система образования в Англии Геометрические паркеты
Геометрические паркеты Подходы к системному целеполаганию. Лекция 2
Подходы к системному целеполаганию. Лекция 2 Конституция РФ
Конституция РФ Проект "Задачи на смеси и сплавы"
Проект "Задачи на смеси и сплавы" Раздел #. Дизайн интерьера
Раздел #. Дизайн интерьера Основы научных исследований
Основы научных исследований 000834aa-f5be4922
000834aa-f5be4922 Погружение
Погружение Невербальное общение
Невербальное общение Однородность керамзита
Однородность керамзита Презентация на тему Длина и меры ее измерения
Презентация на тему Длина и меры ее измерения Презентация на тему Экономика как наука
Презентация на тему Экономика как наука Кофемашина Yamaguchi CoffeeMann
Кофемашина Yamaguchi CoffeeMann Танковая викторина
Танковая викторина Петр Петрович Семёнов-Тян-Шанский
Петр Петрович Семёнов-Тян-Шанский Александр
Александр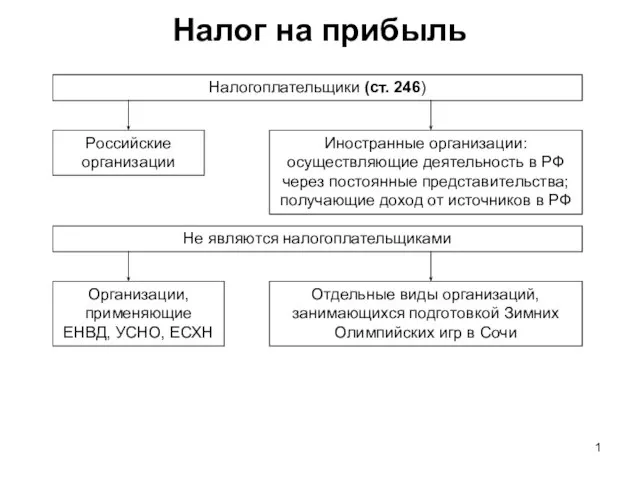 Налог на прибыль
Налог на прибыль SPORTS in Our Life
SPORTS in Our Life  Аудирование —цель и средство обучения
Аудирование —цель и средство обучения Отношения мужчины и женщины. Женская психология
Отношения мужчины и женщины. Женская психология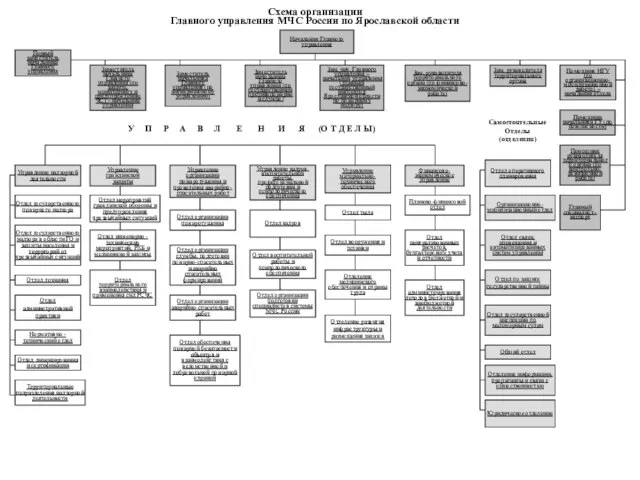 Схема организации Главного управления МЧС России по Ярославской области
Схема организации Главного управления МЧС России по Ярославской области Презентация на тему Афанасий Афанасьевич Фет (4 класс)
Презентация на тему Афанасий Афанасьевич Фет (4 класс) муниципальное образовательное учреждениеОбходская основная общеобразовательная школаУренского муниципального районаНижегор
муниципальное образовательное учреждениеОбходская основная общеобразовательная школаУренского муниципального районаНижегор куликовская битва
куликовская битва