Слайд 2Основные газовые законы
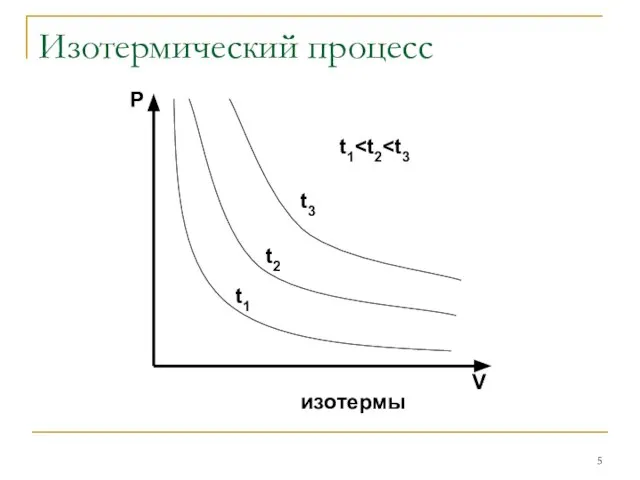
Закон Бойля-Мариотта: P⋅V=const при t0=const
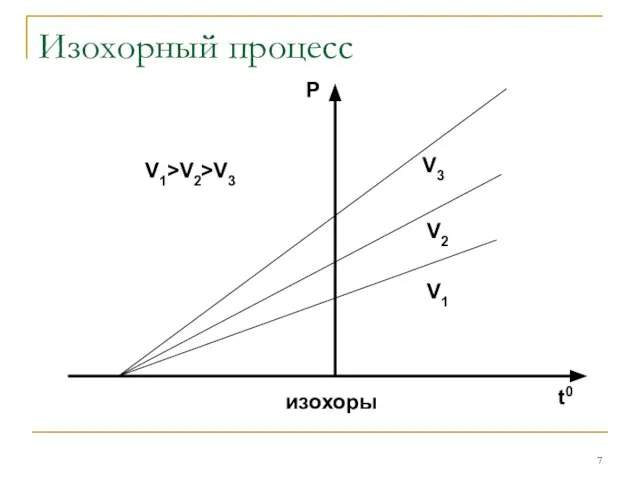
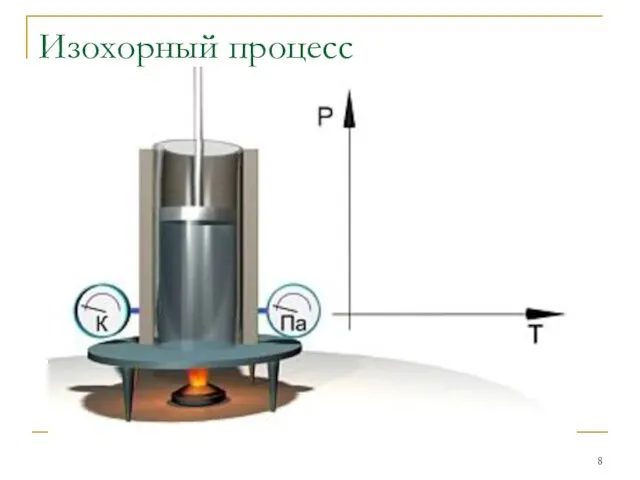
Закон Шарля: P/T=const при V=const
Закон

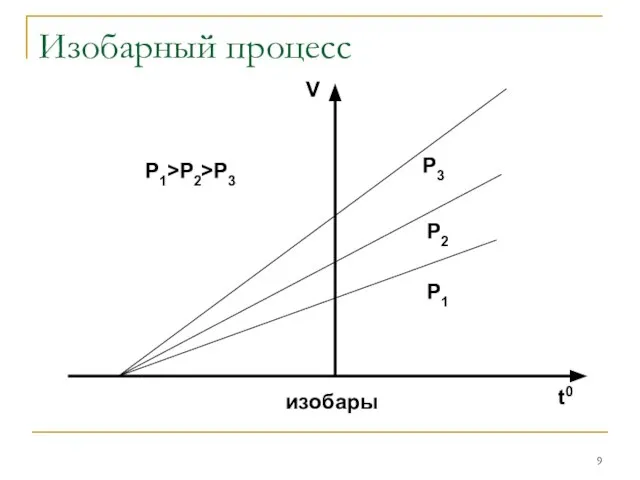
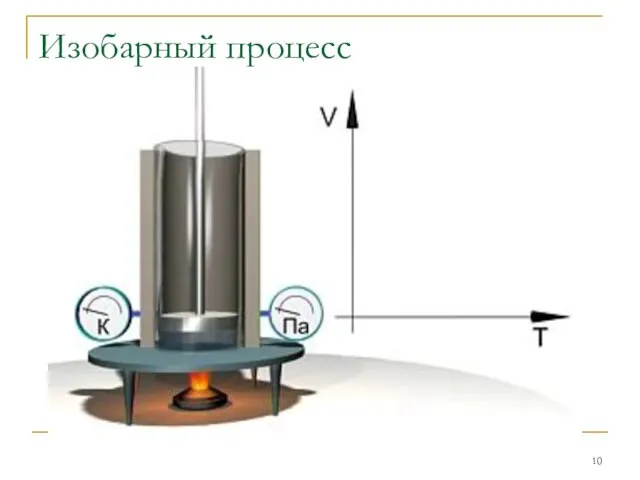
Гей-Люссака: V/T=const при P=const
Закон Авогадро: одинаковые количества газов при одинаковых температуре и давлении занимают одинаковый объём
Слайд 3Основные газовые законы
Законы Шарля и Гей-Люссака имеют такой простой вид если температура

измеряется по абсолютной шкале
Первоначально эти законы были сформулированы для температуры, измеренной в некоторой практической шкале. В этом случае они имеют более сложный вид:
P=P0[1+α⋅(t-t0)]
V=V0[1+β⋅(t-t0)]
при чём коэффициенты α и β оказались равными и не зависящими от рода газа
Слайд 4Основные газовые законы
Процессы, описываемые уравнениями
1-3 называются изопроцессами:
Изотермическим
Изохорным
Изобарным

Слайд 11Основные газовые законы
Если измерять температуру по шкале Цельсия, то оказывается, что точка

пересечения изохорного и изобарного процессов с осью температур имеет координату t=-373,15 0С. Это значит, что α=β=1/273,15 1/0С
Слайд 12Основные газовые законы
Если ввести новую шкалу температур, такую, что Т=t+273,15, то уравнения

примут более простой вид:
P/T=const
V/T=const
Определённая таким образом температура называется абсолютной температурой
Слайд 13Основные газовые законы
Рассмотрим переход из состояния 1 в 2 через а на
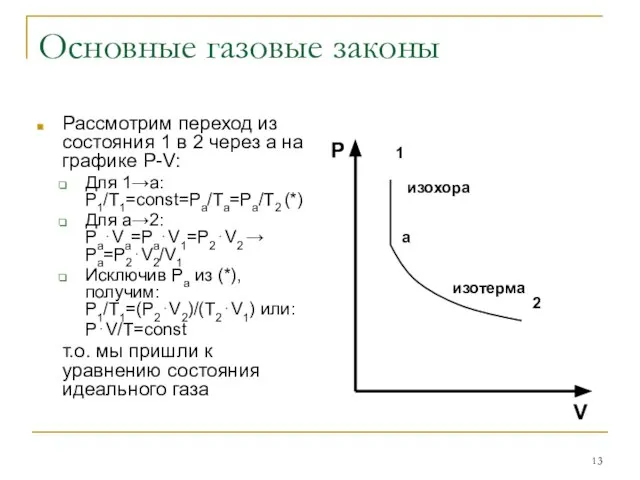
графике P-V:
Для 1→а: P1/T1=const=Pa/Ta=Pa/T2 (*)
Для а→2: Pa⋅Va=Pa⋅V1=P2⋅V2 → Pa=P2⋅V2/V1
Исключив Ра из (*), получим: P1/T1=(P2⋅V2)/(T2⋅V1) или:
P⋅V/T=const
т.о. мы пришли к уравнению состояния идеального газа
Слайд 14Основные газовые законы
Из закона Авогадро следует, что величина соотношения (P⋅V)/T не зависит

от вида газа, значит мы можем записать, что для одного моля любого газа (P⋅V)/T=R, где R – универсальная газовая постоянная, называемая постоянной Авогадро
R=8,31 Дж/(град⋅моль)
Из закона Дальтона следует, что при постоянных V и Т, Р является линейной функцией количества вещества ν







 Презентация на тему Андрей Николаевич Туполев
Презентация на тему Андрей Николаевич Туполев Организация библиотечного обслуживания населения Сургутского района в связи с реализацией положений ФЗ № 131 «Об общих принципах
Организация библиотечного обслуживания населения Сургутского района в связи с реализацией положений ФЗ № 131 «Об общих принципах Русский портрет 18 века
Русский портрет 18 века Курорты США и Великобритании
Курорты США и Великобритании Révisions la Maison
Révisions la Maison Проверка домашнего задания
Проверка домашнего задания Регулировка сцепления
Регулировка сцепления  Политический процесс
Политический процесс Страна Россия
Страна Россия МИХАИЛВАСИЛЬЕВИЧ ЛОМОНОСОВ
МИХАИЛВАСИЛЬЕВИЧ ЛОМОНОСОВ Донозологическая диагностика на основе исследований свойств пульсовой волны
Донозологическая диагностика на основе исследований свойств пульсовой волны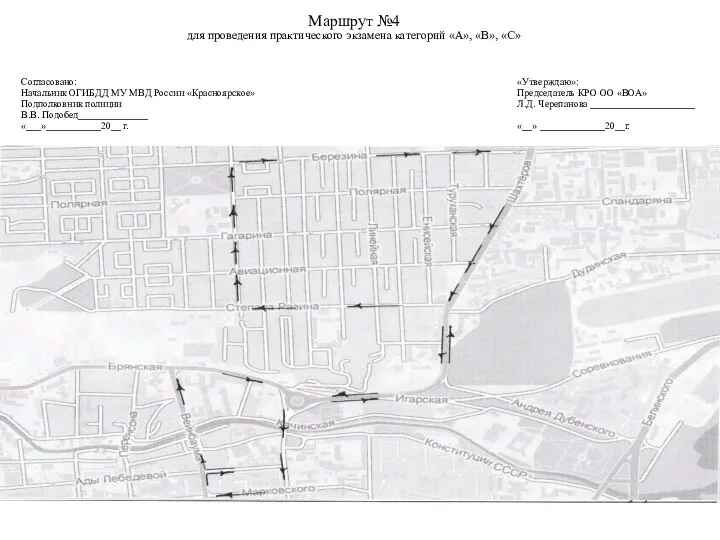 Маршрут №4 для проведения практического экзамена категорий А, В, С
Маршрут №4 для проведения практического экзамена категорий А, В, С Закуски из мяса.11 класс
Закуски из мяса.11 класс Фабрика санитарно-гигиенических изделийКрупнейший производитель бумажной санитарно-гигиенической продукции в УкраинеТМ «Неж
Фабрика санитарно-гигиенических изделийКрупнейший производитель бумажной санитарно-гигиенической продукции в УкраинеТМ «Неж Презентация на тему История рождения Иисуса Христа
Презентация на тему История рождения Иисуса Христа Роль и значение витаминов в рационе младших школьников
Роль и значение витаминов в рационе младших школьников Межпрофессиональная стратификация - основа развития современных профессий и профессиональных групп современного общества
Межпрофессиональная стратификация - основа развития современных профессий и профессиональных групп современного общества Размещение рекламы на контент-сайтах
Размещение рекламы на контент-сайтах Презентация на тему Всемирный день борьбы со СПИДом
Презентация на тему Всемирный день борьбы со СПИДом Интерком центр обучения
Интерком центр обучения Медведь сказочный и настоящий
Медведь сказочный и настоящий Воспитательная система класса Планета «Дружба»
Воспитательная система класса Планета «Дружба» ОЗОН В АТМОСФЕРЕ
ОЗОН В АТМОСФЕРЕ Подходы к управлению
Подходы к управлению Мебель для проекта
Мебель для проекта Презентация на тему Ледниковая эпоха
Презентация на тему Ледниковая эпоха Задачи и объекты SWOT-анализа
Задачи и объекты SWOT-анализа Итоги работы опорной площадки по введению ФГОС
Итоги работы опорной площадки по введению ФГОС