Содержание
- 2. 7. Молекулярно-кинетическая теория идеальных газов 7.1. Статистический и термодинамический методы исследования Молекулярная физика и термодинамика —
- 3. Термодинамика — раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, а также
- 4. Температура — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. В настоящее время применяются только две
- 5. Термодинамическая температура и температура по Международной практической шкале связаны соотношением: Т = 273,15 + t. Нормальные
- 6. 7.2. Законы, описывающие поведение идеальных газов В молекулярно-кинетической теории пользуются моделью идеального газа, согласно которой считают,
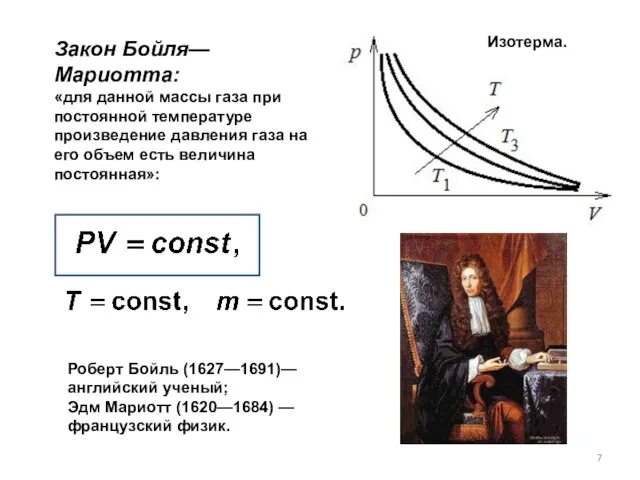
- 7. Изотерма. Закон Бойля—Мариотта: «для данной массы газа при постоянной температуре произведение давления газа на его объем
- 8. Законы Гей-Люссака 1) объем данной массы газа при постоянном давлении изменяется линейно с температурой: Жозеф Гей-Люссак
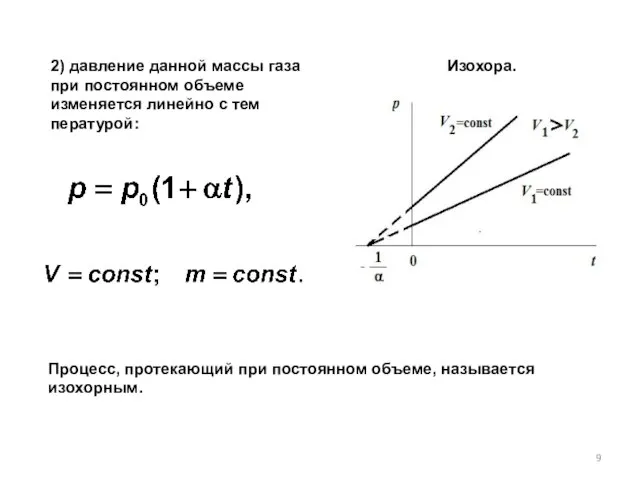
- 9. 2) давление данной массы газа при постоянном объеме изменяется линейно с температурой: Процесс, протекающий при постоянном
- 10. В термодинамической шкале температур:
- 11. Закон Авогадро: «моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы». А. Авогадро (1776—1856)
- 12. Моль – единица количества вещества, количество вещества системы, содержащей столько же структурных элементов, сколько содержится в
- 13. Закон Дальтона: «давление смеси идеальных газов равно сумме парциальных давлений p1, p2 ,..., рn входящих в
- 14. 7.3. Уравнение состояния идеального газа (Менделеева-Клапейрона) Уравнением состояния термодинамической системы называется уравнение, которое связывает давление р,
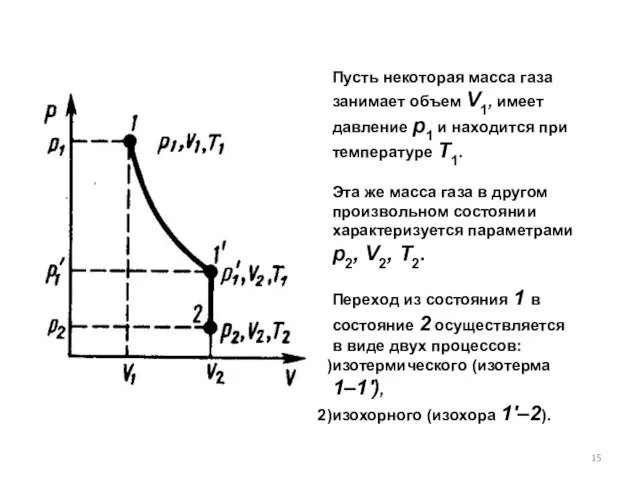
- 15. Пусть некоторая масса газа занимает объем V1, имеет давление р1 и находится при температуре T1. Эта
- 16. В соответствии с законами Бойля — Мариотта и Гей-Люссака запишем: Исключив из уравнений получим: — уравнением
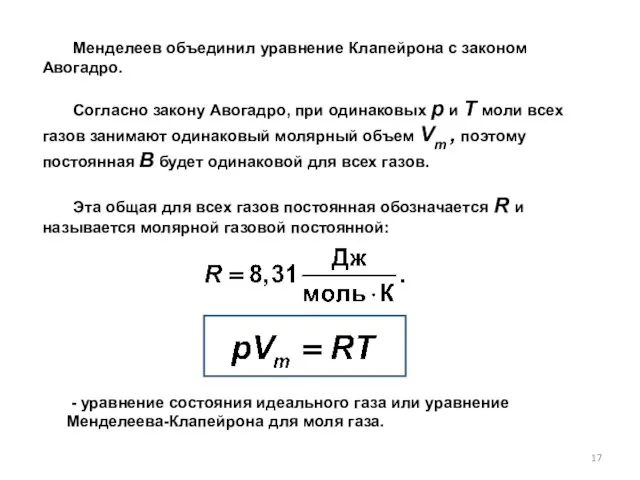
- 17. Менделеев объединил уравнение Клапейрона с законом Авогадро. Согласно закону Авогадро, при одинаковых р и Т моли
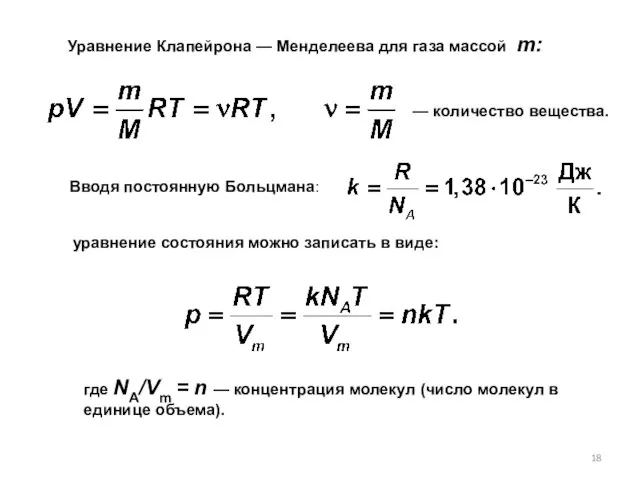
- 18. Уравнение Клапейрона — Менделеева для газа массой т: — количество вещества. Вводя постоянную Больцмана: уравнение состояния
- 19. Число молекул, содержащихся в 1 м3 газа при нормальных условиях, называется числом Лошмидта: 1. Давление идеального
- 20. 7.4. Основное уравнение молекулярно-кинетической теории идеальных газов Пусть в сосуде объемом V находится идеальный газ массой
- 21. За время dt площадке dS передается импульс dP. Тогда давление газа, оказываемое на стенку сосуда, будет
- 22. Давление газа, оказываемое им на стенку сосуда: Если газ в объеме V содержит N молекул, движущихся
- 23. Другие формы этого уравнения : 1. Учитывая, что n =N / V, получим 2. Так как
- 24. Используя уравнение Клапейрона — Менделеева получим: Так как M=m0NА, т0 — масса одной молекулы, NА —
- 26. Скачать презентацию


















 Мир геометрических фигур
Мир геометрических фигур Презентация на тему Организация и содержание физминутки на уроке
Презентация на тему Организация и содержание физминутки на уроке Мы за Новый мир! Движение за Новый Коммунизм
Мы за Новый мир! Движение за Новый Коммунизм Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие
Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие Неиспользуемые здания в коммунальной собственности Мостовского района, планируемые к продаже в 2012 году
Неиспользуемые здания в коммунальной собственности Мостовского района, планируемые к продаже в 2012 году СПП нерасчлененной структуры
СПП нерасчлененной структуры Курсовая работа
Курсовая работа Транспортное средство. Характеристика непрофильного актива
Транспортное средство. Характеристика непрофильного актива «Определение характерных черт портрета успешного предпринимателя »Проект Подготовили: Любченко Алёна и Няргинен ВикторияРуков
«Определение характерных черт портрета успешного предпринимателя »Проект Подготовили: Любченко Алёна и Няргинен ВикторияРуков И.И. Шишкин
И.И. Шишкин Круг обучения. Готовим профессионалов.
Круг обучения. Готовим профессионалов. Конституция Тыва
Конституция Тыва «Дело-КС» Автоматизация делопроизводства
«Дело-КС» Автоматизация делопроизводства Охрана материнства и детства в свете приоритетных правительственных программ Директор Департамента медико-социальных проблем с
Охрана материнства и детства в свете приоритетных правительственных программ Директор Департамента медико-социальных проблем с Тема проекта:«Здоровьесберегающие компоненты математического образования младшего школьника в свете стандарта второго поколен
Тема проекта:«Здоровьесберегающие компоненты математического образования младшего школьника в свете стандарта второго поколен Тургенев и Виардо
Тургенев и Виардо Менеджер по компенсациям и льготам. Профпереподготовка
Менеджер по компенсациям и льготам. Профпереподготовка 7 период развития соц.работы
7 период развития соц.работы Рынок труда: состав, состояние и перспективы развития.
Рынок труда: состав, состояние и перспективы развития. Игровые технологии в младшем школьном возрасте
Игровые технологии в младшем школьном возрасте Открытки с 9 мая
Открытки с 9 мая О введении комплексного курса
О введении комплексного курса Презентация на тему Народы России
Презентация на тему Народы России  Изменчивость. Мутации
Изменчивость. Мутации Презентация на тему Мастерство педагога
Презентация на тему Мастерство педагога Сирень 1945 года
Сирень 1945 года Методы составления и анализа семантического ядра
Методы составления и анализа семантического ядра Презентация на тему Одиночество
Презентация на тему Одиночество