Содержание
- 2. Цели урока - познакомиться с основными химическими производствами Казахстана; -научиться вычислять выход продукта реакции от теоретически
- 3. Критерии оценивания -называет основные производства и производственные процессы, осуществляемые в Республике Казахстан - производит расчеты выхода
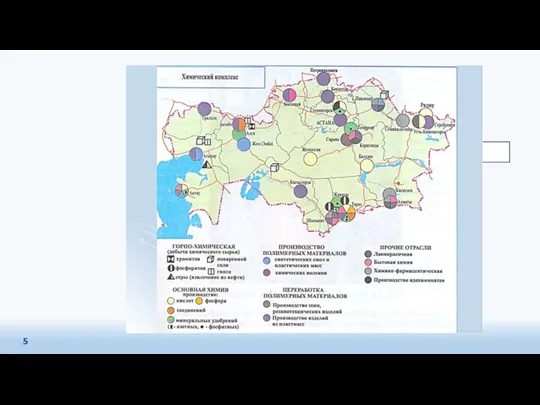
- 4. Химическая промышленность Казахстана Основными предприятиями химической промышленности РК являются: АО «Актюбинский завод хромовых соединений», АО «Ульбинский
- 7. 5
- 8. 3
- 9. Химическая промышленность Казахстана, основанная на богатейшей сырьевой базе, имеет большие перспективы для развития и представляет большой
- 10. 1) Прочитай внимательно условие задачи 2) Запиши: «Дано» и «Найти». 3) Составь уравнение реакции (не забудь
- 11. Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5,
- 12. Решите задачи: 1.Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно
- 14. Скачать презентацию










 Подвижные игры для развития физических качеств
Подвижные игры для развития физических качеств Построение правильного пятиугольника
Построение правильного пятиугольника Личность и социальная среда
Личность и социальная среда Молочная кухня алтайцев
Молочная кухня алтайцев Учет денежных документов
Учет денежных документов Презентация на темум Правописание суффиксов -ЕК, -ИК" 3 класс
Презентация на темум Правописание суффиксов -ЕК, -ИК" 3 класс Физиолого-гигиенические основы режима дня детей и подростков
Физиолого-гигиенические основы режима дня детей и подростков  Национальные способы заваривания чая
Национальные способы заваривания чая Электрический привод. Общая структура электропривода. (Лекция 1)
Электрический привод. Общая структура электропривода. (Лекция 1) 6 «А» класс. Кл. руководитель Жирова Н. В.
6 «А» класс. Кл. руководитель Жирова Н. В. Деньги и банки
Деньги и банки ДОБРОДЕТЕЛЬ И ПОРОК
ДОБРОДЕТЕЛЬ И ПОРОК Программирование
Программирование Вредные привычки человека
Вредные привычки человека Дроби
Дроби Радиоавтоматика. Оценка качества регулирования. Типовые ЛАХ разомкнутой системы
Радиоавтоматика. Оценка качества регулирования. Типовые ЛАХ разомкнутой системы Что такое счастье?
Что такое счастье? Протоколы Интернета
Протоколы Интернета Intensiv
Intensiv современный этикет
современный этикет Профессия и мой характер
Профессия и мой характер Композиция в пейзаже
Композиция в пейзаже СТАНДАРТЫ ОЦЕНКИ ИХ ПРИМЕНЕНИЕ И РАЗВИТИЕ В РЕСПУБЛИКЕ БЕЛАРУСЬ
СТАНДАРТЫ ОЦЕНКИ ИХ ПРИМЕНЕНИЕ И РАЗВИТИЕ В РЕСПУБЛИКЕ БЕЛАРУСЬ Общая характеристика административного права Украины
Общая характеристика административного права Украины Путешествие в Великобританию.
Путешествие в Великобританию. Особенности экономического районирования России Подготовила: Клеутина С.А. Группа МЭ-092
Особенности экономического районирования России Подготовила: Клеутина С.А. Группа МЭ-092 Опыт использования рыночных механизмов в энергосбережении
Опыт использования рыночных механизмов в энергосбережении Движение пешехода
Движение пешехода