Содержание
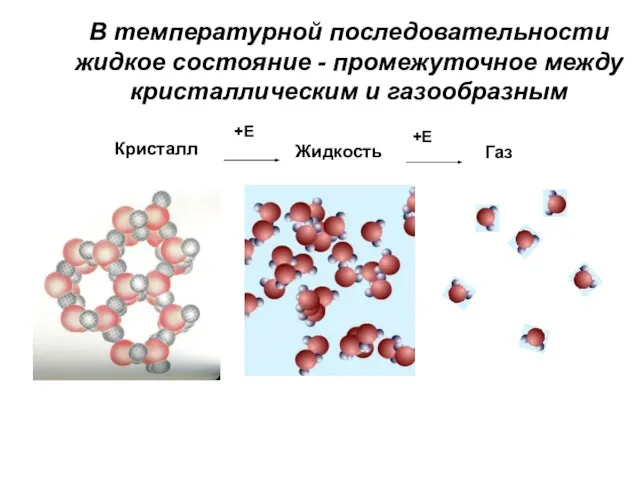
- 2. Кристалл Жидкость Газ В температурной последовательности жидкое состояние - промежуточное между кристаллическим и газообразным
- 3. Классификация растворов Истинные растворы Дисперсные системы
- 4. Растворы – это гомогенные (однофазные) системы, состоящие из двух и более компонентов, состав которых можно изменять
- 5. Истинный (молекулярный) раствор Истинный (молекулярный) раствор - это разновидность растворов в котором размеры частиц растворенного вещества
- 6. Растворитель Растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что
- 7. Растворение Растворение сложный физико-химический процесс. Разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя
- 8. Сольваты Сольваты – продукты переменного состава, которые образуются при химическом взаимодействии частиц растворенного вещества с молекулами
- 9. Основные положения химической теории растворов Д.И. Менделеева Растворение является сложным физико-химическим процессом, включающим разрушение структуры растворяемого
- 10. 2.продолжение 2. Процесс растворения может быть экзотермическим (ΔH или эндотермическим (ΔH>0), например растворение NH4NO3 Теплота растворения
- 11. 3 продолжение 3. В результате химического взаимодействия растворителя и растворенного вещества образуются сольваты (неводный растворитель) или
- 12. Образование гидратов иногда изменяет свойства веществ. Так безводный сульфат меди белого цвета, а кристаллогидрат – синий.
- 13. Процесс растворения определяется: - природой растворителя и растворенного вещества; - агрегатным состоянием растворяемого вещества; - температурой.
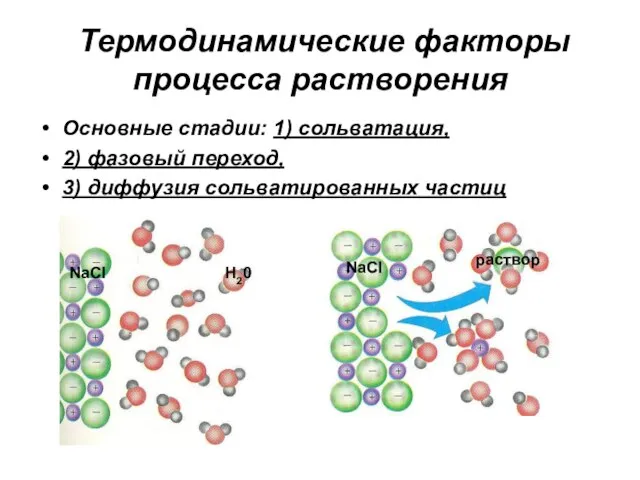
- 14. Термодинамические факторы процесса растворения Процесс растворения связан с самопроизвольным распределением частиц одного вещества между частицами другого.
- 15. Термодинамические факторы процесса растворения Основные стадии: 1) сольватация, 2) фазовый переход, 3) диффузия сольватированных частиц NaCl
- 16. Растворение – самопроизвольный процесс: ΔG ΔHр. = ΔHсольв.+ ΔHф.п.+ Δhдиф ΔHсольв ΔHф.п>0 при растворении твердого вещества.
- 17. ΔHдиф>0 независимо от фазового состояния растворяемого вещества . Диффундируя, сольватированные частицы должны преодолевать силы межмолекулярного взаимодействия
- 18. Влияние температуры на процесс растворения С повышением температуры - растворимость твердых веществ в жидкостях повышается, т.к.
- 19. - растворимость газов в жидкостях понижается: с повышением температуры кинетическая энергия газа в газовой фазе увеличивается
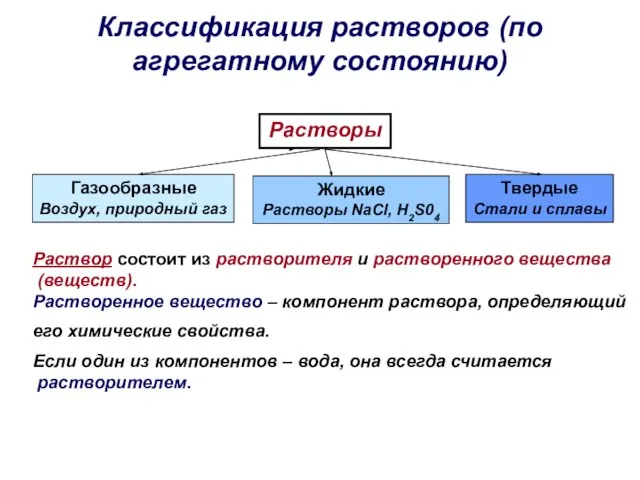
- 20. Классификация растворов (по агрегатному состоянию) Растворы Газообразные Воздух, природный газ Жидкие Растворы NaCl, H2S04 Твердые Стали
- 21. Раствор состоит по крайней мере из 2-х компонентов: РАСТВОРИТЕЛЬ+РАСТВОРЕННОЕ ВЕЩЕСТВО Состав раствора
- 22. Концентрация Содержание определенной порции вещества в растворе называется концентрацией.
- 23. Способы количественного выражения состава растворов. Массовая доля (процентная концентрация)
- 24. продолжение mр= mв+m(Н2О) m(Н2О)= mр- mв При комнатной температуре принимаем плотность воды равной 1 г/мл.
- 25. 10% раствор карбоната натрия – 10 г вещества карбоната натрия содержится в 100 г раствора карбоната
- 26. Массовая концентрация Смасс.=mв/Vр Размерность - г/л
- 27. пример С(NaCl)=54 г/л 54 грамма вещества хлорида натрия содержится в 1 литре раствора
- 28. Молярная концентрация С=n/V n- количество вещества в моль V – объем раствора в литрах Размерность –
- 29. продолжение
- 30. продолжение
- 31. С(NaCl)=4М четырехмолярный раствор хлорида натрия 4 моль вещества хлорида натрия содержится в 1 литре раствора хлорида
- 32. Переход от объма раствора к массе Объем и масса раствора связаны через плотность.
- 33. продолжение
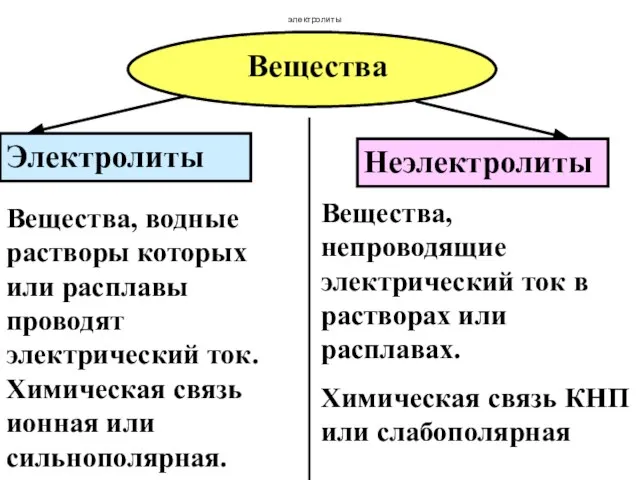
- 34. Вещества Электролиты Неэлектролиты Вещества, водные растворы которых или расплавы проводят электрический ток. Химическая связь ионная или
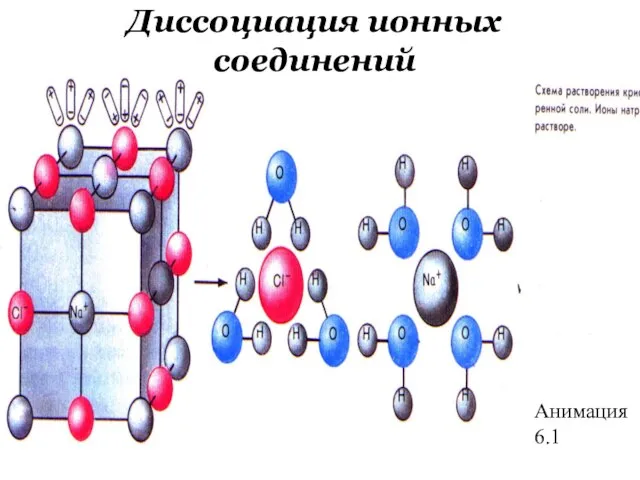
- 35. Теория электролитической диссоциации Электролитическая диссоциации – процесс распада электролита на ионы в растворе или в расплаве.
- 36. Основные положения ТЭД Электролиты при растворении в воде или в расплаве распадаются на ионы. Ионы –
- 37. продолжение 3. В растворе и расплаве ионы движутся хаотически. При пропускании электрического тока катионы движутся к
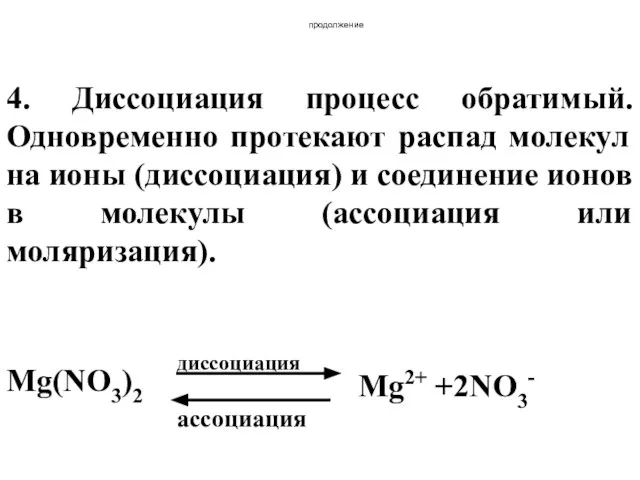
- 38. продолжение 4. Диссоциация процесс обратимый. Одновременно протекают распад молекул на ионы (диссоциация) и соединение ионов в
- 39. Ghjljk;tybt 5. Общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку.
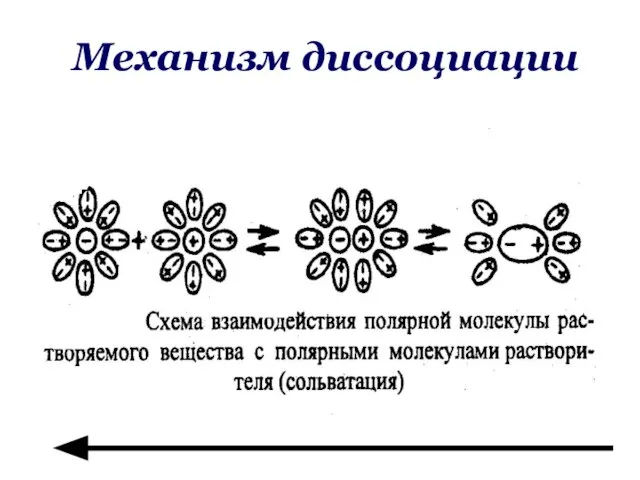
- 40. Механизм диссоциации
- 41. Анимация 6.1 Диссоциация ионных соединений
- 42. Количественные характеристики процесса диссоциации Степень диссоциации, α – доля молекул, распавшихся на ионы Константа диссоциации Кд
- 43. Степень электролитической диссоициации α=(Nдисс/Nобщ.)×100 α>30% - сильные электролиты 3% α
- 44. Константа диссоциации Обозначение Кд Кд-константа равновесия процесса диссоциации. Чем больше Кд, тем глубже протекает диссоциация
- 45. Равновесные концентрации в растворе слабого электролита AB ⮀ A+ + B– С – молярная концентрации электролита
- 46. AB ⮀ A+ + B– α×С – количество электролита АВ распавшегося на ионы в моль/л [A+]=[B-]=[AB]=
- 47. AB ⮀ A+ + B– c – αc αc αc
- 48. Закон разбавления Оствальда
- 49. Для слабых электролитов α
- 50. Факторы, влияющие на процесс диссоциации 1. Влияние концентрации электролита ; - закон разбавления Освальда
- 51. 2. Влияние температуры на процесс диссоциации Процесс диссоциации – эндотермический. Поэтому с повышением температуры степень диссоциации
- 52. 4. Влияние природы вещества на процесс его диссоциации Чем выше полярность связи, тем легче вещество диссоциирует
- 53. Кислоты, основания, соли с позиций ТЭД Кислоты – это электролиты, которые при диссоциации образуют один вид
- 54. Условная запись уравнений диссоциации кислот Диссоциация сильных кислот HCl → H++Cl- 1. H2SO4 → H+ +HSO4-
- 55. Диссоциация слабых кислот и кислот средней силы HNO2⇔ H++NO2- Кд=[H+]×[NO2-]/[HNO2] Средние и слабые кислоты
- 56. 1. H2S ⇔ H++ HS- 2. HS- ⇔ H+ + S 2- Суммарное уравнение диссоциации H2S
- 57. Основания – это электролиты, которые при диссоциации образуют один вид анионов – гидроксид-ионы ОН- Диссоциация сильного
- 58. Диссоциация слабых оснований и оснований средней силы NH4OH ⇔NH4++OH- Кд=[NH4+]×[OH-]/[NH4OH]
- 59. 1. Fe(OH)2 ⇔FeOH++OH- Кд1=[FeOH+] ×[OH-]/[Fe(OH)2] 2. FeOH+⇔ Fe2++OH- Кд2=[Fe2+] ×[OH-]/[Fe(OH)+] Ступенчатая диссоциация слабого основания
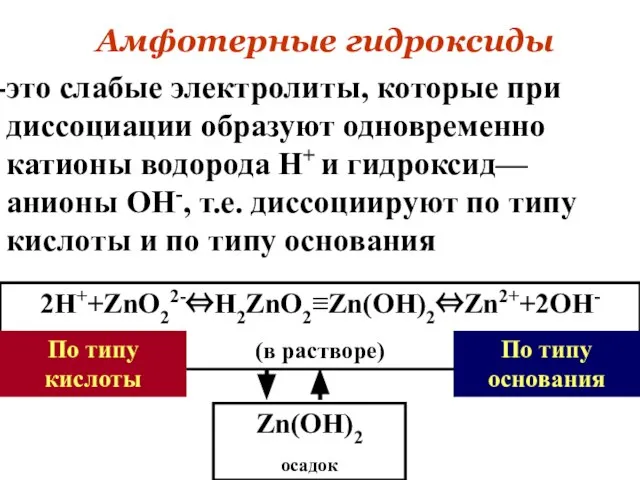
- 60. Амфотерные гидроксиды это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н+ и гидроксид—анионы ОН-,
- 61. Нормальные соли – электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка К2СО3→ 2К++СО32- Нормальные
- 62. Кислые соли – электролиты, которые диссоциируют на катионы металла и сложный анион в состав которого входят
- 63. Основные соли – электролиты, которые диссоциируют на анионы кислотного остатка и сложные катионы, состоящие из атома
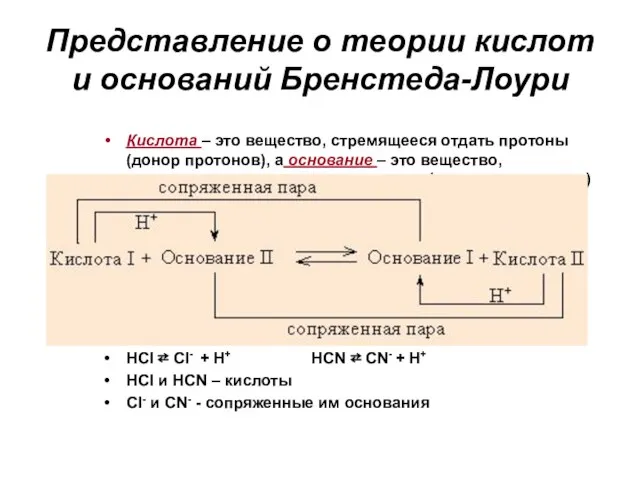
- 64. Представление о теории кислот и оснований Бренстеда-Лоури Кислота – это вещество, стремящееся отдать протоны (донор протонов),
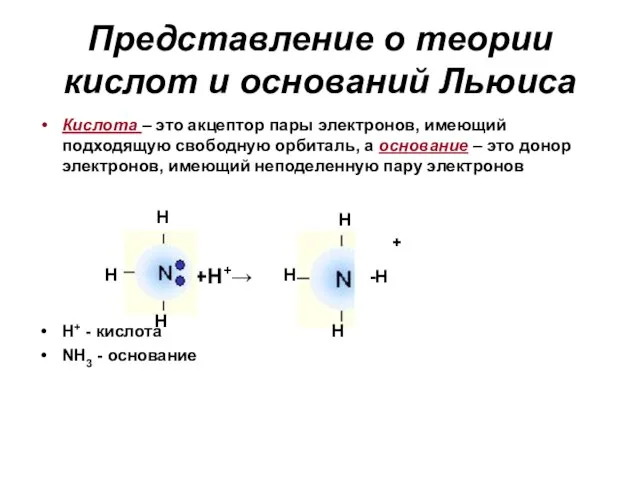
- 65. Представление о теории кислот и оснований Льюиса Кислота – это акцептор пары электронов, имеющий подходящую свободную
- 66. Реакции обмена между растворами сильных электролитов необратимы, если в результате образуются а) осадок б) выделяется газ
- 67. Реакции в растворах электролитов Записать молекулярное уравнение. 2.Проверить по таблице растворимости образование осадка, отметить 3. Если
- 68. 6. Подчеркнуть одноименные ионы и составить краткое ионное уравнение реакции. Ионные реакции реакции протекающие между ионами.
- 69. К сильным электролитам относятся Кислоты: HCl, HBr, HI, HNO3, H2SO4
- 70. Основания: гидроксиды щелочных Li, Na, K, Rb, Cs щелочноземельных Ca, Sr, Ba металлов
- 71. Соли все растворимые (таблица растворимости)
- 72. Пример Запишите молекулярные и ионные уравнения реакций, протекающих между растворами: а) сульфидом натрия и соляной кислотой
- 73. Na2S+2HCl H2S +2NaCl 2Na+ + S2- H2S +2Na+ +2Cl- +2H+ +2Cl- S2- +2H+→H2S
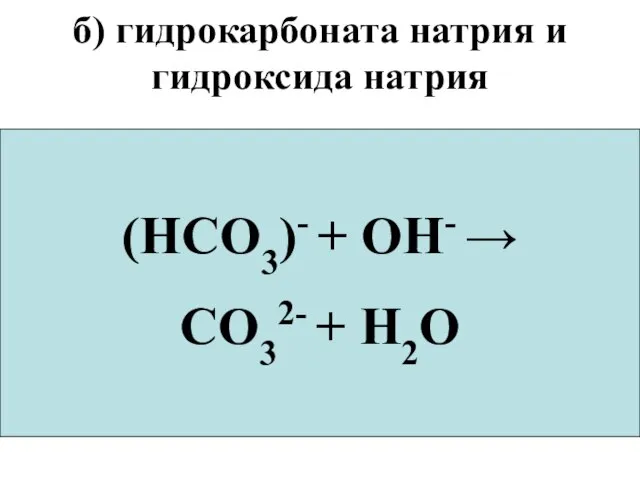
- 74. б) гидрокарбоната натрия и гидроксида натрия NaHCO3+NaOH → Na2CO3+H2O Na+ + (HCO3)-+Na+ +OH- →2Na+ + CO32-
- 75. Диссоциация воды. Вода слабый электролит. Уравнение диссоциации воды: НОН⇔Н++ОН- (1)
- 76. Диссоциация воды. Вода слабый электролит. Уравнение диссоциации воды: НОН⇔Н++ОН- (1)
- 77. продолжение
- 78. Ионное произведение воды Величина Кд и концентрация воды являются постоянными Следовательно Кд×[HOH] =Кв.
- 79. Ионное произведение воды Кв = [ Н+]×[ОН-] (3)
- 80. Кв величина постоянная при данной температуре и не зависит от изменения концентраций ионов водорода и ионов
- 81. При 250С Кв=10-14 [ Н+]×[ОН-]=10-14 (4)
- 82. Характер среды в водных растворах В чистой воде [ Н+]=[ОН-]=10-7 моль/л. Растворы в которых [ Н+]=[ОН-]
- 83. [ Н+]>[ОН-] кислая среда; [ Н+]
- 84. Расчет [ Н+] и [ОН-] [ Н+]=10-14/[ОН-] [ОН-]=10-14/ [ Н+]
- 85. Водородный показатель во избежании неудобств, связанных с применением чисел в отрицательной степени концентрацию ионов водорода принято
- 86. рН= -lg[H+] [H+]=10-pH Водородным показателем называется отрицательный логарифм концентрации ионов водорода
- 87. Понятие введено датским химиком С Серенсеном в 1909 году. p (от датского potenz) – математическая степень
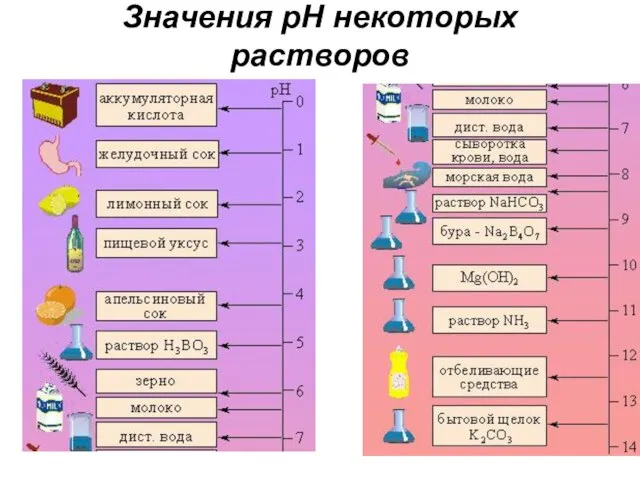
- 88. Значения рН некоторых растворов
- 89. Способы измерения значения рН раствора При помощи индикаторов, веществ, изменяющих цвет в присутствии ионов Н+ и/или
- 90. Гидролиз Буквально означает разложение соли водой («гидро» –вода, «лизис» - разложение)
- 91. Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
- 92. НОН⇔Н++ОН- [Н+]=[ОН-]=10-7 моль/л Среда нейтральная В реакции гидролиза участвуют 1 моль воды и 1 «слабый ион»
- 93. продолжение Соль рассматривается как продукт взаимодействия основания и кислоты.
- 94. продолжение Реакция гидролиза – реакция обратная реакции нейтрализации. Протекает с поглощением теплоты
- 95. Типы гидролиза Гидролиз соли образованной слабой кислотой и сильным основанием (гидролиз по аниону). рН>7 При обычных
- 96. Продукты сильное основание и слабая кислота (однозарядный анион) или кислая соль (многозарядный анион)
- 97. Соль образована сильной кислотой и слабым основанием (гидролиз по катиону) рН При обычных условиях протекает по
- 98. Продукты сильная кислота и слабое основание (катион однозарядный) или основная соль (катион многозарядный)
- 99. Гидролиз соли образованной слабой кислотой и слабым основанием (гидролиз по аниону и по катиону) рН≈7 (слабокислая
- 100. Гидролиз таких солей во многих случаях протекает до конца до образования слабой кислоты и слабого основания.
- 101. Гидролиз солей образованных сильной кислотой и сильным основанием не протекает, т.к. невозможно образование какого-либо слабого электролита
- 102. Правила составления уравнений гидролиза Определить какой кислотой и каким основанием образована соль. 2. Предварительно оценить характер
- 103. продолжение 3. Подчеркнуть слабый ион 4. Составить краткое ионное уравнение гидролиза. Записать уравнение реакции 1 моль
- 104. 5. Закончить молекулярное уравнение гидролиза. Для этого полученные в результате гидролиза ионы дополнить ионами не участвовавшими
- 105. Гидролиз – процесс обратимый (равновесный). Такое равновесное состояние характеризуется константой гидролиза. Равновесие гидролиза можно смещать. Гидролиз
- 106. Примеры Определите характер среды в растворе нитрита калия. Запишите уравнение гидролиза. Укажите значение рН. Запишите выражение
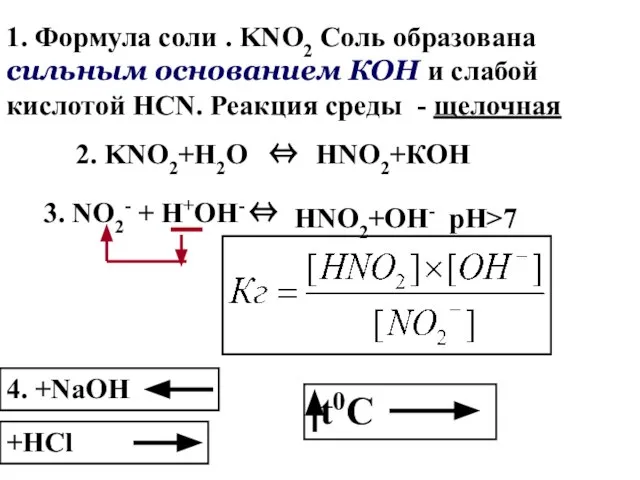
- 107. 1. Формула соли . KNO2 Соль образована сильным основанием КОН и слабой кислотой HCN. Реакция среды
- 108. Na3PO4+H2O⇔Na2HPO4+NaOH Соль образована сильным основанием и слабой кислотой. Среда щелочная. Гидролиз по аниону. PO43-+НОН ⇔(НPO4)2-+ОН- pH>7
- 109. NH4Cl+H2O ⇔NH4OH+HCl Соль образована слабым основанием и сильной кислотой. Гидролиз по катиону. Среда кислая. NH4+ +
- 110. Полный гидролиз Al2S3+6H2O → 2Al(OH)3↓ + 3H2S↑ pH ≈ 7
- 111. Na2SO4+H2O → pH=7 Гидролиз не идет
- 112. Степень гидролиза Количественная характеристика степень гидролиза – h.
- 113. n – число молекул соли подвергшихся гидролизу N – общее число растворенных молекул h(NH4Cl)=0,01%; h(KCN)=3,7% h(NH4)2S=99%
- 114. Константа гидролиза Постоянная величина, характеризующая глубину протекания гидролиза. Обозначение Кг. Чем больше величина Кг, тем глубже
- 115. Константа гидролиза и степень гидролиза Кг=h2c h=√Кг/с
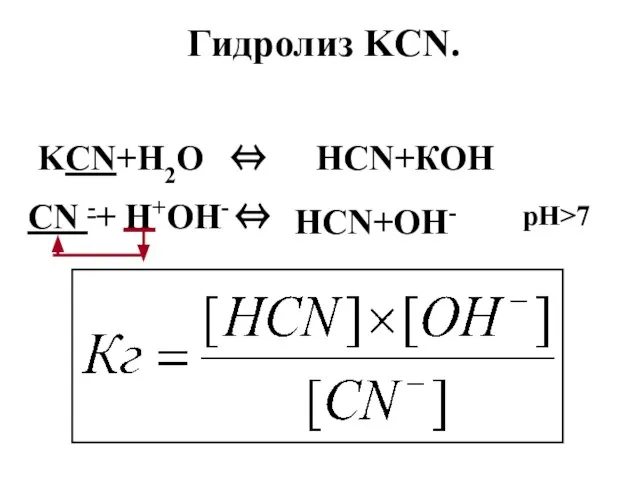
- 116. Гидролиз KCN. KCN+Н2О ⇔ НCN+КОН CN -+ Н+ОН- ⇔ НCN+ОН- рН>7
- 117. Константа гидролиза равна отношению произведения концентрация ионов, образовавшихся в результате гидролиза к концентрации «слабого иона». Вода
- 118. Кг не приводится в таблицах Для расчета Кг домножим числитель и знаменатель дроби на одну и
- 119. Расчет Кг Кг=Кв/Кд Кв=10-14 – ионное произведение воды Кд – константа диссоциации слабого электролита (кислоты или
- 120. Кг(KCN) Кг=10-14/Кд(HCN) Кд(НCN)=7,9x10-10 Кг=10-14/7,9x10-10= 10x10-15/7,9x10-10=1,27x10-5
- 121. В ряде технологических процессов и лабораторной практике необходимо поддерживать рН постоянным. При этом рН не должен
- 122. Буферным раствором (буфером) называют раствор рН которого не претеревает значительных изменений при добавлении небольших количеств кислоты
- 123. Слабая кислота + соль этой кислоты и сильного основания Примеры буферных растворов
- 124. ацетатная буферная смесь СН3СООН+ NaСН3СОО , Как правило в этих буферных растворах устойчивое значение рН в
- 125. Например аммиачный буфер – NH3×H2O+NH4Cl. Для буферных растворов этого типа устойчивое значение рН в интервале 7
- 126. Применение буферных растворов При электрохимическом нанесении защитных покрытий. 2. Призводство красителей, фотоматериалов, кожи. 3. Медицина, сельское
- 127. Биологические и биохимические процессы и скорости их протекания, направление протекания зависят от поддержания постоянного рН.
- 128. нормальный рН крови 7,4, слюны 6,9, желудочного сока – 1,7, слез 7,4. Содержащийся в крови буфер
- 129. Классификация растворов По содержанию растворенного вещества насыщенные ненасыщенные пересыщенные.
- 130. Способность вещества растворяться при данной температуре в определенной порции растворителя называется растворимостью. Коэффициент растворимости - максимальная
- 131. продолжение Растворимость вещества в воде при 200С Р (>1 г вещества в 100 г Н2О) Сахар
- 132. Обозначение – Р. Р=mв/100 г Н2О Размерность – г/100г воды. Растворимость зависит от природы растворяемого вещества,
- 133. продолжение В полярных растворителях лучше растворяются вещества с ионным типом связи и ковалентной полярной связью. В
- 134. Насыщенный раствор — раствор в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше
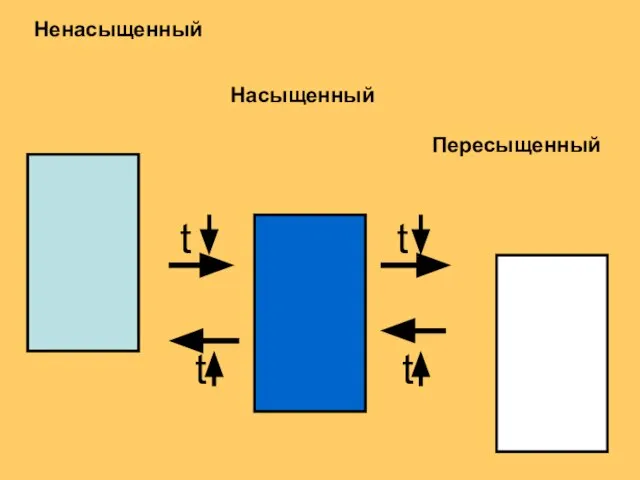
- 135. В насыщенном растворе: BaSO4 кр ⇄ Ba2++SO42- Kp = [Ba2+]p[SO42- ]p = ПР Произведение растворимости -
- 136. Ненасыщенный раствор Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе.
- 137. Пересыщенный раствор Пересыщенный раствор —раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе,
- 138. Пересыщенный раствор нестабилен и может легко переходить в насыщенный. Если резко охладить насыщенный раствор получим пересыщенный.
- 139. t t t t Пересыщенный Насыщенный Ненасыщенный
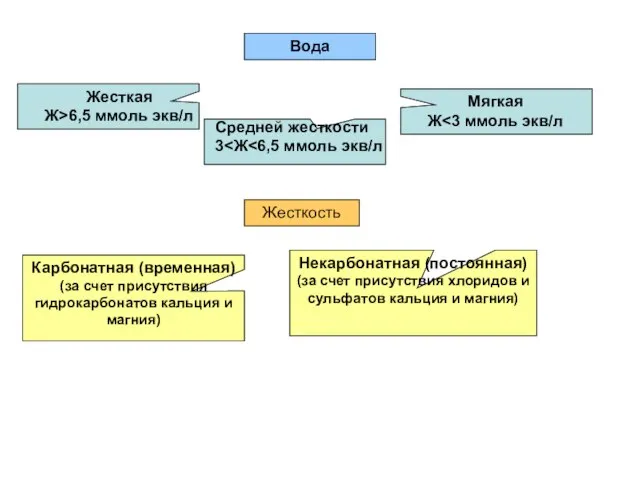
- 140. Жесткость природных вод Природные воды, содержащие в растворе большое количество солей кальция и магния называются жесткими.
- 142. Система водоподготовки 1. Освобождение от грубодисперсных примесей (отстой, фильтрация) 2. Защелачивание (до рН 6,5-7,5). Цель –
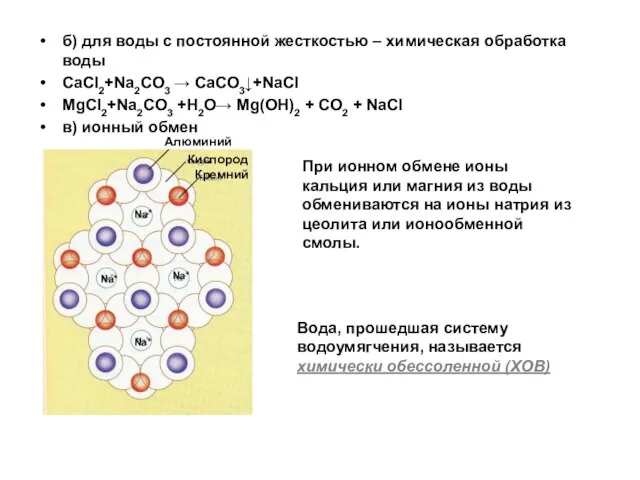
- 143. б) для воды с постоянной жесткостью – химическая обработка воды CaCl2+Na2CO3 → CaCO3↓+NaCl MgCl2+Na2CO3 +H2O→ Mg(OH)2
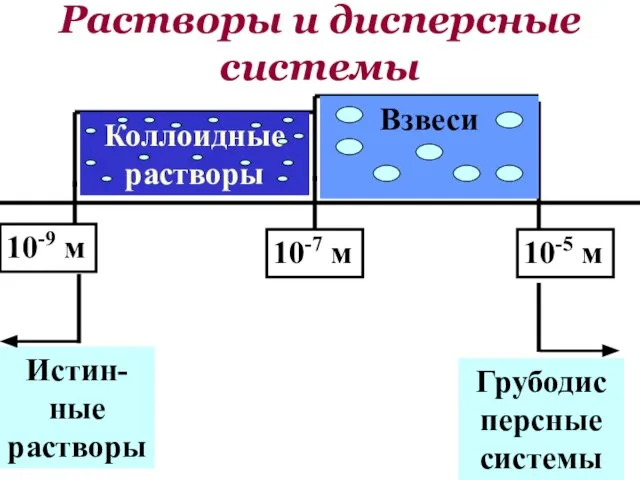
- 144. Размер частиц более 10-5 м. Такие системы являются гетерогенными и относятся к дисперсным системам. Гетерогенные системы
- 145. Диспе́рсная систе́ма — это образования — это образования из двух или более числа фаз (тел), которые
- 147. 10-5 м 10-7 м 10-9 м Взвеси Коллоидные растворы Истин-ные растворы Растворы и дисперсные системы Грубодисперсные
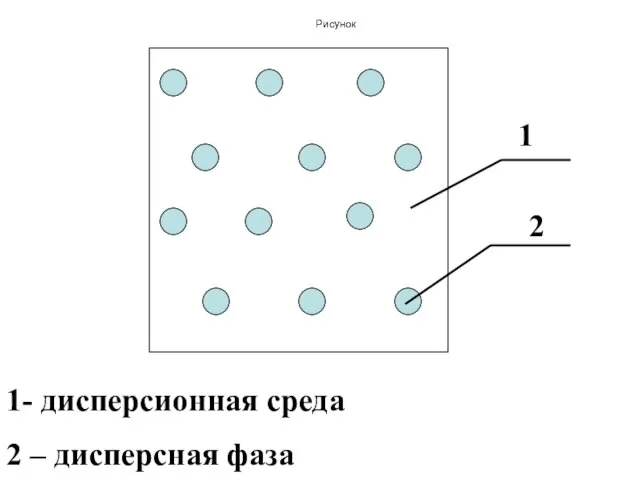
- 148. Дисперсные системы Все дисперсные системы состоят из сплошной фазы (дисперсионная среда) и прерывистой (раздробленной) фазы (дисперсная
- 149. Рисунок 2 1 1- дисперсионная среда 2 – дисперсная фаза
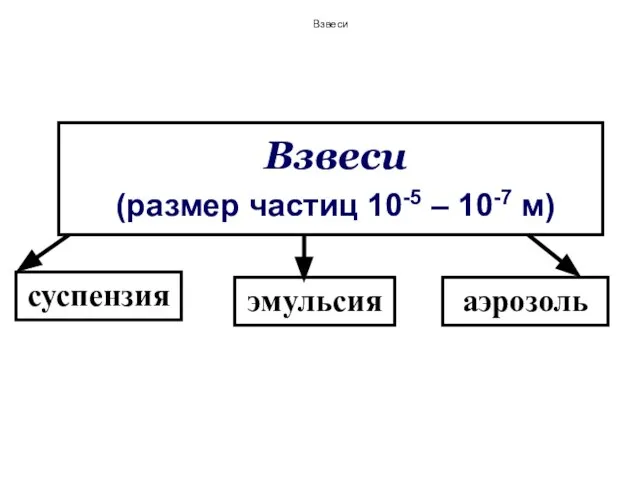
- 150. Взвеси (размер частиц 10-5 – 10-7 м) суспензия эмульсия аэрозоль Взвеси
- 151. Суспензии Дорожная грязь - частицы минералов алюмосиликатов (глина) в водной среде. Краски, эмали, чистящие пасты, косметические
- 152. Эмульсии Эмульсии представляют собой смеси состоящие из взаимно нерастворимых жидкостей. Дисперсионная среда и дисперсная фаза –
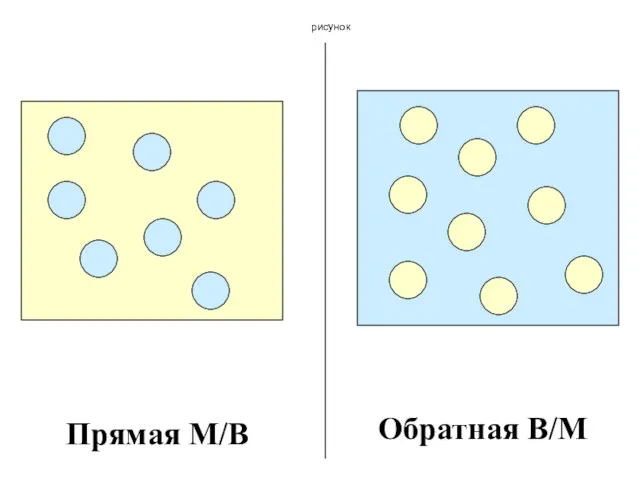
- 153. продолжение Специфическое свойство эмульсий – образовывать системы со сферическими частицами дисперсной фазы. Прямая эмульсия – молоко
- 154. рисунок Прямая М/В Обратная В/М
- 155. Аэрозоли это дисперсные системы – в которых частицы дисперсной фазы находятся во взвешенном состоянии (аэро –
- 156. Классификация аэрозолей
- 157. Пены Это дисперсные системы типа Г/Ж – дисперсная фаза пузырьки газа, дисперсионная среда слои жидкости. Примеры
- 158. Коллоидные растворы. Это растворы с размером частиц 10-7-10-9м. Такой размер частиц является промежуточным между частицами в
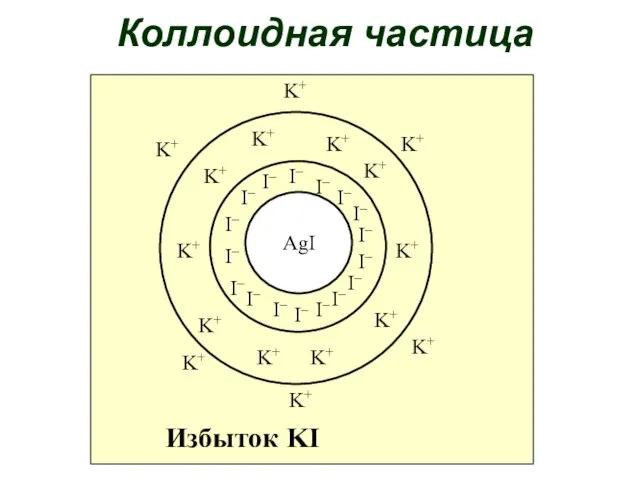
- 159. продолжение Твердые коллоидные растворы – природные минералы и драгоценные камни. Коллоидные частицы имеют сложное строение. Состоит
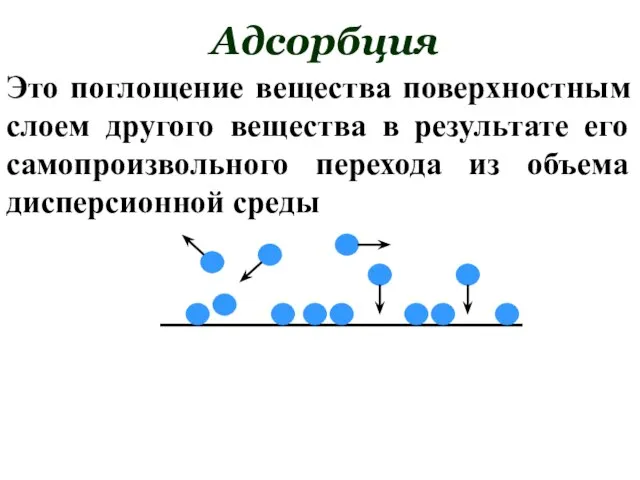
- 160. Адсорбция Это поглощение вещества поверхностным слоем другого вещества в результате его самопроизвольного перехода из объема дисперсионной
- 161. Лиофильные (гидрофильные) коллоиды – растворитель взаимодействует с ядром частиц Лиофобные (гидрофобные) коллоиды растворитель не взаимодействуе с
- 162. AgI I– I– I– I– I– I– I– I– I– I– I– I– I– I– I–
- 163. Удаление загрязнений с помощью детергентов (моющих средств) Модель 13.2
- 165. Скачать презентацию



















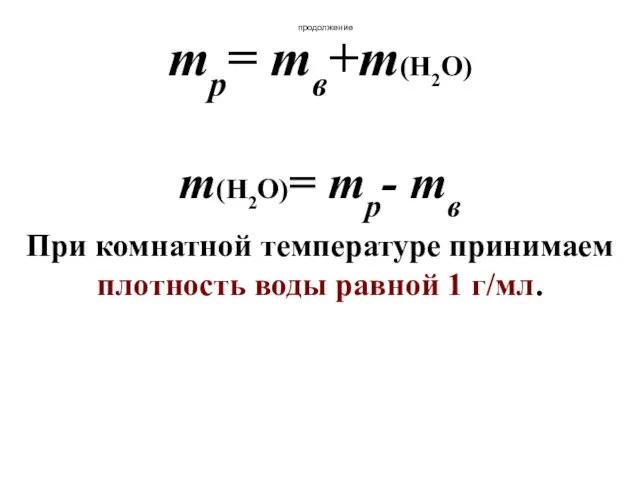




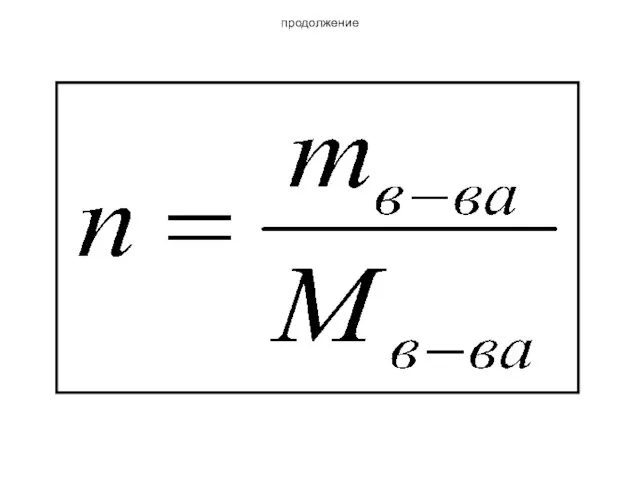
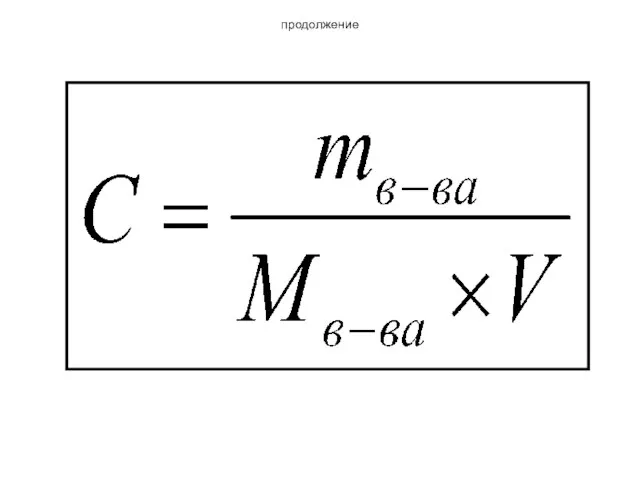


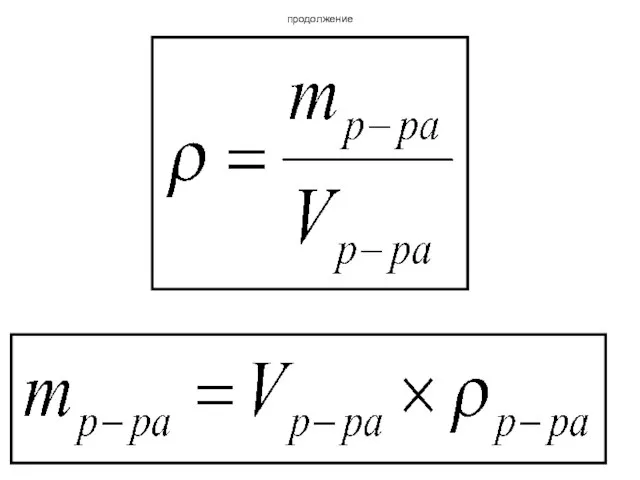









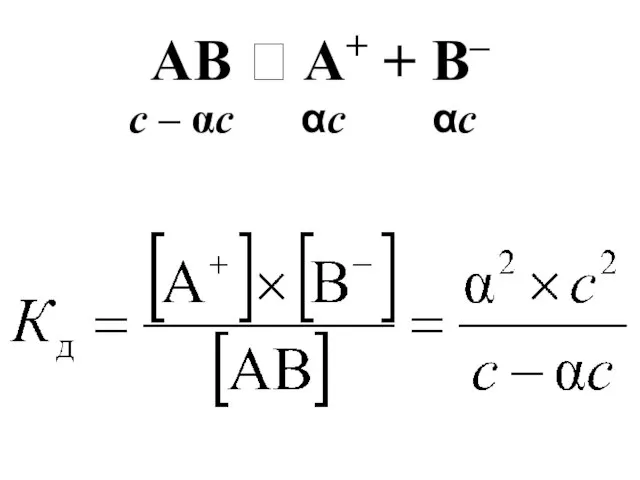
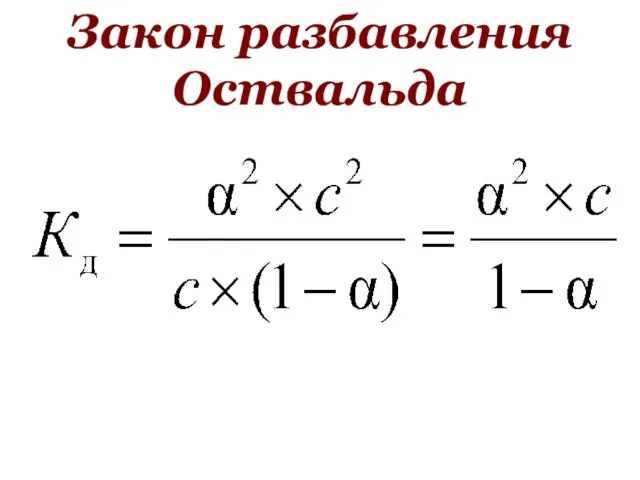
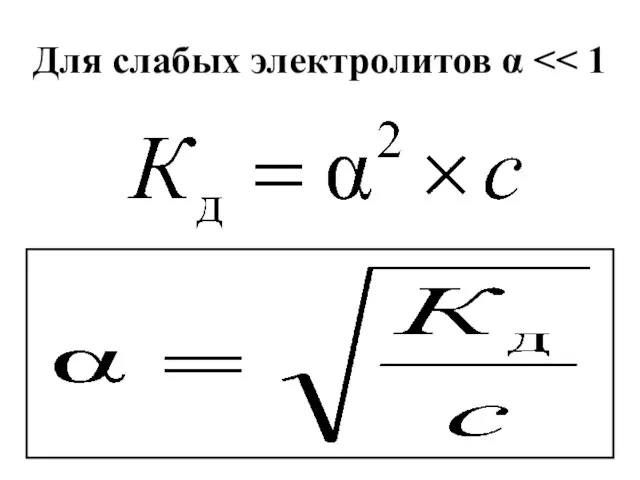





![Диссоциация слабых кислот и кислот средней силы HNO2⇔ H++NO2- Кд=[H+]×[NO2-]/[HNO2] Средние и слабые кислоты](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376865/slide-54.jpg)


![Диссоциация слабых оснований и оснований средней силы NH4OH ⇔NH4++OH- Кд=[NH4+]×[OH-]/[NH4OH]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376865/slide-57.jpg)
![1. Fe(OH)2 ⇔FeOH++OH- Кд1=[FeOH+] ×[OH-]/[Fe(OH)2] 2. FeOH+⇔ Fe2++OH- Кд2=[Fe2+] ×[OH-]/[Fe(OH)+] Ступенчатая диссоциация слабого основания](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376865/slide-58.jpg)










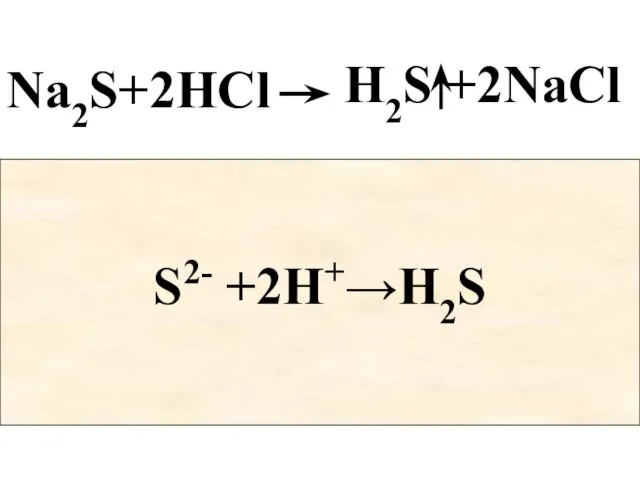


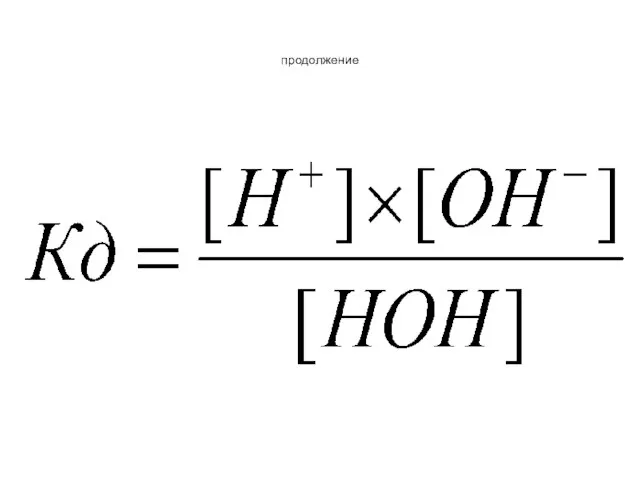
![Ионное произведение воды Величина Кд и концентрация воды являются постоянными Следовательно Кд×[HOH] =Кв.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376865/slide-77.jpg)
![Ионное произведение воды Кв = [ Н+]×[ОН-] (3)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376865/slide-78.jpg)

![При 250С Кв=10-14 [ Н+]×[ОН-]=10-14 (4)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376865/slide-80.jpg)
![Характер среды в водных растворах В чистой воде [ Н+]=[ОН-]=10-7 моль/л. Растворы](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376865/slide-81.jpg)
![[ Н+]>[ОН-] кислая среда; [ Н+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376865/slide-82.jpg)
![Расчет [ Н+] и [ОН-] [ Н+]=10-14/[ОН-] [ОН-]=10-14/ [ Н+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376865/slide-83.jpg)

![рН= -lg[H+] [H+]=10-pH Водородным показателем называется отрицательный логарифм концентрации ионов водорода](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376865/slide-85.jpg)




![НОН⇔Н++ОН- [Н+]=[ОН-]=10-7 моль/л Среда нейтральная В реакции гидролиза участвуют 1 моль воды и 1 «слабый ион»](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376865/slide-91.jpg)

















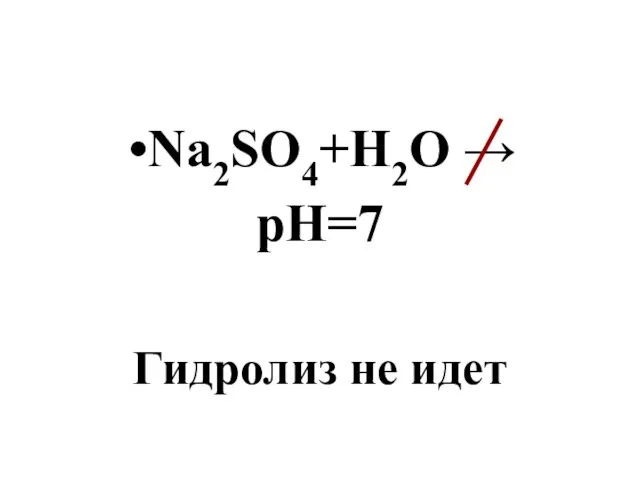







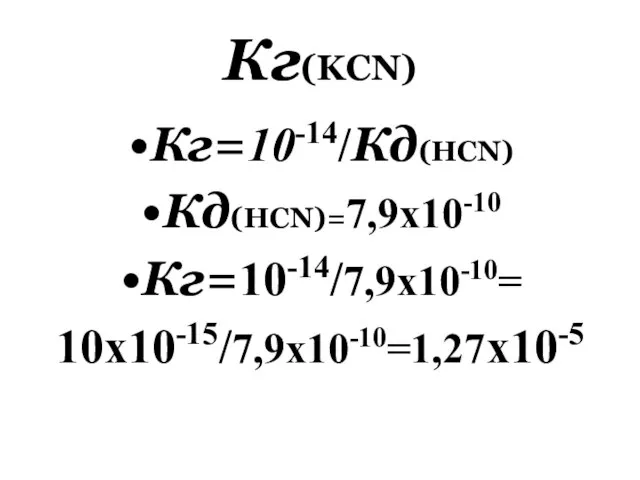














![В насыщенном растворе: BaSO4 кр ⇄ Ba2++SO42- Kp = [Ba2+]p[SO42- ]p =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376865/slide-134.jpg)



















 АСВ-Техникс
АСВ-Техникс Проект по восстановлению мест гнездования балобана в Республике Тува
Проект по восстановлению мест гнездования балобана в Республике Тува Воздушные компрессора Patriot
Воздушные компрессора Patriot Автоматизированная система учета помещений ВУЗа
Автоматизированная система учета помещений ВУЗа Программное обеспечение персонального компьютера
Программное обеспечение персонального компьютера Производственная логистика
Производственная логистика Изометрическая проекция детали
Изометрическая проекция детали Подготовка и организация строительства
Подготовка и организация строительства Управление дебиторкой
Управление дебиторкой Морозова Ольга Васильевна
Морозова Ольга Васильевна Введение в специальность
Введение в специальность Демографическая ситуация в России (11 класс)
Демографическая ситуация в России (11 класс) Научные интенсивы. Шаблон для защиты проекта
Научные интенсивы. Шаблон для защиты проекта Сложение и вычитание чисел в пределах 100
Сложение и вычитание чисел в пределах 100 Волшебное путешествие к мечте
Волшебное путешествие к мечте Развиваем дар слова
Развиваем дар слова Nineteeneffect by nineteenstudio
Nineteeneffect by nineteenstudio Откуда ты, имя?
Откуда ты, имя? Descriptive language
Descriptive language Familia de Microcontrolere AVR (ATMEL)
Familia de Microcontrolere AVR (ATMEL) florists department
florists department Правописание суффиксов имен существительных
Правописание суффиксов имен существительных «1С:Предприятие 8. 1С-Рейтинг: Диетпитание»
«1С:Предприятие 8. 1С-Рейтинг: Диетпитание» Международное гуманитарное право.
Международное гуманитарное право. Персональный стиль
Персональный стиль Проблемы реализации процедуры конкурсного производства в отношении должника и пути их решения
Проблемы реализации процедуры конкурсного производства в отношении должника и пути их решения «Вишнёвый сад»
«Вишнёвый сад» Thanksgiving day. My finally comment
Thanksgiving day. My finally comment