Слайд 2План лекции
Устойчивость коллоидных растворов, ее виды
Коагуляция коллоидных растворов электролитами
Правило Шульце-Гарди
Кинетика коагуляции
Взаимная коагуляция

золей
Коллоидная защита
Слайд 3Гидрофобные коллоидные растворы
Обладают большой удельной поверхностью раздела между дисперсной фазой и дисперсионной

средой
Большой избыточной поверхностной энергией
Являются термодинамически неравновесными, агрегативно-неустойчивыми
Можно говорить лишь об относительной устойчивости коллоидных систем
Слайд 4Кинетическая устойчивость
Способность дисперсных частиц удерживаться во взвешенном состоянии под влиянием броуновского движения

и противостоять действию сил тяжести
Факторы кинетической устойчивости:
Броуновское движение
Степень дисперсности
Вязкость дисперсионной среды
Разность плотностей фазы и среды
Слайд 5Агрегативная устойчивость
Способность частиц дисперсной фазы поддерживать определенную степень дисперсности (препятствовать образованию агрегатов)
Факторы

агрегативной устойчивости:
Заряд частиц
Сольватная оболочка
Температура
Слайд 6Теория устойчивости и коагуляции гидрофобных золей (Дерягин и Ландау)
Силы межмолекулярного притяжения –

способствуют агрегации частиц
Силы электростатического отталкивания – наблюдается перекрывание диффузных слоев
При броуновском движении частицы могут свободно приближаться друг к другу на расстояние 10-5 см
Слайд 7Расклинивающее действие тонких слоев воды препятствует дальнейшему движению частиц
Для объединения частиц в

агрегат необходимо преодолеть расклинивающее действие и сблизиться на расстояние 10-7 – 10-8 см
Слайд 8Коагуляция
Процесс объединения частиц в более крупные агрегаты
Скорость коагуляции тем больше, чем меньше

ς - потенциал (меньше заряд частицы)
Процесс самопроизвольной коагуляции золей – старение
Слайд 9Факторы влияющие на скорость коагуляции
Температура
Концентрация золя
Электрический ток
Лучистая энергия
Добавление электролитов

Слайд 10Коагуляция золей электролитами
Коагулирующим действием в электролите обладают те ионы, которые имеют заряд,

противоположный заряду гранул
Для начала коагуляции необходимо достичь порога коагуляции – некоторой минимальной концентрации электролита (ммоль/л), который нужно добавить к 1л золя, чтобы вызвать его явную коагуляцию
Слайд 11Правило значности Шульце-Гарди
Коагулирующая сила иона тем больше, чем больше его заряд
Коагулирующая способность

двухзарядных ионов в десятки раз, а трехзарядных – в сотни раз выше, чем у однозарядных ионов
As2S3 – отрицательно заряженный золь
K+ Ba2+ Al3+
1 : 72 : 540
Fe(OH)3 – положительно заряженный золь
Br- SO42-
1 : 60
Слайд 12Коагулирующая способность ионов зависит
От способности ионов адсорбироваться на коллоидных частицах
От степени гидратации
Лиотропные

ряды:
Cs+ > Rb+ > K+ > Na+ > Li+
Ba2+ > Sr2+ > Ca2+ > Mg2+ > Be2+
Cl- > Br+ > NO3- > J- > CNS-
Слайд 13Механизм коагулирующего действия ионов
Сжатие диффузного слоя противоионов
Избирательная адсорбция ионов
Уменьшение ς - потенциала
Уменьшение

расклинивающего действия дисперсионной среды
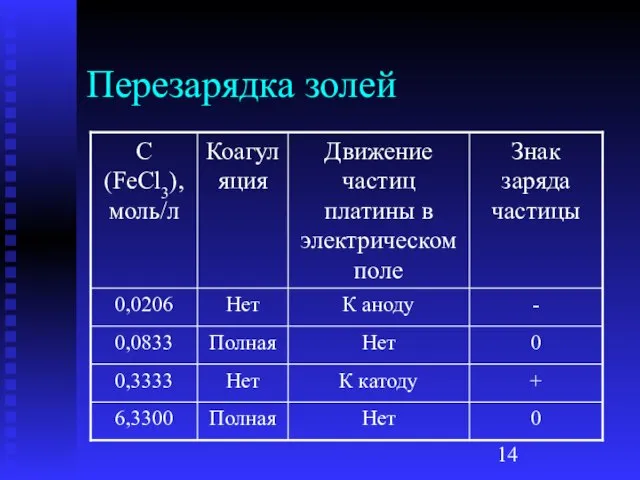
Слайд 15Перезарядка наблюдается при добавлении, как правило, многозарядных ионов. Они обладают большой адсорбирующей

способностью
Избыток ионов Fe3+ притягивает ионы Cl- и это меняет знак ς-потенциала
Чередование зон коагуляции – чередование зон электронейтральности и заряженности частиц
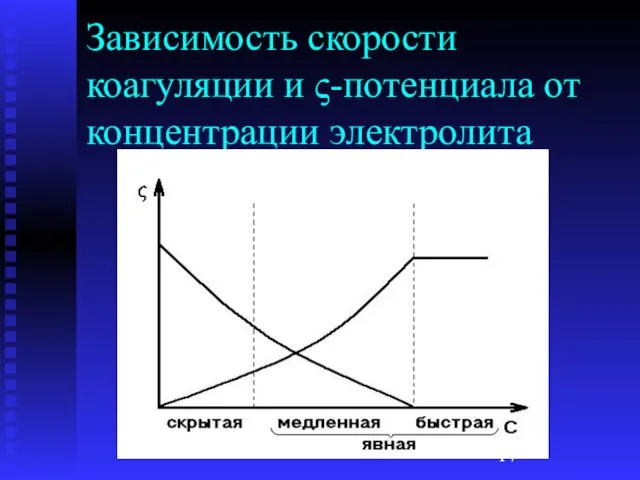
Слайд 16Кинетика коагуляции
Скрытая коагуляция – при увеличении концентрации электролита начинается образование частиц низших

порядков
Явная коагуляция – видимые изменения золя (помутнение, изменение окраски)
Медленная коагуляция – увеличение концентрации электролита ускоряет коагуляцию
Быстрая коагуляция – увеличение концентрации электролита не влияет на скорость коагуляции
Слайд 17Зависимость скорости коагуляции и ς-потенциала от концентрации электролита
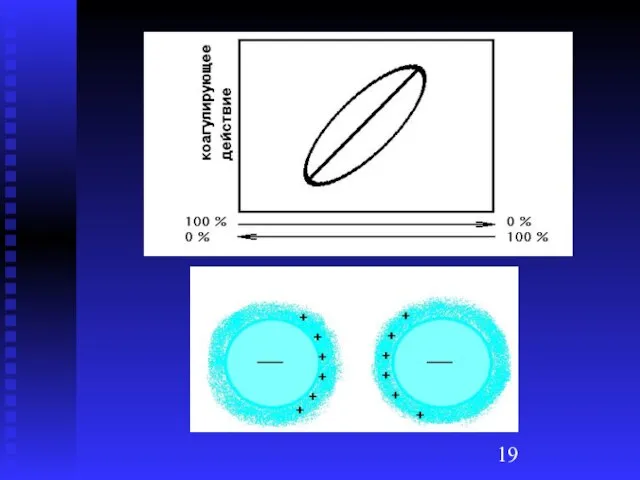
Слайд 18Коагуляция смесями электролитов
Аддитивность (суммирование) – коагулирующий эффект от двух электролитов равен сумме

эффектов каждого из них
Синергизм – один электролит несколько усиливает коагулирующее действие другого
Антагонизм – общий эффект электролитов больше эффектов каждого из них (один электролит ослабляет действие другого)
Слайд 20Явление привыкания
При медленном добавлении электролита, или порциями через большие промежутки времени, коагуляция

может не наступить
Происходит образование новых химических соединений (пептизаторов), которые придают частицам достаточный ς - потенциал
Слайд 21Взаимная коагуляция золей
Происходит, если смешать два коллоидных раствора, у которых частицы имеют

противоположный заряд
Применяется:
Для очистки воды от частиц глины и органических примесей
Аl2(SO4)3 + 6H2O ⮀ Al(OH)3+ + 3Н2SO4
золь
Слайд 22Коллоидная защита
При добавлении к гидрофобному золю высокомолекулярных веществ происходит их адсорбция на

коллоидных частицах и образование агрегатов, обладающих гидрофильными свойствами (белки, углеводы, желатин, казеин, альбумин, коллоидные ПАВ)
В присутствии высокомолекулярных веществ коллоидные растворы можно сконцентрировать вплоть до высыхания, а затем, добавив растворитель, снова получить коллоидные растворы – свойство обратимости
Слайд 23«Золотое число» (железное, серебряное, рубиновое)
Число мг сухого высокомолекулярного вещества, которое нужно добавить

к 10 мл красного золя золота, чтобы предотвратить его коагуляцию при добавлении 1 мл 10% раствора NaCl
Золотые числа условны, так как на защитное действие вещества влияет дисперсность золя, молекулярный вес защитного вещества, значение рН системы




















 Денежные переводы физических лиц: состояние и тенденции развития (на примере ПАО Сбербанк)
Денежные переводы физических лиц: состояние и тенденции развития (на примере ПАО Сбербанк) Особенности истории информатики
Особенности истории информатики Мотивирование топ-менеджеров в банковской сфере: подходы и инструменты
Мотивирование топ-менеджеров в банковской сфере: подходы и инструменты = 1
= 1 Изустная среда мордовского села
Изустная среда мордовского села Показатели рыночной активности
Показатели рыночной активности Выхухоль. Красная книга
Выхухоль. Красная книга Обработка текстовой и графической информации. Создаём комбинированный документ
Обработка текстовой и графической информации. Создаём комбинированный документ Телевидение: я выбираю или меня выбирают. Автор и руководитель проекта: Симонова Ольга Владимировна 2004 год
Телевидение: я выбираю или меня выбирают. Автор и руководитель проекта: Симонова Ольга Владимировна 2004 год Что я сделаю, чтобы доверенный мне магазин стал лучшим на рынке
Что я сделаю, чтобы доверенный мне магазин стал лучшим на рынке Туалетная вода для мужчин Faberlic Intense
Туалетная вода для мужчин Faberlic Intense Межпроцедурные анализы и оптимизации
Межпроцедурные анализы и оптимизации Внешняя политика СССР в 1930-е гг. и накануне Великой Отечественной войны
Внешняя политика СССР в 1930-е гг. и накануне Великой Отечественной войны Урок 3 Человек и Бог в православии-повторение
Урок 3 Человек и Бог в православии-повторение 17 век
17 век ПЕРЕГОВОРЫ
ПЕРЕГОВОРЫ Изготовление вечернего платья
Изготовление вечернего платья Теорiя iгор
Теорiя iгор  Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс
Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс аня хочет санчо панчо
аня хочет санчо панчо Создание таблиц в Microsoft Word
Создание таблиц в Microsoft Word Teenagers’ society problems
Teenagers’ society problems Воля познавать
Воля познавать Любимое блюдо моей семьи
Любимое блюдо моей семьи Ладья. Урок №8
Ладья. Урок №8 Описательные характеристики распределения тестовых результатов
Описательные характеристики распределения тестовых результатов Презентация на тему Одиночество
Презентация на тему Одиночество Ich gehe mit meine Laterne
Ich gehe mit meine Laterne