Содержание
- 2. Цель презентации В этой презентации мы рассмотрим процесс коррозии металлов как окислительно-восстановительную реакцию. Изучим : что
- 3. 1.Цели презентации 2.Что такое коррозия? 3.Почему коррозия - это коррозия? 4. Виды коррозий 5.Химическая коррозия 6.Электрохимическая
- 4. Что такое коррозия? Коррозия - это разрушение твердых тел вызванное химическими и электрохимическими процессами, развивающимися на
- 5. Происхождение слова Слово коррозия происходит от латинского “corrodo” - “грызу”. Некоторые источники ссылаются на позднелатинское “corrosio”
- 6. Какая она бывает? Существует несколько классификаций процессов коррозии. Сначала опишем классификацию по механизму процесса. Коррозию подразделяют
- 7. Химическая коррозия Под химической коррозией подразумевают взаимодействие металлической поверхности с окружающей средой, не сопровожда- ющееся возникновением
- 8. Электрохимическая коррозия Рассмотрим коррозию железа как электрохимический процесс. Ржавление железа есть не что иное, как анодная
- 9. Электрохимическая коррозия 2Fe + O2 + 4H+ = 2FeO + 2H2O. Таким образом, начальную стадию коррозии
- 10. Механохимическая коррозия При механохимической коррозии к химическим и электрохимическим процессам добавляются механические воздействия: трение, напряжение, циклические
- 11. Виды коррозионных разрушений Общая или сплошная коррозия при которой коррозирует вся поверхность металла. Она соответственно делится
- 12. Ещё одна классификация По условиям протекания процесса: а) Газовая коррозия - это коррозия в газовой среде
- 13. Сущность коррозии Рассмотрим случай, когда железо загрязнено примесями меди.При этом возникают гальванические микроэлементы.Металл с более отрицательным
- 14. Борьба с коррозией Основные методы защиты: применение защитных покрытий(металлические изделия покрывают другим металлом (хромирование) или лаками,
- 15. Катодная защита Для защиты железа от коррозии используются всевозможные покрытия: краска, слой металла (олова, цинка). При
- 16. Защита резервуаров Для защиты металлических поверхностей, подвергающихся воздействию агрессивных веществ: масел, бензина, концентрированных кислот, растворов щелочей,
- 17. Знаете ли Вы, что... 1. Знаменитый «Медный всадник» установлен на внутреннем железном каркасе, который соединён с
- 18. Знаете ли Вы, что... 4. Дамасские мастера для снятия ржавчины использовали раствор серной кислоты с добавками
- 19. Знаете ли Вы, что... 7. Если у человека во рту имеются коронки, изготовленные из разных металлов,
- 20. Как это объяснить? В земле железо Fe, естественно, ржавело, превращаясь в метагилроксид железа: 4Fe + H2O
- 21. Знаете ли Вы, что... На рукомойнике моём Позеленела медь, Но так играет луч на нем, Что
- 22. Как это объяснить? В поэтических строках А.Ахматовой говорится о том, что на медном рукомойнике появился налет
- 23. Что можно сказать... Из всего вышесказанного сделаем вывод об основных характеристиках коррозии: коррозия - окислительно-восстановительных процесс
- 24. Дорогие друзья! Благодарим Вас за просмотр данной презентации, надеемся,что это было интересно и познавательно для Вас.
- 26. Скачать презентацию























 Презентация на тему Задачи на смеси и сплавы (9 класс)
Презентация на тему Задачи на смеси и сплавы (9 класс) Русская литература XX века: общая характеристика
Русская литература XX века: общая характеристика Денежные единицы мира
Денежные единицы мира Презентация на тему Золотой век Екатерины II
Презентация на тему Золотой век Екатерины II  Доходный подход к оценке
Доходный подход к оценке Музей Конфлуанс
Музей Конфлуанс Гендерные аспекты семейной политики Жанна Чернова НИУ-ВШЭ
Гендерные аспекты семейной политики Жанна Чернова НИУ-ВШЭ Презентация на тему Технология обработки древесины
Презентация на тему Технология обработки древесины Статистический анализ массовых наблюдений НЛО в восточном Оренбуржье
Статистический анализ массовых наблюдений НЛО в восточном Оренбуржье Поняття ЕТ Excel
Поняття ЕТ Excel Налоги: сущность и виды. Классификация
Налоги: сущность и виды. Классификация Внутреняя энергия
Внутреняя энергия В стране правовых знаний
В стране правовых знаний Убранство русской избы
Убранство русской избы Политико-правовая теория Монтескье
Политико-правовая теория Монтескье 169601
169601 Отделение восстановительного леченияреабилитация* неврологические больные (22,1%)* кардиологические больные (20,2%)* * травматол
Отделение восстановительного леченияреабилитация* неврологические больные (22,1%)* кардиологические больные (20,2%)* * травматол Франсуа Виет и его теорема (8 класс)
Франсуа Виет и его теорема (8 класс) Может ли природа жить без человека?
Может ли природа жить без человека? Юридическая ответственность и её виды
Юридическая ответственность и её виды Осенняя одежда
Осенняя одежда Банк внешней торговли (Внешторгбанк)
Банк внешней торговли (Внешторгбанк)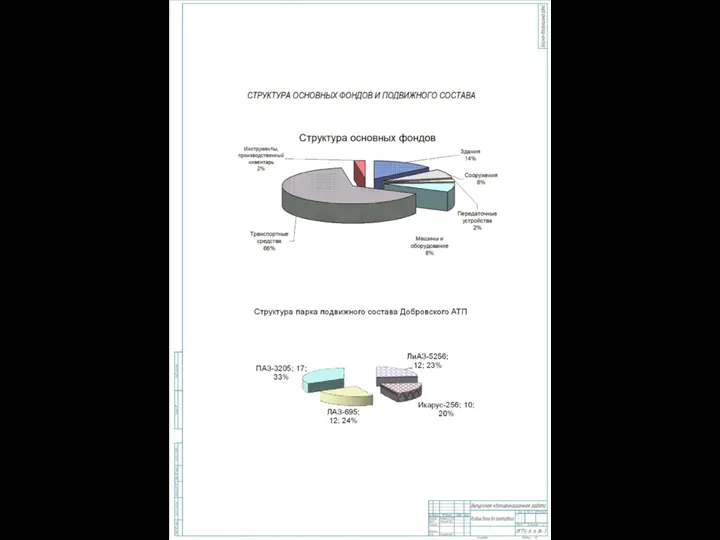 Структура основных фондов и подвижного состава
Структура основных фондов и подвижного состава Saint Isaac’s Square
Saint Isaac’s Square Агентство «Инсайт Маркетинг» решает задачи привлечения клиентов и повышения продаж при помощи инструментов интернет-маркетинга.
Агентство «Инсайт Маркетинг» решает задачи привлечения клиентов и повышения продаж при помощи инструментов интернет-маркетинга.  Педагогический совет
Педагогический совет Виды Смоленска
Виды Смоленска НАСС
НАСС