Содержание
- 2. Давайте пригадаємо (запишіть в зошиті): Як позначають протон? Як позначають нейтрон? Як позначають електрон? Яку масу
- 3. Нуклід – будь-який вид атома, що характеризується певним числом протонів та нейтронів. Запис нукліду має вигляд:
- 4. Відносна атомна маса елемента 3Р 4n 3Li 3+4= 7, але Аr(Li)= 6,941 Чому? Атом складається з
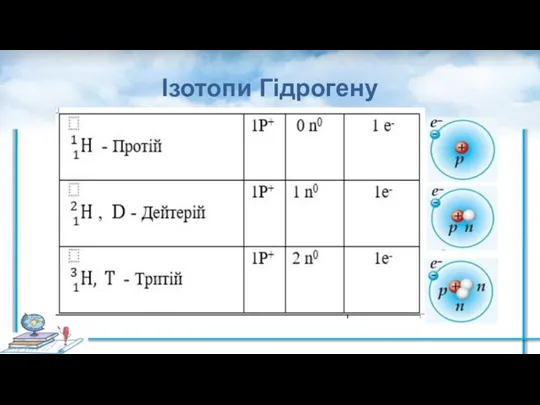
- 5. Більшість елементів існує у вигляді кількох нуклідів. Називають ці нукліди ізотопами. 14
- 6. Ізотопи Гідрогену
- 7. Ізотопи Літію
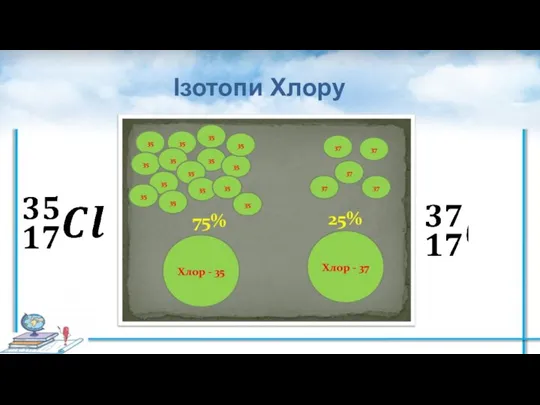
- 8. Ізотопи Хлору
- 9. Ізотопи Оксигену Оксиген скдадається з трьох нуклідів
- 10. Порівняйте будову ізотопів. Знайдіть спільні і відмінні ознаки. Спільне в будові ізотопів: Заряд ядра Кількість протонів
- 11. Хімічний елемент – це вид атомів, що характеризуються однаковим протонним числом (зарядом ядра). Сучасне формулювання періодичного
- 12. Визначення відносної атомної маси хімічного елемента Відносна атомна маса елемента, подана в періодичній таблиці, є середньою
- 13. Визначення відносної атомної маси хімічного елемента У природному Хлорі частка нукліда 35Cl становить ≈ 75,53 %,
- 14. Визначення відносної атомної маси хімічного елемента Елемент Оксиген являє собою суміш ізотопів — нуклідів 16О -
- 15. Застосуйте свої знання Скільки різних елементів зображено такими формулами:
- 16. Серед поданих нуклідів знайдіть ізотопи: Відповідь: Оскільки ізотопи – це нукліди одного хімічного елемента, то вони
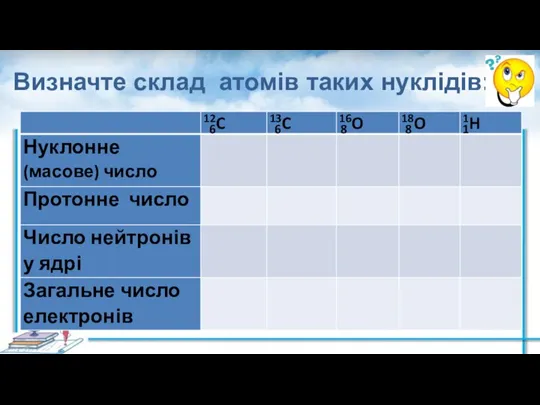
- 17. Визначте склад атомів таких нуклідів: 6 6 8 8 1
- 19. Скачать презентацию













 24 декабря – день варежек
24 декабря – день варежек Исследование эффективности светодиодных источников света.
Исследование эффективности светодиодных источников света. ОТЧЁТ о проделанной работе Совета студенческого самоуправления ОГОУ СПО «СПК»
ОТЧЁТ о проделанной работе Совета студенческого самоуправления ОГОУ СПО «СПК» Политическая мысль Франции
Политическая мысль Франции Образовательная технология Дебаты
Образовательная технология Дебаты Перевод сайта на систему управления нового поколения UMI.CMS
Перевод сайта на систему управления нового поколения UMI.CMS Что такое сентиментализм?
Что такое сентиментализм? Прием в 1 класс. Начальная школа №5 города Макеевки
Прием в 1 класс. Начальная школа №5 города Макеевки СЭД «EOS for SharePoint» Проекты внедрения
СЭД «EOS for SharePoint» Проекты внедрения Виктор Мойсеенко
Виктор Мойсеенко Особенности оформления документов с целью замены регистрационного удостоверения на медицинское изделие
Особенности оформления документов с целью замены регистрационного удостоверения на медицинское изделие Умножение десятичной дроби на натуральное число
Умножение десятичной дроби на натуральное число excel электронные таблицы
excel электронные таблицы Семейное право
Семейное право Ломоносов М.В. Годы жизни: 8 ноября 1711 – 4 апреля 1765
Ломоносов М.В. Годы жизни: 8 ноября 1711 – 4 апреля 1765 Овладение учебно-исследовательской и проектной деятельностью как один из важнейших результатов общего образования
Овладение учебно-исследовательской и проектной деятельностью как один из важнейших результатов общего образования День благодарения
День благодарения Презентация возможностей программы обновления автомобильной техники для федеральных органов исполнительной власти. Жилищно-ко
Презентация возможностей программы обновления автомобильной техники для федеральных органов исполнительной власти. Жилищно-ко Имидж офиса
Имидж офиса Формирование здорового образа жизни дошкольников.
Формирование здорового образа жизни дошкольников. Атрибуты управления шрифтом в CSS
Атрибуты управления шрифтом в CSS образец-2
образец-2 Расчет локальной сметы
Расчет локальной сметы Некоторые экономические аспекты применения знаков и иных ТСОДД на дорогах и улицах
Некоторые экономические аспекты применения знаков и иных ТСОДД на дорогах и улицах Презентация Ангарского филиала ООО «Уралприбор»
Презентация Ангарского филиала ООО «Уралприбор» Адвокатура и адвокатская деятельность в Российской Федерации
Адвокатура и адвокатская деятельность в Российской Федерации Социальное проектирование: методика и практика реализации
Социальное проектирование: методика и практика реализации Налог на добавленную стоимость
Налог на добавленную стоимость