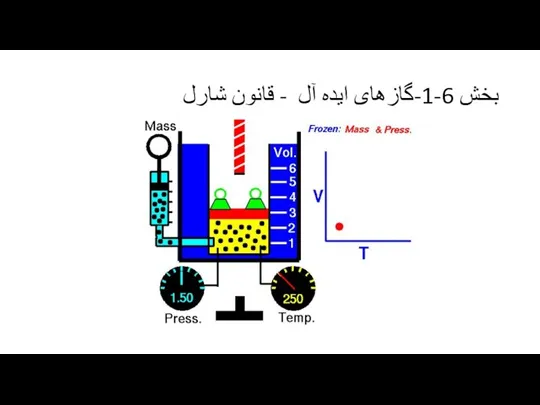
نظر می رسد که حجم همه گازها در حد فشار صفر و دمای بخصوصی به صفر می رسد و با انتخاب یک مقیاس دمایی مناسب رابطه بین حجم و دما به صورت T=BV خواهد بود که B یک ثابت است.
T=BV , at constant p and m , B is a constant
نقطه سه گانه حالتی است که آب مایع – یخ – بخار آب با هم در تعادل هستند.
تعریف مقیاس دمای نسبی سلسیوس بر حسب مقیاس دمای مطلق گاز ایده آل کلوین
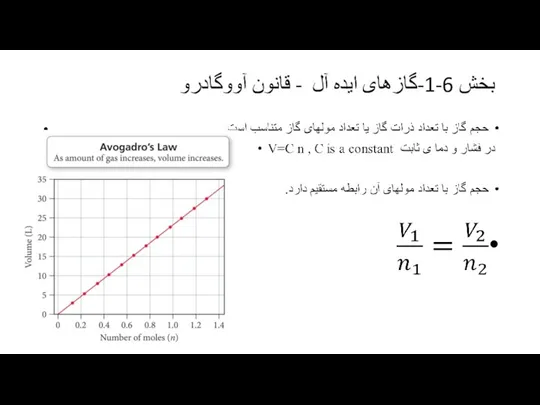
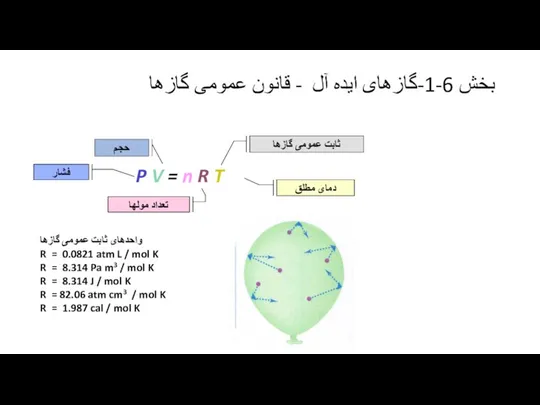
مقیاس دمای مطلق کلوین بر اساس خواص کلی گازها است و مستقل از نوع و جنس گاز است و می توان قانون عمومی زیر را بدست آورد.
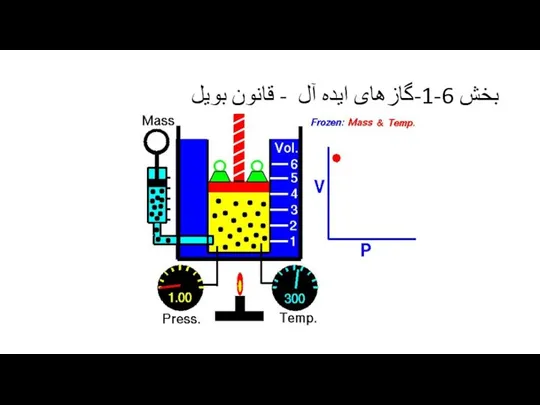
V1/T1=V2/T2
مقایس دمای مطلق گاز ایده آل
V حجم گاز در دمای T مورد نظر
حجم گاز در دمای نقطه سه گانه آب











 Техническое обслуживание и ремонт электрических машин постоянного и переменного тока. Тест
Техническое обслуживание и ремонт электрических машин постоянного и переменного тока. Тест Демонтаж трансмиссии автомобилей
Демонтаж трансмиссии автомобилей Манипулятор. Занятие 3
Манипулятор. Занятие 3 Голография и ее применение
Голография и ее применение Решение задач на расчет электрических цепей
Решение задач на расчет электрических цепей Уравнения Максвелла
Уравнения Максвелла Динамика поступательного движения
Динамика поступательного движения Физика ЕГЭ. Разбор диагностического тестирования (Занятие 1)
Физика ЕГЭ. Разбор диагностического тестирования (Занятие 1) Бронзы в машиностроении (творческая работа)
Бронзы в машиностроении (творческая работа) Физический параметр. Физическая величина
Физический параметр. Физическая величина Електромагнітні явища
Електромагнітні явища Амперметр. Измерение силы тока
Амперметр. Измерение силы тока Механические волны
Механические волны Работа и энергия
Работа и энергия Моделирование процесса полёта исследовательского зонда в поле земного тяготения
Моделирование процесса полёта исследовательского зонда в поле земного тяготения Силы в механике. Решение задач. Урок физики в 10 классе
Силы в механике. Решение задач. Урок физики в 10 классе Идентификация и моделирование CW–crds спектра поглощения молекулы двуокиси азота в области 6000 – 6400 см -1
Идентификация и моделирование CW–crds спектра поглощения молекулы двуокиси азота в области 6000 – 6400 см -1 Презентация на тему Равноускоренное прямолинейное движение
Презентация на тему Равноускоренное прямолинейное движение  Презентация на тему Силы всемирного тяготения
Презентация на тему Силы всемирного тяготения 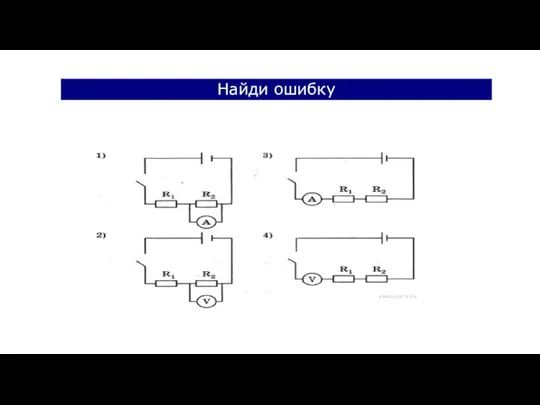 Электрический ток в металлах
Электрический ток в металлах Источники тока
Источники тока Осциллограф. Классификация
Осциллограф. Классификация Потенциальная энергия заряженного тела в однородном электростатическом поле
Потенциальная энергия заряженного тела в однородном электростатическом поле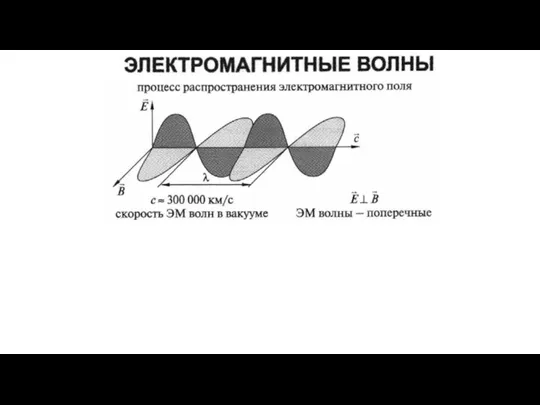 Электромагнитные волны
Электромагнитные волны Электрический ток. Сила тока. Закон Ома. Сопротивление
Электрический ток. Сила тока. Закон Ома. Сопротивление Вероятность формулы. 11 класс, 10 задание
Вероятность формулы. 11 класс, 10 задание Презентация на тему Оптические иллюзии или обман зрения
Презентация на тему Оптические иллюзии или обман зрения  Презентация на тему Видимое излучение
Презентация на тему Видимое излучение