Содержание
- 2. ХИМИЧЕСКИЕ РЕАКЦИИ И ТЕПЛОТА CH4 + 2O2 = CO2 + 2H2O + 2783 кДж/моль NaOH +
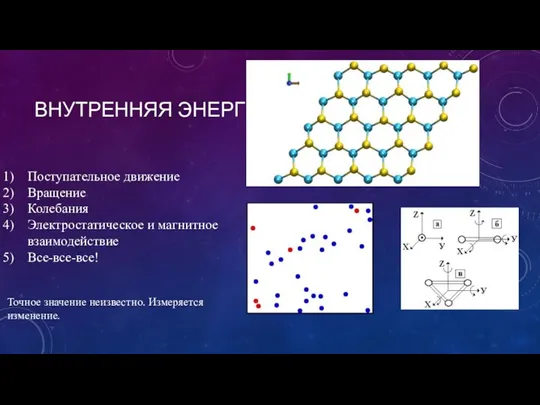
- 3. ВНУТРЕННЯЯ ЭНЕРГИЯ Поступательное движение Вращение Колебания Электростатическое и магнитное взаимодействие Все-все-все! Точное значение неизвестно. Измеряется изменение.
- 4. ЭНЕРГИЯ НЕ МОЖЕТ ВЗЯТЬСЯ ИЗ НИОТКУДА И ИСЧЕЗНУТЬ В НИКУДА (ЭТО ВАЖНО)
- 5. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ Q = ΔU + W Q = ΔH - V Δp (H =
- 6. ВНУТРЕННЯЯ ЭНЕРГИЯ И ЭНТАЛЬПИЯ Q = ΔH - V Δp Q = ΔU + p ΔV
- 7. ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ aA+bB = dD+eE ± Q Q – функция состояния (это важно) CH4 +
- 8. РЕАКЦИИ МОЖНО И НУЖНО СКЛАДЫВАТЬ И ВЫЧИТАТЬ S+O2 = SO2 2SO2+O2 = 2SO3 2S+2O2 + 2SO2+O2
- 9. ЗАДАНИЕ: КАКОЕ КОЛИЧЕСТВО ТЕПЛОТЫ ВЫДЕЛИТСЯ ИЛИ ПОГЛОТИТСЯ ПРИ ГАЗИФИКАЦИИ УГЛЯ С + 2H2 = CH4 СH4(г)
- 10. СТАНДАРТНАЯ ТЕПЛОТА ОБРАЗОВАНИЯ C + 1/2O2 = CO H2 + 1/2O2 = H2O H2 + S
- 11. ЗАКОН ГЕССА С6Н12О6 + 6 О2 = 6 СО2 + 6 Н2О
- 12. ИНТЕРЕСНЫЕ ШТУКИ
- 13. ПОПРОБУЕМ ЧТО-НИБУДЬ ПОСЧИТАТЬ KOH (к) + HCl(р-р, ,беск. H2O) = KCl (р-р, беск. H2O) + H2O
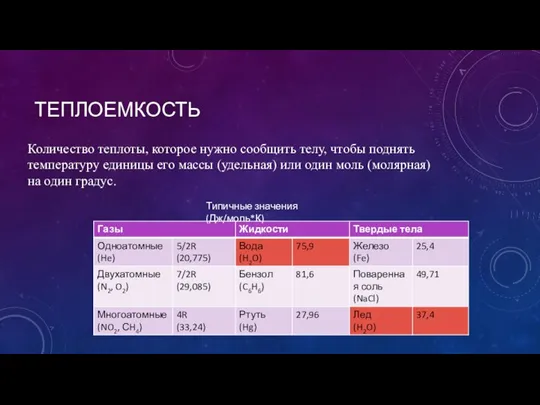
- 14. ТЕПЛОЕМКОСТЬ Количество теплоты, которое нужно сообщить телу, чтобы поднять температуру единицы его массы (удельная) или один
- 16. ЗАДАНИЕ: КАК МОЖНО БЫЛО БЫ УВЕЛИЧИТЬ РАЗОГРЕВ? ОБЪЕМ РАСТВОРА СОЛЯНОЙ КИСЛОТЫ ОСТАВИТЬ ПОСТОЯННЫМ. НА СКОЛЬКО МАКСИМАЛЬНО
- 18. Скачать презентацию













 изические основы микроэлектроники
изические основы микроэлектроники Презентация на тему Сферическое зеркало
Презентация на тему Сферическое зеркало  Лекция 24. Механическое аккумулирование (гидроаккумулирующая электростанция)
Лекция 24. Механическое аккумулирование (гидроаккумулирующая электростанция) Электрическое поле. Напряженность
Электрическое поле. Напряженность ЭДС индукции в движущихся проводниках. Решение задач
ЭДС индукции в движущихся проводниках. Решение задач Измерение работы и мощности тока в электрической лампе. Лабораторная работа № 7
Измерение работы и мощности тока в электрической лампе. Лабораторная работа № 7 Переменный ток. Решение задач
Переменный ток. Решение задач Смачивание. Капиллярнность
Смачивание. Капиллярнность Проводники и диэлектрики в электростатическом поле
Проводники и диэлектрики в электростатическом поле Демонтаж системы питания инжекторных и карбюраторных двигателей
Демонтаж системы питания инжекторных и карбюраторных двигателей Влажность воздуха. Насыщенный и ненасыщенный пар
Влажность воздуха. Насыщенный и ненасыщенный пар Автоматизированная информационная система Техосмотр
Автоматизированная информационная система Техосмотр Силы в механике. Импульс тела. Закон сохранения
Силы в механике. Импульс тела. Закон сохранения Воздухораспределитель №242
Воздухораспределитель №242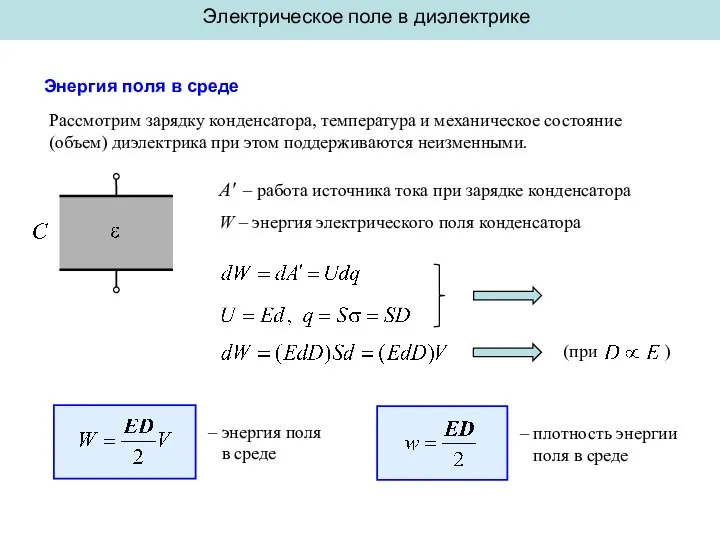 Энергия поля в среде
Энергия поля в среде Клепаные и сварные соединения
Клепаные и сварные соединения Кипение
Кипение Амперметр. Измерение силы тока
Амперметр. Измерение силы тока Поликристаллы. Кристаллическое строение
Поликристаллы. Кристаллическое строение Примеры наклонной плоскости
Примеры наклонной плоскости Сущность фотометрических методов
Сущность фотометрических методов Презентация на тему Воздействие тепловых двигателей на окружающую среду
Презентация на тему Воздействие тепловых двигателей на окружающую среду  Механическая работа
Механическая работа Формирование экспериментального метода решения задач на уроках физики
Формирование экспериментального метода решения задач на уроках физики Правило Ленца
Правило Ленца Теория ядерных реакторов. Семинар к курсовому проекту по спецкурсу № 2
Теория ядерных реакторов. Семинар к курсовому проекту по спецкурсу № 2 Физика в нашем доме. Принцип работы микроволновой (СВЧ) печи
Физика в нашем доме. Принцип работы микроволновой (СВЧ) печи Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса