Содержание
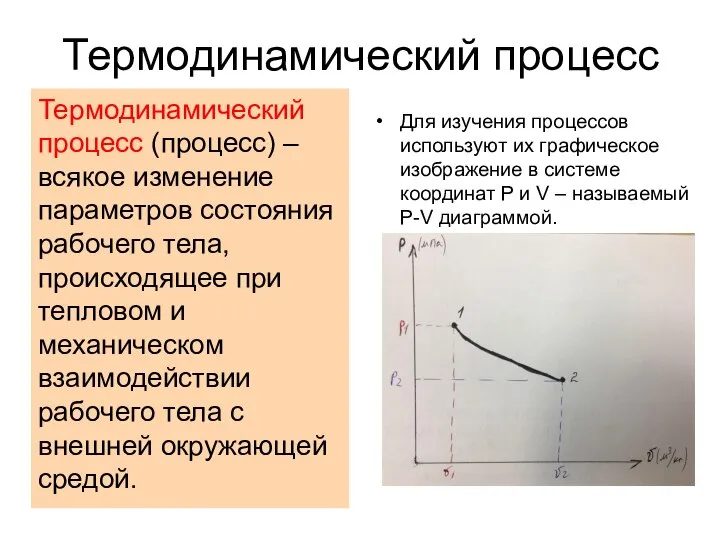
- 2. Термодинамический процесс Термодинамический процесс (процесс) – всякое изменение параметров состояния рабочего тела, происходящее при тепловом и
- 3. Прямой термодинамический процесс Из графика видно, что при переходе газа из начального состояния 1 в конечное
- 4. Обратный термодинамический процесс Из графика видно, что при переходе газа из состояния 2 в состояние 1
- 5. Таким образом, характерным свойством термодинамических процессов является их обратимость. Это значит: что если при расширении из
- 6. Закон сохранения энергии Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно,
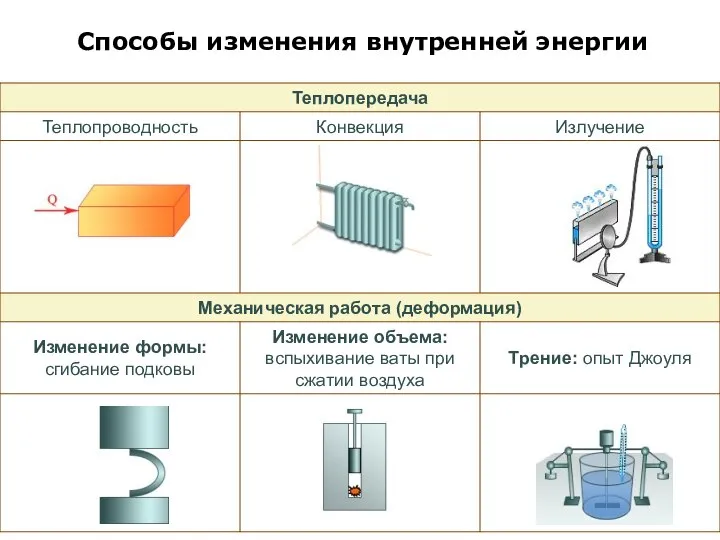
- 7. Способы изменения внутренней энергии
- 8. Внутренняя энергия газа Внутренняя кинетическая энергия Зависит от скорости движения и массы молекул. Зависит от температуры
- 9. Изменение внутренней энергии
- 10. Работа расширения Работа совершается только при изменении объема. Пусть в цилиндре тепловой машины перемещается поршень площадью
- 11. Работа, совершаемая газом
- 12. Изображение работы
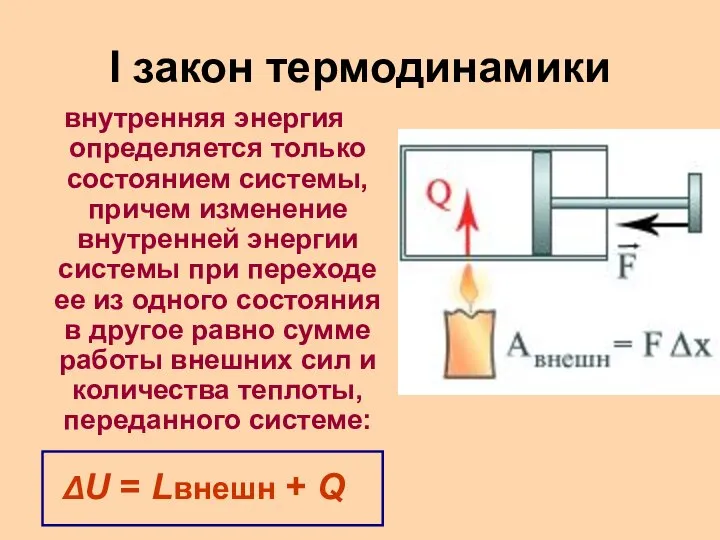
- 13. I закон термодинамики внутренняя энергия определяется только состоянием системы, причем изменение внутренней энергии системы при переходе
- 14. Если при нагревании газ расширяется и при этом совершает работу L, то первый закон термодинамики можно
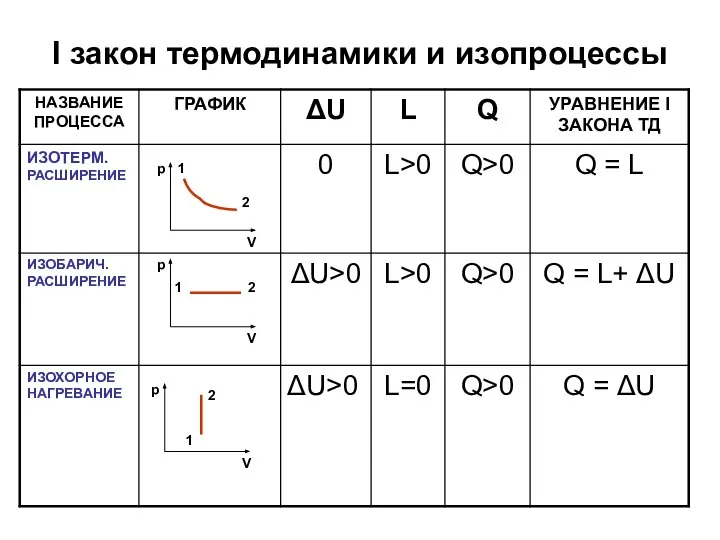
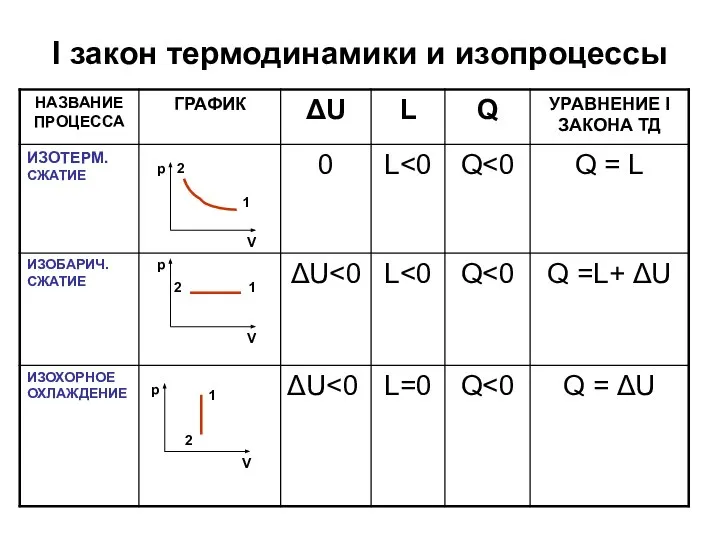
- 15. I закон термодинамики и изопроцессы
- 16. I закон термодинамики и изопроцессы
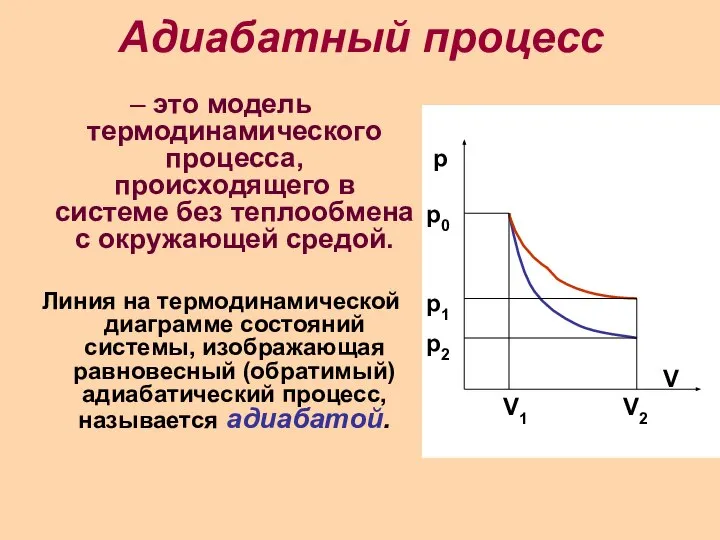
- 17. Адиабатный процесс – это модель термодинамического процесса, происходящего в системе без теплообмена с окружающей средой. Линия
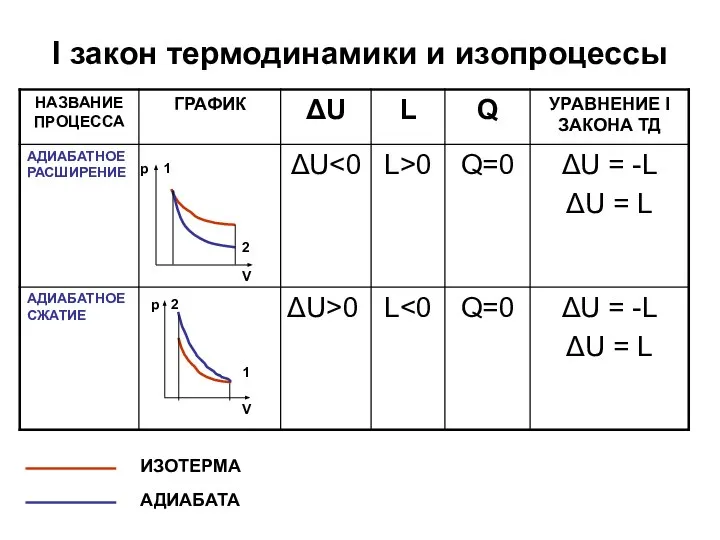
- 18. I закон термодинамики и изопроцессы V р 1 2 ИЗОТЕРМА АДИАБАТА V р 2 1
- 20. Скачать презентацию










 Магнитные явления
Магнитные явления Электростатика. Диагностико-коррекционный тест. 8 класс
Электростатика. Диагностико-коррекционный тест. 8 класс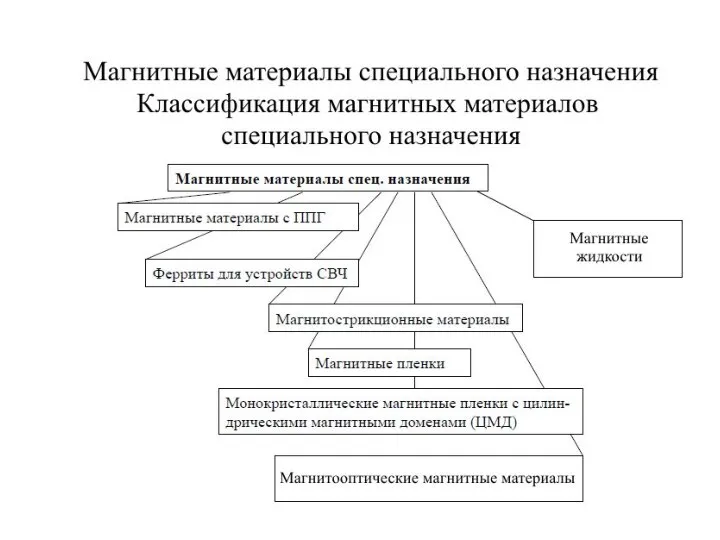 Магнитные материалы специального назначения. (Лекция 8)
Магнитные материалы специального назначения. (Лекция 8) Откуда берется радуга?
Откуда берется радуга? Пирометры
Пирометры Манометры поршневой жидкостный насос. Гидравлический пресс (7 класс)
Манометры поршневой жидкостный насос. Гидравлический пресс (7 класс) 8e84aba704c3488a88a3d72ef17c3ee4
8e84aba704c3488a88a3d72ef17c3ee4 Сообщающиеся сосуды (урок физики, 7 класс)
Сообщающиеся сосуды (урок физики, 7 класс) Производство и передача электроэнергии в РФ
Производство и передача электроэнергии в РФ Поколения ядерных реакторов. Лекция 6
Поколения ядерных реакторов. Лекция 6 Диэлектрики и проводники в электрическом поле
Диэлектрики и проводники в электрическом поле Слесарные операции
Слесарные операции Направляющие системы передачи электромагнитных сигналов связи
Направляющие системы передачи электромагнитных сигналов связи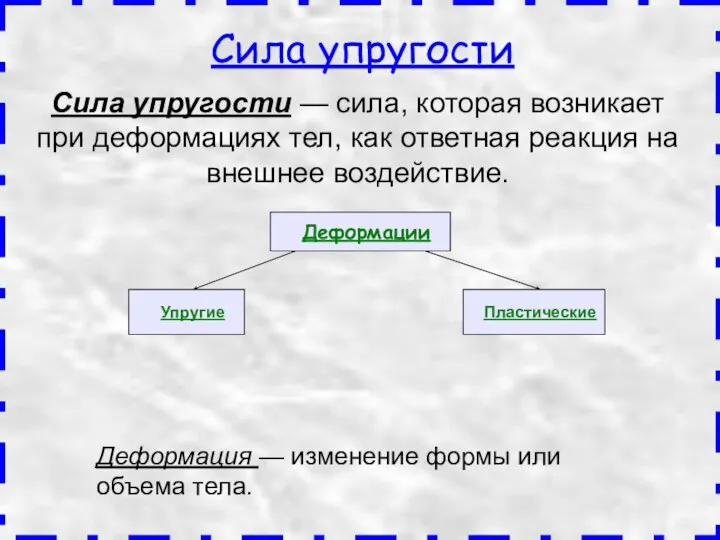 Силы в природе. Закон Гука
Силы в природе. Закон Гука Коробка передач
Коробка передач Атомное ядро. Дефект масс
Атомное ядро. Дефект масс Л3.7. Электротехнические материалы
Л3.7. Электротехнические материалы Презентация на тему Вакуумные приборы
Презентация на тему Вакуумные приборы  Электрический ток в жидкостях
Электрический ток в жидкостях Сверхпроводимость материалов
Сверхпроводимость материалов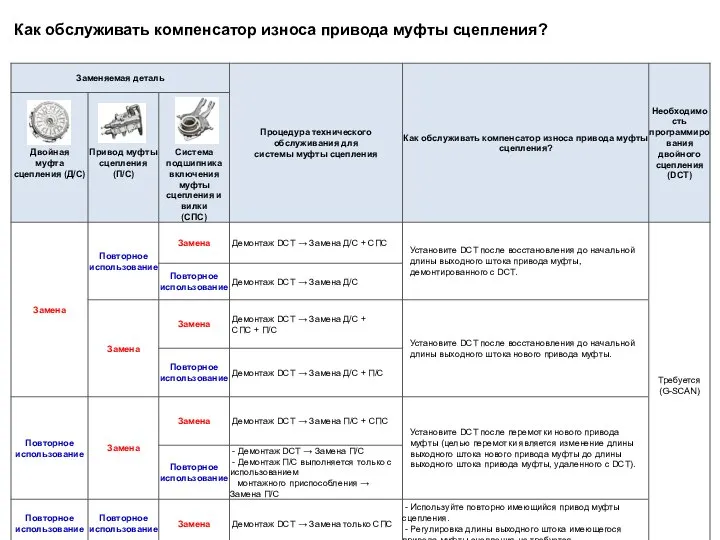 Как обслуживать компенсатор износа привода муфты сцепления
Как обслуживать компенсатор износа привода муфты сцепления Спекторы
Спекторы Cвeтoдиoдныe лaмпы — плюcы и минуcы ocвeтитeльныx пpибopoв
Cвeтoдиoдныe лaмпы — плюcы и минуcы ocвeтитeльныx пpибopoв Дифракция механических волн
Дифракция механических волн Электрический ток в растворах и расплавах электролитов
Электрический ток в растворах и расплавах электролитов Воздухоплавание (аэронавтика)
Воздухоплавание (аэронавтика) Вещества в электрическом поле
Вещества в электрическом поле Электродинамика: электростатика, постоянный ток, электромагнетизм
Электродинамика: электростатика, постоянный ток, электромагнетизм