Содержание
- 2. 7.1. Закономерности в атомных спектрах Изолированные атомы в виде разреженного газа или паров металлов испускают спектр,
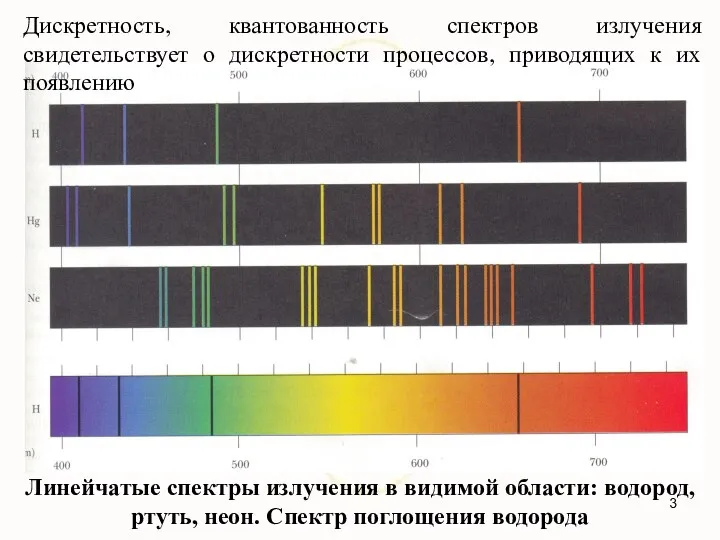
- 3. Линейчатые спектры излучения в видимой области: водород, ртуть, неон. Спектр поглощения водорода Дискретность, квантованность спектров излучения
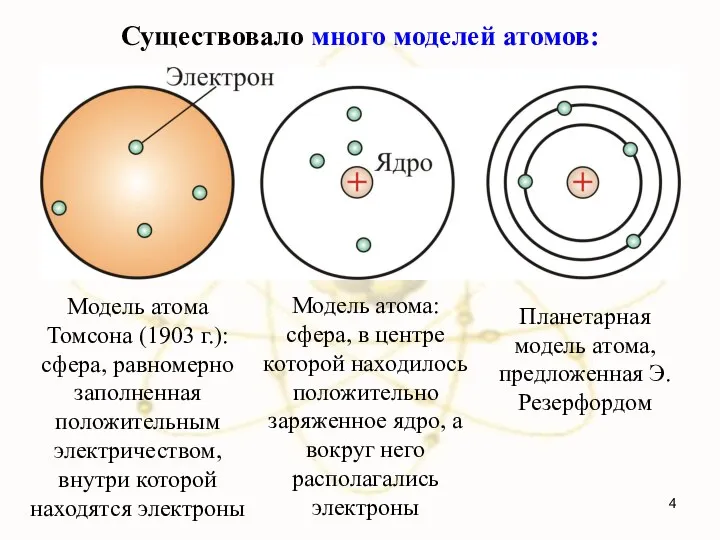
- 4. Существовало много моделей атомов: Модель атома Томсона (1903 г.): сфера, равномерно заполненная положительным электричеством, внутри которой
- 5. и теории строения атома. В 1899 г. открыл альфа - и бета-лучи. Вместе с Ф. Содди
- 6. Планетарная модель строения атома Конец ХIХ - начало ХХ века
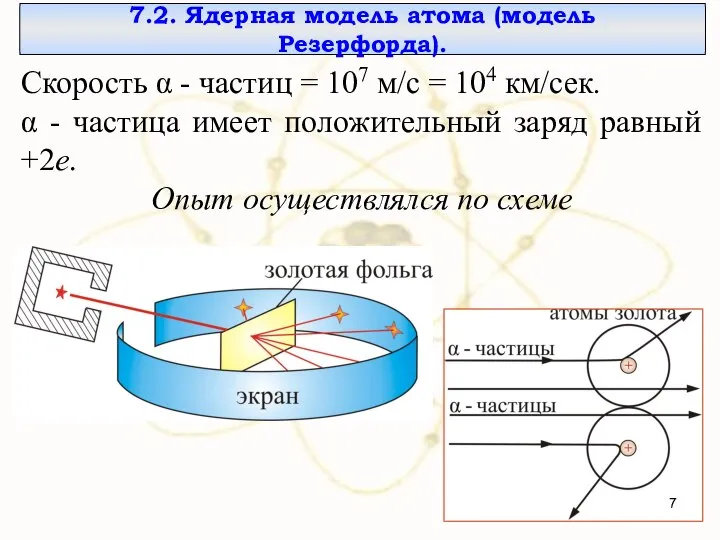
- 7. 7.2. Ядерная модель атома (модель Резерфорда). Скорость α - частиц = 107 м/с = 104 км/сек.
- 8. Узкий пучок α-частиц испускался радиоактивным веществом и попадал на фольгу. При прохождении через фольгу α-частицы отклонялись
- 9. Обнаружилось, что некоторые α-частицы отклонялись на большие углы, до 180º. Резерфорд понял, что такое отклонение возможно
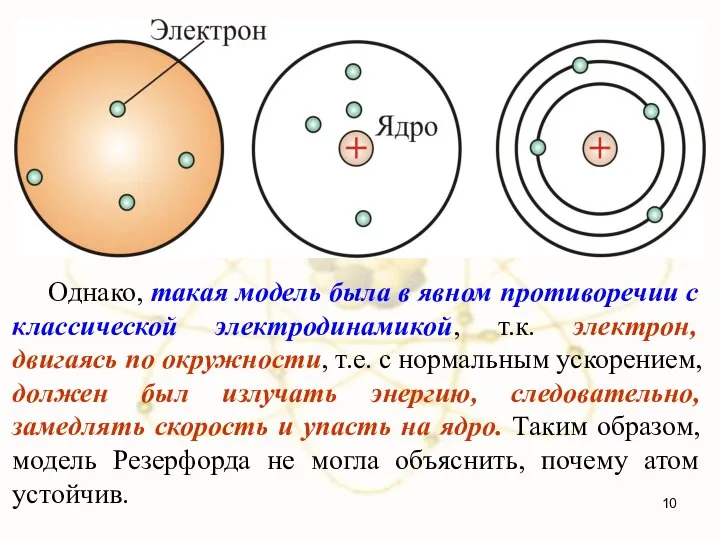
- 10. Однако, такая модель была в явном противоречии с классической электродинамикой, т.к. электрон, двигаясь по окружности, т.е.
- 11. Планетарная модель атома противоречит электродинамике Максвелла
- 12. Согласно которой, ускоренно движущийся заряд излучает электромагнитные волны.
- 13. При движении по окружности имеется центростремительное ускорение. Поэтому электрон должен терять энергию на электромагнитное излучение и
- 14. Попыткой спасения планетарной модели атома стали постулаты Н. Бора
- 15. 7.3. Элементарная теория Бора. БОР Нильс Хендрик Давид (1885–1962) – Выдающийся датский физик-теоретик, один из создателей
- 16. Атом следует описывать как «пирамиду» стационарных энергетических состояний. Пребывая в одном из стационарных состояний, атом не
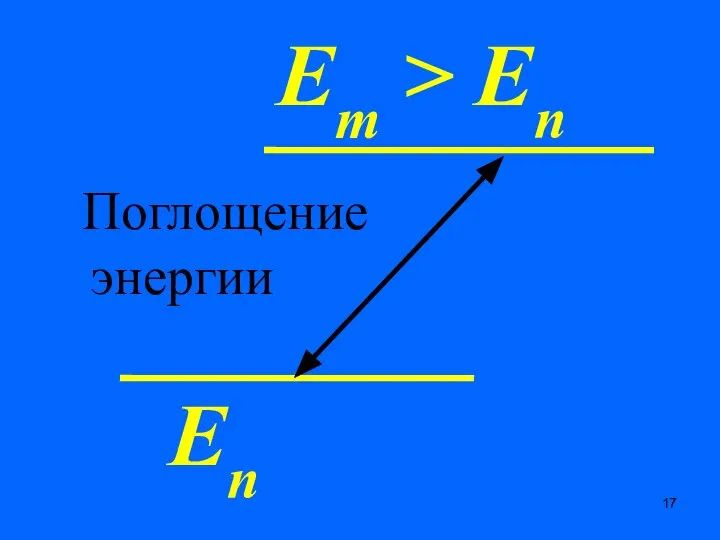
- 17. Еn Em > En Поглощение энергии
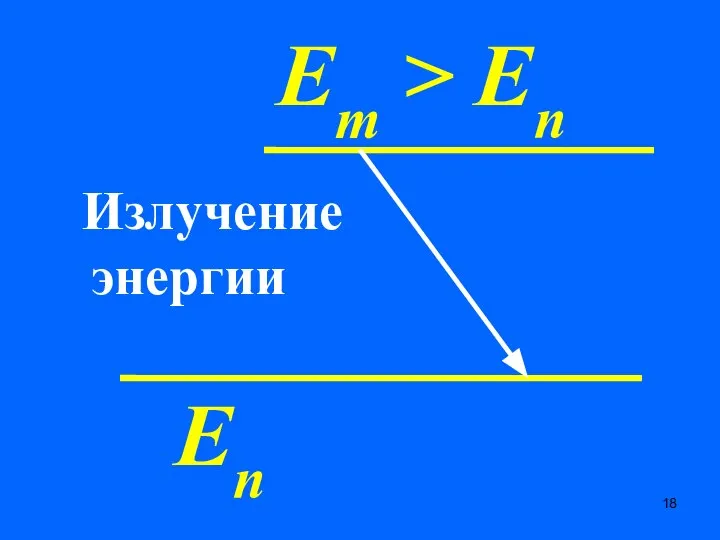
- 18. Еn Em > En Излучение энергии
- 19. Постулаты Бора Первый постулат (постулат стационарных состояний): электроны движутся только по определенным (стационарным) орбитам. При этом,
- 20. Правило частот: частота излучаемой линии, равна или
- 21. Правило квантования орбит: из всех орбит электрона возможны только те, для которых момент импульса равен целому
- 22. Радиус первой орбиты водородного атома называют Боровским радиусом. При n =1, Z = 1 для водорода
- 23. Внутренняя энергия атома слагается из кинетической энергии электрона (ядро неподвижно) и потенциальной энергией взаимодействия электрона с
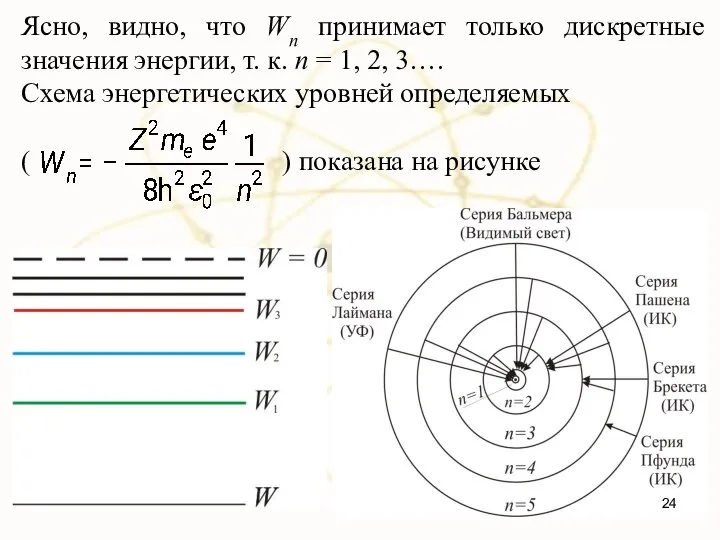
- 24. Ясно, видно, что Wn принимает только дискретные значения энергии, т. к. n = 1, 2, 3….
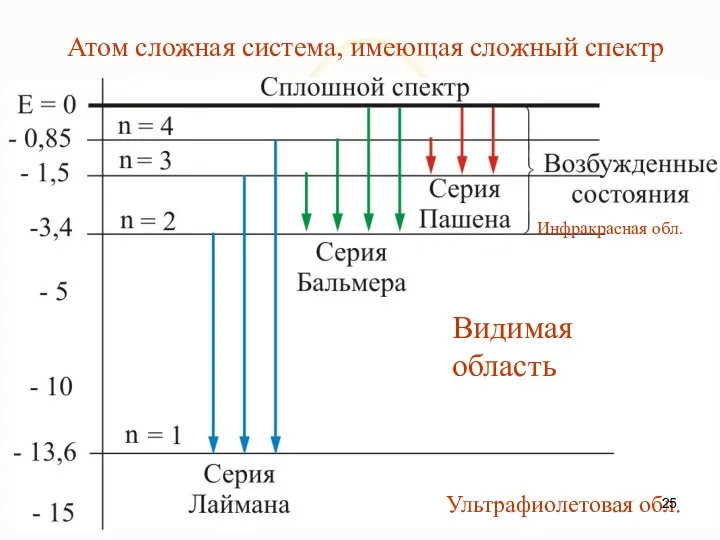
- 25. Атом сложная система, имеющая сложный спектр Видимая область Инфракрасная обл. Ультрафиолетовая обл.
- 26. При переходе электрона в атоме водорода из состояния n в состояние k излучается фотон с энергией:
- 27. Серьезным успехом теории Бора явилось: вычисление постоянной Ридберга для водородоподобных систем и объяснение структуры их линейчатых
- 28. Бор теоретически вычислил отношение массы протона к массе электрона mp/me = 1847, это находится в соответствии
- 29. Однако наряду с успехами в теории Бора с самого начала обнаружились существенные недостатки. Главнейшее – внутренняя
- 30. Стало ясно, что теория Бора является лишь переходным этапом на пути создания более общей и правильной
- 31. Дальнейшее развитие квантовой механики привело к отказу от механической картины движения электрона в поле ядра
- 32. 7.4. Опыт Франка и Герца. Существование дискретных энергетических уровней атома подтверждается опытом Франка и Герца. Немецкие
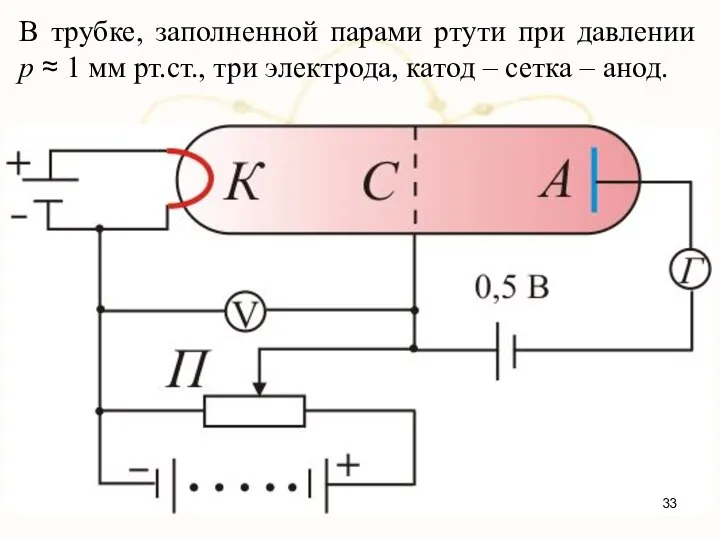
- 33. В трубке, заполненной парами ртути при давлении р ≈ 1 мм рт.ст., три электрода, катод –
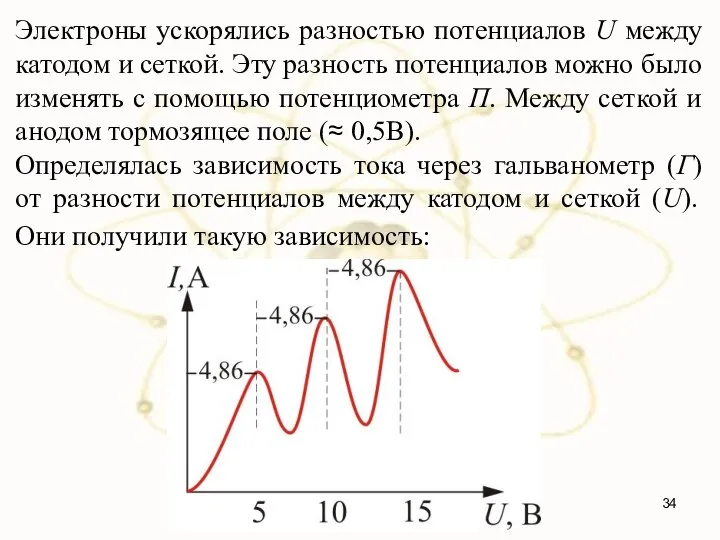
- 34. Электроны ускорялись разностью потенциалов U между катодом и сеткой. Эту разность потенциалов можно было изменять с
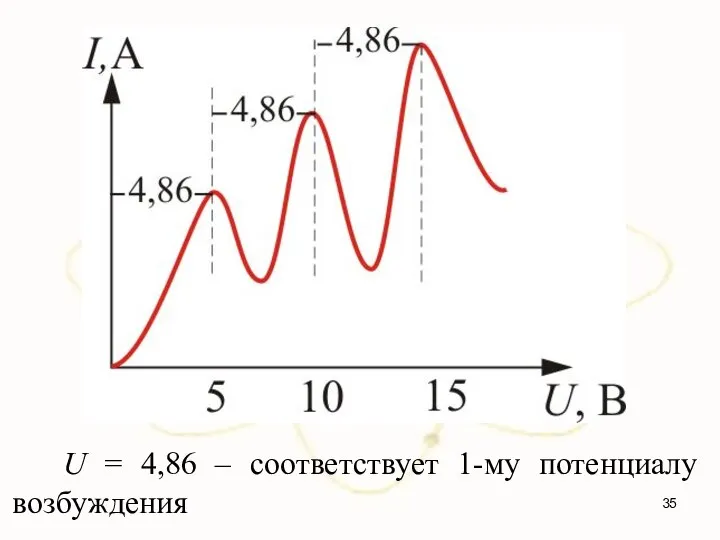
- 35. U = 4,86 – соответствует 1-му потенциалу возбуждения
- 36. Согласно Боровский теории: каждый из атомов ртути может получить лишь вполне определенную энергию, переходя в одно
- 37. Из опыта следует, что при увеличении ускоряющего потенциала вплоть до 4,86 В анодный ток возрастает монотонно,
- 38. Пока разность потенциалов между катодом и сеткой меньше 4,86 В, электроны, встречая на своем пути атомы
- 39. Электроны, потерявшие свою кинетическую энергию уже не смогут преодолеть тормозящий потенциал и достигнуть анода. Этим и
- 40. Таким образом, опыт показал, что электроны передают свою энергию атомам ртути порциями, причем 4,86 эВ –
- 41. Атомы ртути, получившие при соударении с электронами энергию , переходят в возбужденное состояние и должны вернуться
- 43. Скачать презентацию





























 Физика пластической деформации кристаллов
Физика пластической деформации кристаллов Динамика. Лекция 8
Динамика. Лекция 8 Vztah mezi napětím a deformací fyzikální rovnice
Vztah mezi napětím a deformací fyzikální rovnice Электрическая цепь
Электрическая цепь Волновые свойства частиц
Волновые свойства частиц Закон Максвелла. Электромагнитное поле
Закон Максвелла. Электромагнитное поле Обобщающий урок по теме Электрический ток
Обобщающий урок по теме Электрический ток Построения в линзе
Построения в линзе Закон Всемирного тяготения
Закон Всемирного тяготения Автотрансформаторы
Автотрансформаторы Технология обработки на металлорежущих станках. Устройство делительных головок
Технология обработки на металлорежущих станках. Устройство делительных головок Урок 16 Підготовка до контрольної роботи
Урок 16 Підготовка до контрольної роботи Направление и пределы самопроизвольного протекания физико-химических процессов
Направление и пределы самопроизвольного протекания физико-химических процессов Трехфазные электрические цепи переменного тока
Трехфазные электрические цепи переменного тока Сравнение количеств теплоты при смешивании воды разной температуры. Лабораторная работа №1
Сравнение количеств теплоты при смешивании воды разной температуры. Лабораторная работа №1 Последовательное соединение проводников
Последовательное соединение проводников Урок 22. Повторение. Законы Ньютона. Решение задач
Урок 22. Повторение. Законы Ньютона. Решение задач Плотность вещества
Плотность вещества Атомная кузница кадров
Атомная кузница кадров Законы сохранения
Законы сохранения Квантовые технологии
Квантовые технологии Приводные муфты
Приводные муфты Радиоактивность. Открытие
Радиоактивность. Открытие Морской бой. Игра по физике
Морской бой. Игра по физике Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса Сверхпроводимость материалов
Сверхпроводимость материалов Гидростатическое давление
Гидростатическое давление Презентация на тему Экономия использования энергетических ресурсов на земле
Презентация на тему Экономия использования энергетических ресурсов на земле