Содержание
- 2. Молекулярно-кинетическая теория МКТ объясняет свойства макроскопических тел и тепловых процессов, на основе представлений о том, что
- 3. Основные положения мкт Вещество состоит из частиц Частицы непрерывно и хаотически движутся Частицы взаимодействуют друг с
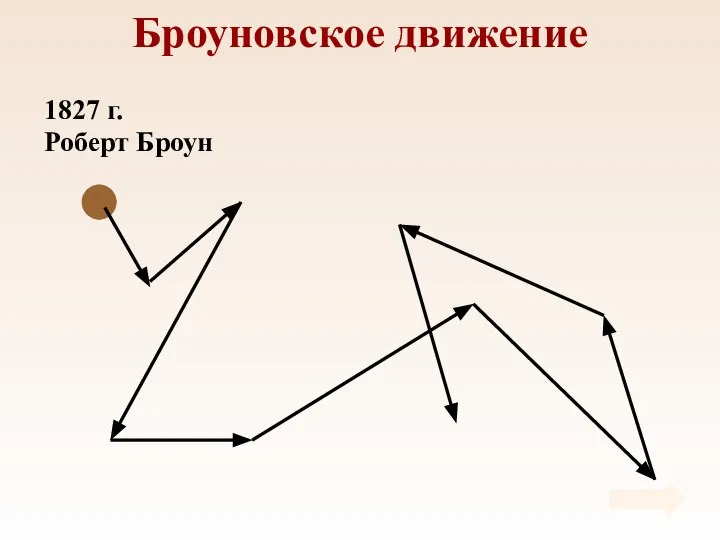
- 4. Броуновское движение 1827 г. Роберт Броун
- 5. Броуновское движение Причина броуновского движения состоит в том, что удары молекул жидкости о частицу не компенсируют
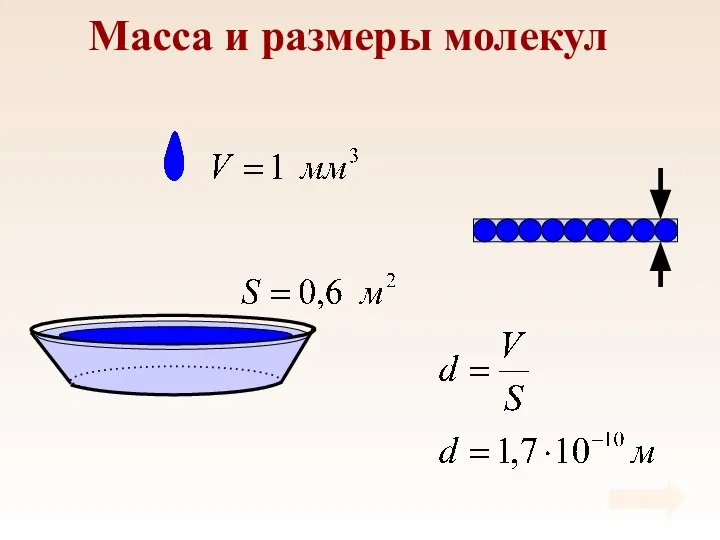
- 6. Масса и размеры молекул
- 7. Масса и размеры молекул Массы молекул в макроскопических масштабах чрезвычайно малы.
- 8. кофе этанол Масса и размеры молекул
- 9. Масса и размеры молекул Относительной молекулярной (или атомной) массой вещества (Мr) называют отношение массы молекулы (или
- 10. Количество вещества Количество вещества наиболее естественно было бы измерять числом молекул или атомов в теле. Но
- 11. Количество вещества В 1 моле любого вещества содержится одно и то же число атомов или молекул.
- 12. Количество вещества Молярной массой вещества называют массу вещества, взятого в количестве 1 моль. m0 - масса
- 13. Количество вещества m – масса вещества
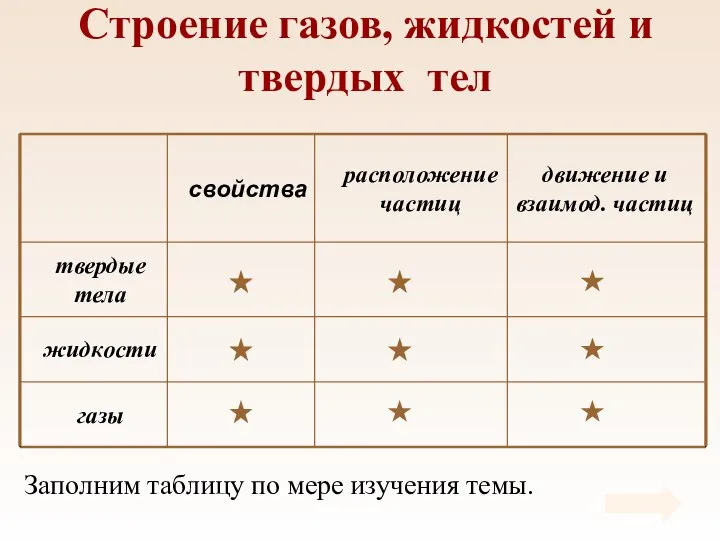
- 14. Таблица Свойства газов, жидкостей и твердых тел
- 15. Строение газов, жидкостей и твердых тел Заполним таблицу по мере изучения темы.
- 16. Свойства Твердые тела сохраняют объем и форму.
- 17. Свойства Жидкости сохраняют объем и принимают форму сосуда. Обладают текучестью.
- 18. Свойства Газы не имеют формы, занимают весь предоставленный объем.
- 19. Расположение частиц Частицы расположены в строгом порядке вплотную друг к другу. Кристаллическая решетка.
- 20. Расположение частиц Частицы расположены вплотную друг к другу, образуют только ближний порядок.
- 21. Расположение частиц Частицы расположены на значительных расстояниях (расстояния между частицами во много раз больше размеров самих
- 22. Движение и взаимодействие частиц Частицы совершают колебательные движения около положения равновесия Силы притяжения и отталкивания значительны
- 23. Движение и взаимодействие частиц Частицы совершают колебательные движения около положения равновесия, изредка совершая скачки на новое
- 24. Движение и взаимодействие частиц Частицы свободно перемещаются по всему объему, двигаясь поступательно Силы притяжения почти отсутствуют,
- 25. Идеальный газ Идеальный газ – это газ, в котором Частицы – материальные точки Частицы взаимодействуют только
- 26. Среднее значение квадрата скорости молекул Скорость – величина векторная, поэтому средняя скорость движения частиц в газе
- 27. Среднее значение квадрата скорости молекул
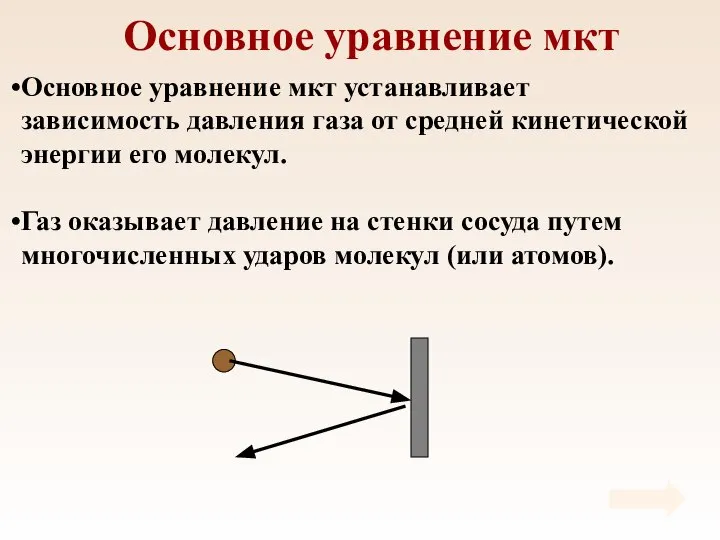
- 28. Основное уравнение мкт Основное уравнение мкт устанавливает зависимость давления газа от средней кинетической энергии его молекул.
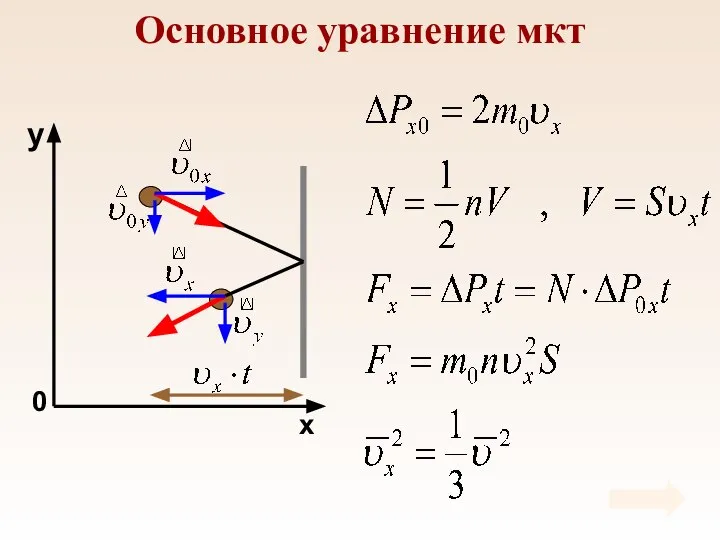
- 29. Основное уравнение мкт
- 30. Основное уравнение мкт
- 31. Температура и тепловое равновесие Макроскопические параметры (макропараметры) – величины, характеризующие состояние макроскопических тел без учета молекулярного
- 32. Температура и тепловое равновесие Любое макроскопическое тело или группа макроскопических тел при неизменных внешних условиях самопроизвольно
- 33. Температура и тепловое равновесие Термометр – прибор для измерения температуры тела. Термометр входит в состояние теплового
- 34. Температура и тепловое равновесие Основная деталь термометра – термометрическое тело, то есть тело, макропараметры которого изменяются
- 35. Температура и тепловое равновесие Изобретателем термометра является Галилео Галилей (ок. 1600 г.) Термометрическим телом в его
- 36. Температурные шкалы шкала Цельсия шкала Фаренгейта шкала Реомюра шкала Кельвина
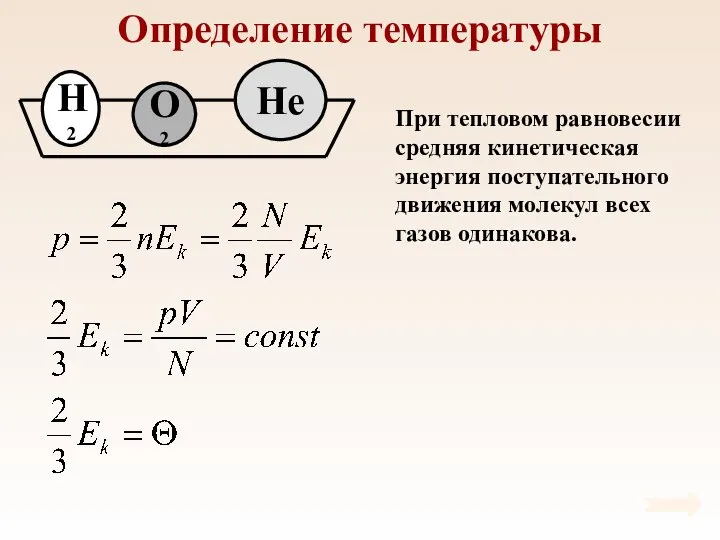
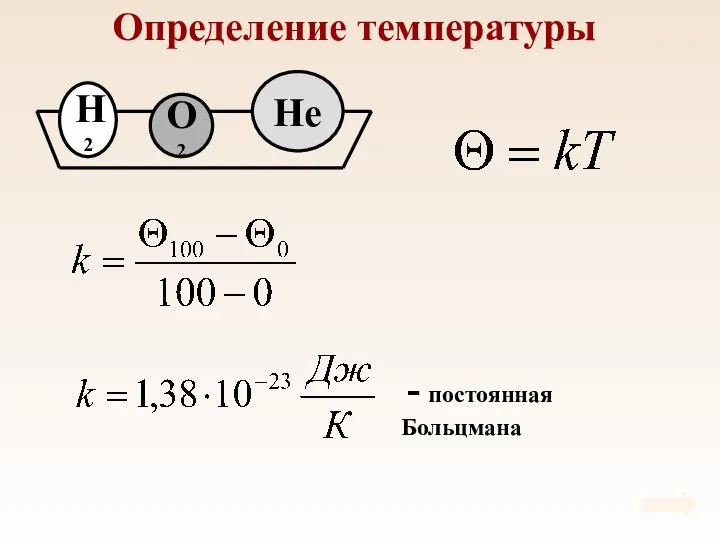
- 37. Определение температуры При тепловом равновесии средняя кинетическая энергия поступательного движения молекул всех газов одинакова.
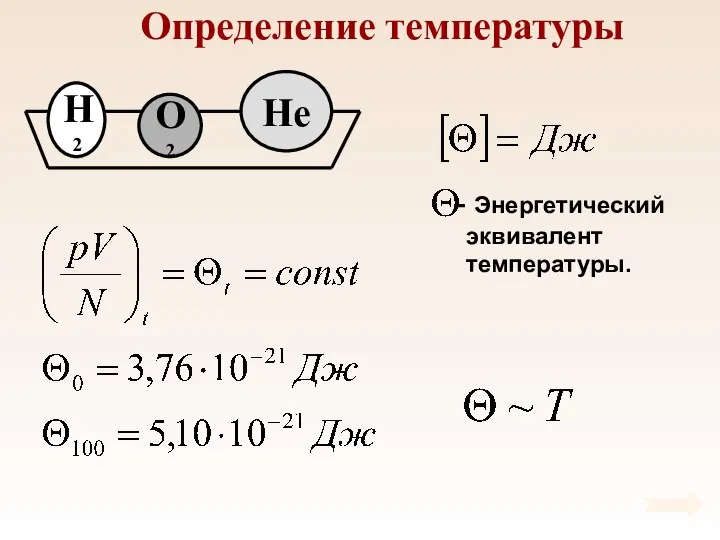
- 38. Определение температуры
- 39. Определение температуры
- 40. Температура – мера средней кинетической энергии молекул
- 41. Зависимость давления газа от температуры и концентрации молекул газа
- 42. Скорости молекул
- 43. Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона) - универсальная газовая постоянная
- 44. Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона) Если в ходе процесса масса газа остается неизменной,
- 45. Изопроцессы Изотермический процесс Изобарный процесс Изохорный процесс
- 46. Изотермический процесс Процесс, происходящий с газом неизменной массы при постоянной температуре называется изотермическим. Изотермический процесс описывается
- 47. Изобарный процесс Процесс, происходящий с газом неизменной массы при постоянном давлении называется изобарным. Изобарный процесс описывается
- 48. Изохорный процесс Процесс, происходящий с газом неизменной массы при постоянном объеме называется изохорным. Изохорный процесс описывается
- 50. Скачать презентацию






































 Презентация на тему Механическое движение
Презентация на тему Механическое движение  Презентация на тему Давление твёрдых тел
Презентация на тему Давление твёрдых тел 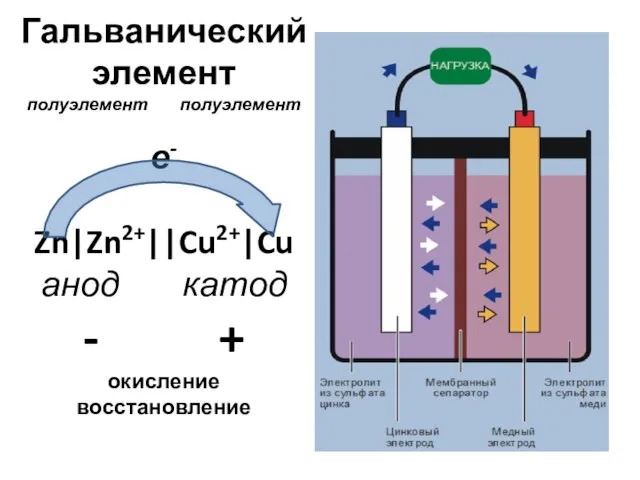 Гальванический элемент, полуэлемент, полуэлемент, е- Zn|Zn2+||Cu2+|Cu, анод, катод, - +, окисление, восстановление
Гальванический элемент, полуэлемент, полуэлемент, е- Zn|Zn2+||Cu2+|Cu, анод, катод, - +, окисление, восстановление Силы, действующие в магнитном поле: сила Ампера, сила Лоренца
Силы, действующие в магнитном поле: сила Ампера, сила Лоренца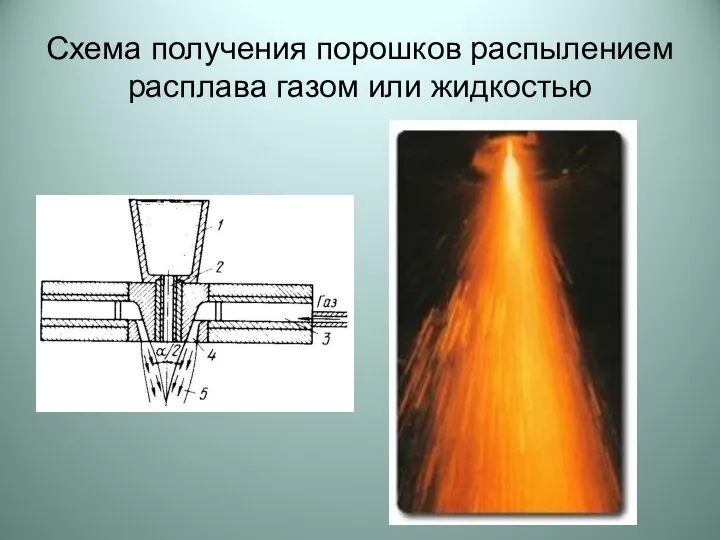 Схема получения порошков распылением расплава газом или жидкостью
Схема получения порошков распылением расплава газом или жидкостью Размышления в будущем времени
Размышления в будущем времени Теория движения военных колесных машин. Лекция 7
Теория движения военных колесных машин. Лекция 7 Энергия топлива. Удельная теплота сгорания топлива
Энергия топлива. Удельная теплота сгорания топлива Резонансы в электрических цепях
Резонансы в электрических цепях Строение атома. Каковы примерно размеры атома?
Строение атома. Каковы примерно размеры атома? Кривошипно-шатунный механизм
Кривошипно-шатунный механизм Задача о движении внешней нагрузки по битому льду в канале
Задача о движении внешней нагрузки по битому льду в канале Профильное обучение физике в процессе модернизации школьного образования
Профильное обучение физике в процессе модернизации школьного образования Л2 мех.оборуд
Л2 мех.оборуд Сила тяжести
Сила тяжести Кто хочет стать отличником?
Кто хочет стать отличником? Силы в природе
Силы в природе Механическая работа. Единицы работы
Механическая работа. Единицы работы Обобщающий урок-соревнование по теме Электрические явления
Обобщающий урок-соревнование по теме Электрические явления Ионизация воздуха
Ионизация воздуха Масс-спектрометрия
Масс-спектрометрия Теоретическая механика. Кинематика. Движение твердой среды
Теоретическая механика. Кинематика. Движение твердой среды Формулы для расчета рем передачи
Формулы для расчета рем передачи Атмосферное давление
Атмосферное давление Урок 22. Повторение. Законы Ньютона. Решение задач
Урок 22. Повторение. Законы Ньютона. Решение задач Назначение, устройство и работа сцепления автомобиля КамАЗ 5320 его привод и пневмогидроусилитель
Назначение, устройство и работа сцепления автомобиля КамАЗ 5320 его привод и пневмогидроусилитель Ремонт муфты сцепления
Ремонт муфты сцепления Законы отражения и преломления света
Законы отражения и преломления света