Содержание
Слайд 2Атомы отличаются не только фигурой, но расположением и порядком. Чувствами их нельзя познать; атом есть умопостигаемая форма, она зрима и
Атомы отличаются не только фигурой, но расположением и порядком. Чувствами их нельзя познать; атом есть умопостигаемая форма, она зрима и
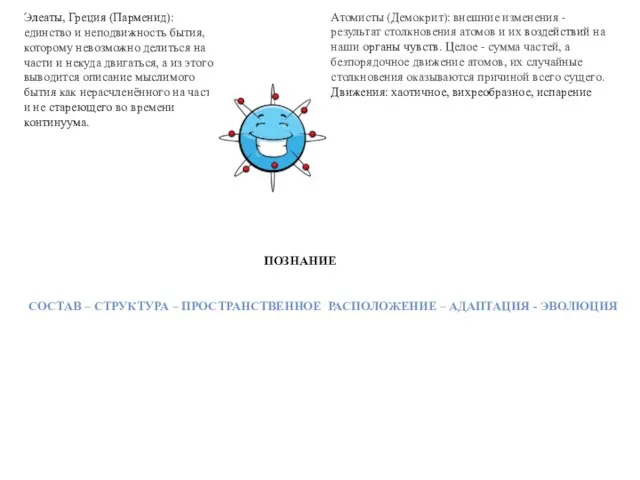
Элеаты, Греция (Парменид): единство и неподвижность бытия, которому невозможно делиться на части и некуда двигаться, а из этого выводится описание мыслимого бытия как нерасчленённого на части и не стареющего во времени континуума.
Атомисты (Демокрит): внешние изменения - результат столкновения атомов и их воздействий на наши органы чувств. Целое - сумма частей, а безпорядочное движение атомов, их случайные столкновения оказываются причиной всего сущего. Движения: хаотичное, вихреобразное, испарение
ПОЗНАНИЕ
СОСТАВ – СТРУКТУРА – ПРОСТРАНСТВЕННОЕ РАСПОЛОЖЕНИЕ – АДАПТАЦИЯ - ЭВОЛЮЦИЯ
Слайд 3Древнегреческий натурфилософ Анаксагор, живший примерно с 500-го по 428-ой годы до нашей
Древнегреческий натурфилософ Анаксагор, живший примерно с 500-го по 428-ой годы до нашей

Пу́динговая модель а́тома предложена в 1904 году Джозефом Джоном Томсоном. После открытия им в 1897 году электрона, Томсон предположил, что отрицательно заряженные «корпускулы» входят в состав атома и предложил модель атома, в котором в облаке положительного заряда, равного размеру атома, содержатся маленькие, отрицательно заряженные «корпускулы», суммарный электрический заряд которых равен заряду положительно заряженного облака, обеспечивая электронейтральность атомов. «Корпускулы» в этой модели распределены внутри положительно заряженного облака с одинаковой по объёму плотностью заряда, подобно изюминкам в тесте пудинга.
Ленард разработал в 1903 г. свою динамидическую модель атома, согласно которой атом был, в основном, «пустым», и в этом атоме имелись одинаковые нейтральные частицы ("динамиды") маленького объёма, состоящие из электрона и крепко связанной с ним положительно заряжённой частицы. Этой моделью Ленард впервые опроверг господствующее в то время представление об атоме как о массивном однородном объекте.
Моде́ль Бо́ра —предложена в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввёл допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую.
11.1 Вокруг одного дерева
 Часы. Приборы и методы измерения (по видам измерений)
Часы. Приборы и методы измерения (по видам измерений) Излучение и спектры
Излучение и спектры Действие магнитного поля на проводник с током. Электрический двигатель
Действие магнитного поля на проводник с током. Электрический двигатель Шкала звуковых частот
Шкала звуковых частот Презентация на тему Создание вечного двигателя
Презентация на тему Создание вечного двигателя  1.Силы, действующие в жикости. Режимы движения
1.Силы, действующие в жикости. Режимы движения Цена деления прибора
Цена деления прибора Презентация на тему Мощность
Презентация на тему Мощность  Лекция №14. Интегралы, зависящие от параметров
Лекция №14. Интегралы, зависящие от параметров Презентация на тему Инерция (7 класс)
Презентация на тему Инерция (7 класс)  Решение задач по теме Соединение проводников
Решение задач по теме Соединение проводников Виды соединения проводников. Работа тока
Виды соединения проводников. Работа тока Широкополосный генератор подавления радиосигналов
Широкополосный генератор подавления радиосигналов Импульс тела. Закон сохранения импульса тела
Импульс тела. Закон сохранения импульса тела Ремонт роликового подшипника
Ремонт роликового подшипника Давление. Обобщающий урок
Давление. Обобщающий урок Введение и Первоначальные сведения о строении вещества
Введение и Первоначальные сведения о строении вещества Построение эвольвентного профиля зуба
Построение эвольвентного профиля зуба Ускорители заряженных частиц
Ускорители заряженных частиц Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Презентация на тему Конкурс эрудитов
Презентация на тему Конкурс эрудитов  Prezentatsia_7
Prezentatsia_7 Презентация на тему Шкала электромагнитных волн
Презентация на тему Шкала электромагнитных волн  Принципы радиосвязи
Принципы радиосвязи Вихрь (ротор) векторного поля
Вихрь (ротор) векторного поля Оптическая сила линзы
Оптическая сила линзы Презентация на тему Термоядерные реакции
Презентация на тему Термоядерные реакции  Тяговый расчет трактора
Тяговый расчет трактора