Содержание
- 2. Специфические особенности органических реакций 1. Органические реакции идут медленно, часто требуют жёстких условий (температура, давление, участие
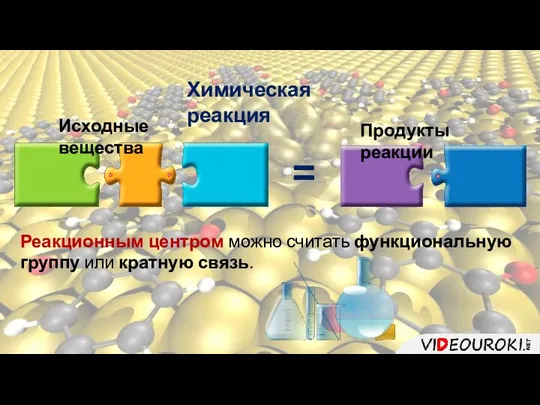
- 3. Химическая реакция Исходные вещества = Продукты реакции Реакционным центром можно считать функциональную группу или кратную связь.
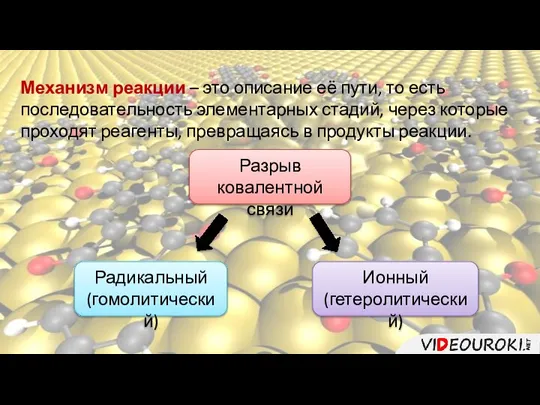
- 4. Механизм реакции – это описание её пути, то есть последовательность элементарных стадий, через которые проходят реагенты,
- 5. Радикальный (гомолитический) разрыв ковалентной связи (гомолиз) – от греческого homos – «равный», «одинаковый» и lysis –
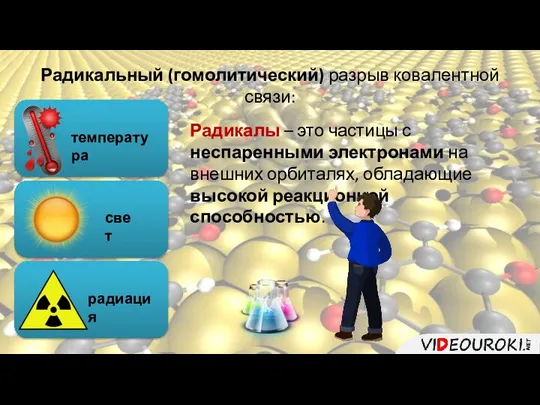
- 6. Радикальный (гомолитический) разрыв ковалентной связи: температура свет радиация Радикалы – это частицы с неспаренными электронами на
- 7. Ионный, или гетеролитический разрыв ковалентной связи (гетерозис) от греческого heteros – «другой», «иной» и lysis –
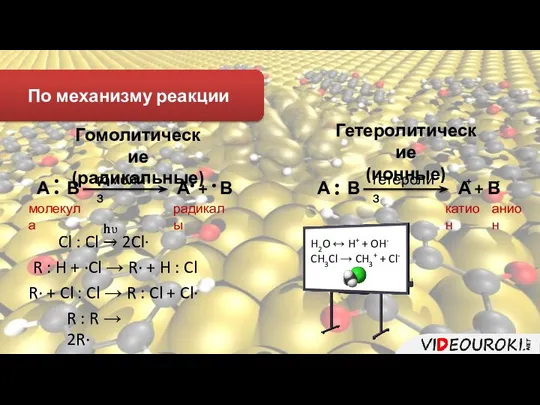
- 8. По механизму реакции Гомолитические (радикальные) Гетеролитические (ионные) А В • • А • + В •
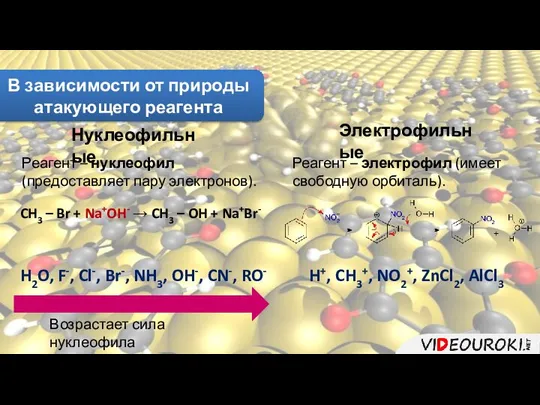
- 9. В зависимости от природы атакующего реагента Нуклеофильные Электрофильные Реагент – нуклеофил (предоставляет пару электронов). CH3 –
- 10. По направлению и конечному продукту реакции замещения; реакции присоединения; реакции отщепления (элиминирования); реакции окисления и восстановления.
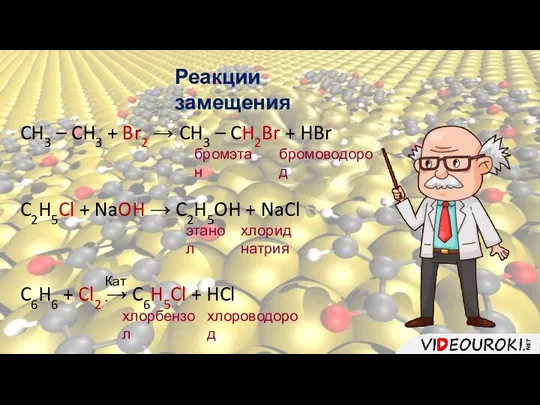
- 11. Реакции замещения CH3 – CH3 + Br2 → CH3 – CH2Br + HBr бромэтан бромоводород C2H5Cl
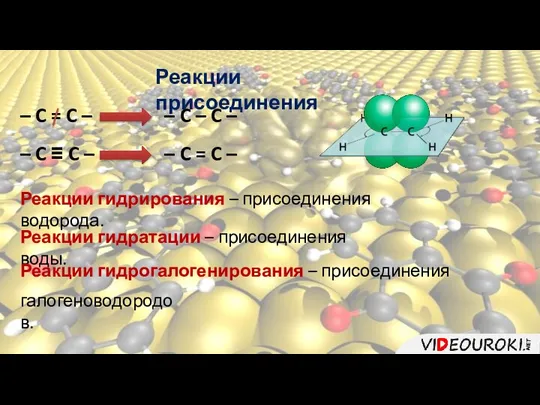
- 12. Реакции присоединения – C = C – – C – C – – C ≡ C
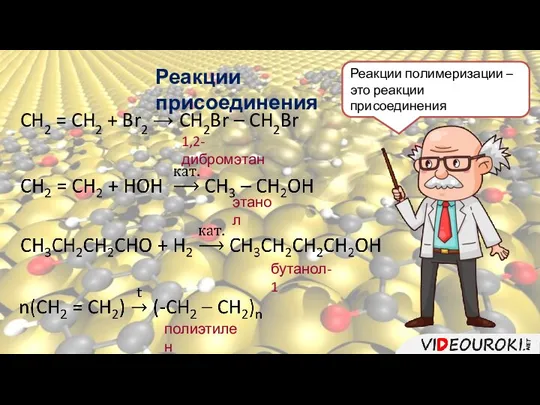
- 13. Реакции присоединения CH2 = CH2 + Br2 → CH2Br – CH2Br 1,2-дибромэтан этанол бутанол-1 полиэтилен Реакции
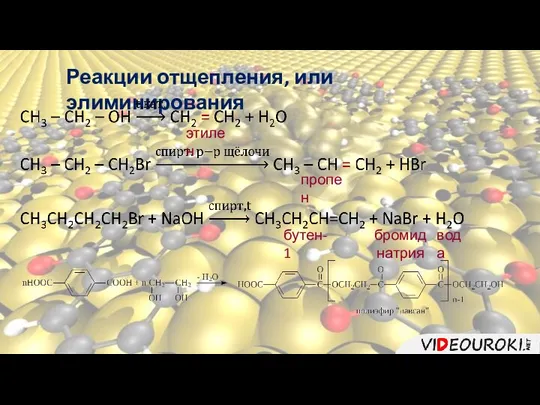
- 14. Реакции отщепления, или элиминирования К реакциям отщепления, или элиминирования относятся реакции, в ходе которых происходит отщепление
- 15. Реакции отщепления, или элиминирования этилен пропен бутен-1 бромид натрия вода
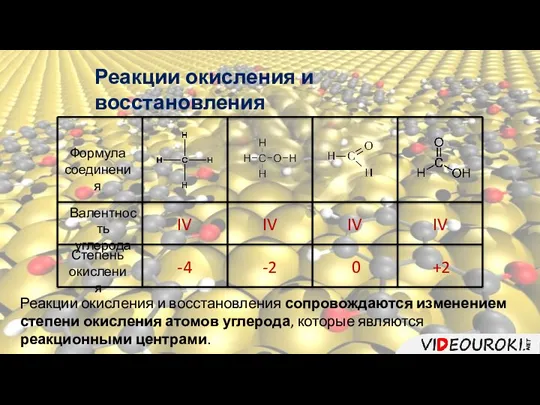
- 16. Реакции окисления и восстановления Формула соединения Валентность углерода Степень окисления IV IV IV IV -4 -2
- 18. Скачать презентацию





 Обмен липидов
Обмен липидов Ковалентная связь между одинаковыми атомами неметаллов
Ковалентная связь между одинаковыми атомами неметаллов Классификация органических соединений
Классификация органических соединений Concise asymmetric total synthesis of lycopodine
Concise asymmetric total synthesis of lycopodine ЛКМ на основе кремнийорганических соединений
ЛКМ на основе кремнийорганических соединений Строение бензола
Строение бензола Строение электронных оболочек атомов. 8 класс
Строение электронных оболочек атомов. 8 класс Кислотно-основные взаимодействия
Кислотно-основные взаимодействия Презентация на тему Типы химических реакций (8 класс)
Презентация на тему Типы химических реакций (8 класс)  Изомерия. Виды изомерии
Изомерия. Виды изомерии Реакции ионного обмена
Реакции ионного обмена Презентация по химии на тему _Высокомолекулярные Соединения_ (1)
Презентация по химии на тему _Высокомолекулярные Соединения_ (1) Пуриновые основания
Пуриновые основания Аналитическая химия. Введение
Аналитическая химия. Введение Презентация на тему Роль йода в организме
Презентация на тему Роль йода в организме  Хлор
Хлор Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини Агрегатные состояния веществ
Агрегатные состояния веществ Металлы 1 А - группы. Щелочные металлы
Металлы 1 А - группы. Щелочные металлы Ароматические углеводороды
Ароматические углеводороды Амфотерные гидроксиды
Амфотерные гидроксиды География. Уральские самоцветы
География. Уральские самоцветы Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс Карбонаты (3)
Карбонаты (3) Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода)
Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода) Команда Оптимисты
Команда Оптимисты Скорость химической реакции
Скорость химической реакции От простых правил к сложным структурам. Метод валентных связей. Принцип VSEPR
От простых правил к сложным структурам. Метод валентных связей. Принцип VSEPR