Содержание
- 2. Оборотні та необоротні реакції Реакції, які за певних умов відбуваються переважно тільки в одному напрямку, є
- 3. Принцип зміщення хімічної рівноваги Ле Шательє: якщо на систему, яка знаходиться в хімічній рівновазі, вчинити зовнішній
- 4. Основи – це складні речовини, в яких йони металів з'єднані з одною чи декільками гідроксид-йонами. Повторення
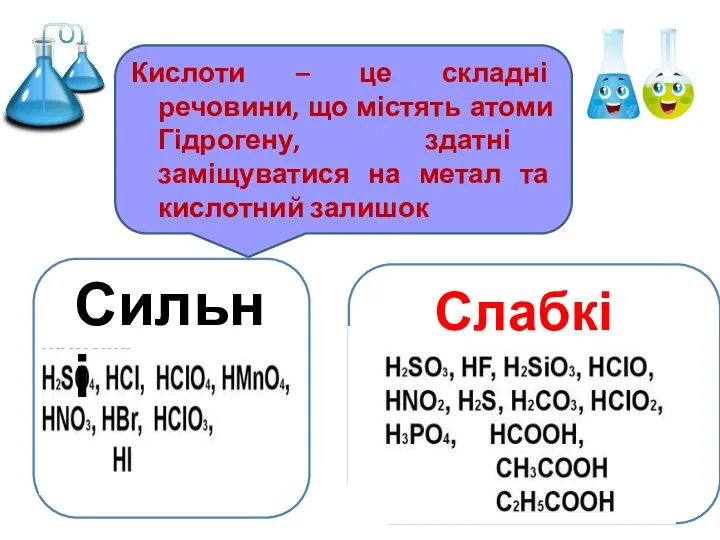
- 5. Кислоти – це складні речовини, що містять атоми Гідрогену, здатні заміщуватися на метал та кислотний залишок
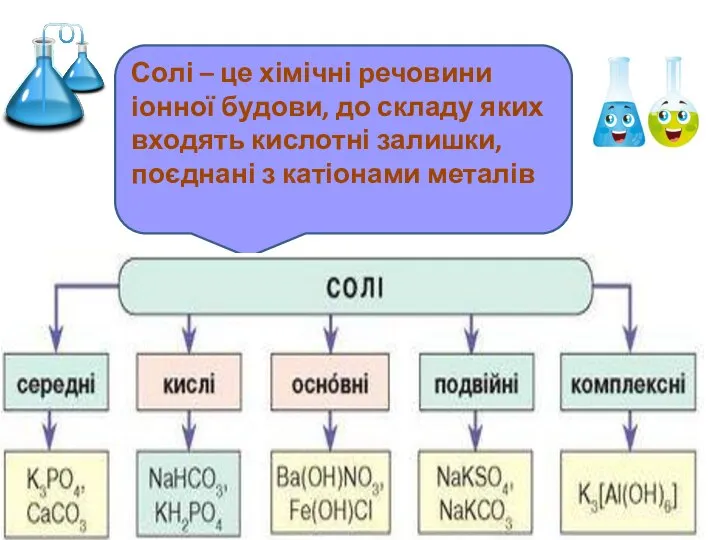
- 6. Солі – це хімічні речовини іонної будови, до складу яких входять кислотні залишки, поєднані з катіонами
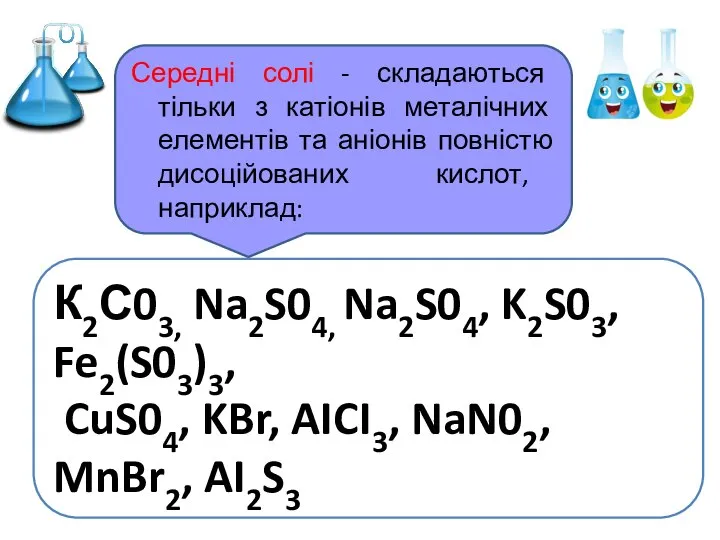
- 7. Середні солі - складаються тільки з катіонів металічних елементів та аніонів повністю дисоційованих кислот, наприклад: К2С03,
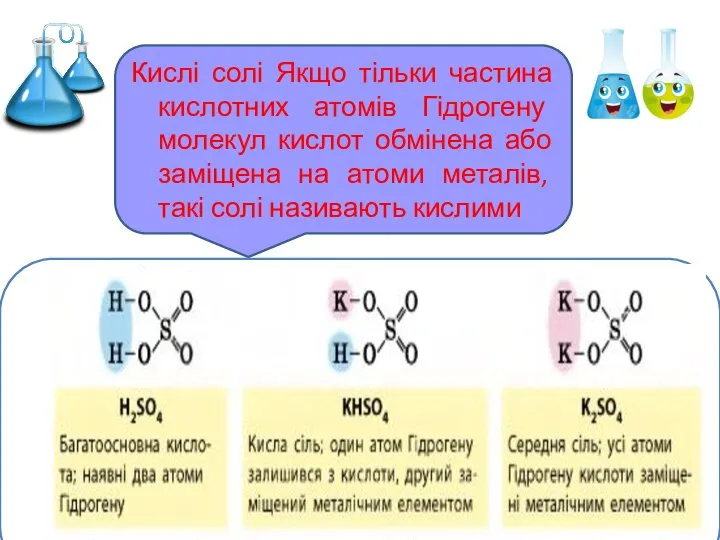
- 8. Кислі солі Якщо тільки частина кислотних атомів Гідрогену молекул кислот обмінена або заміщена на атоми металів,
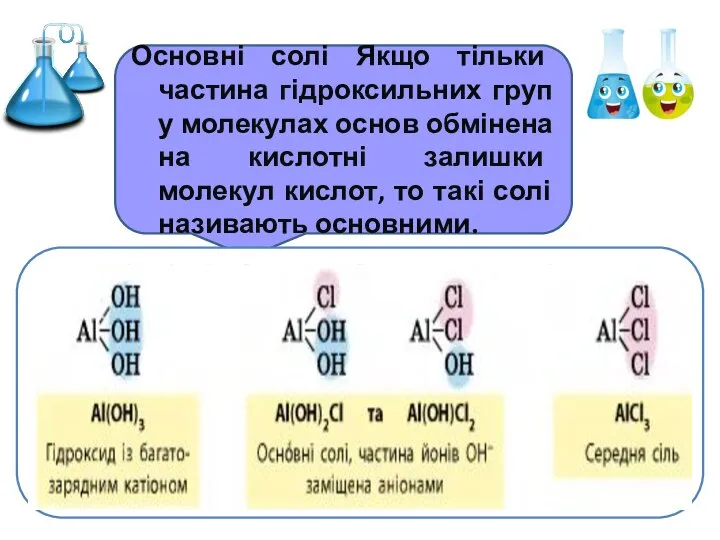
- 9. Основні солі Якщо тільки частина гідроксильних груп у молекулах основ обмінена на кислотні залишки молекул кислот,
- 10. Гідроліз солей – реакція обміну між сіллю і водою.
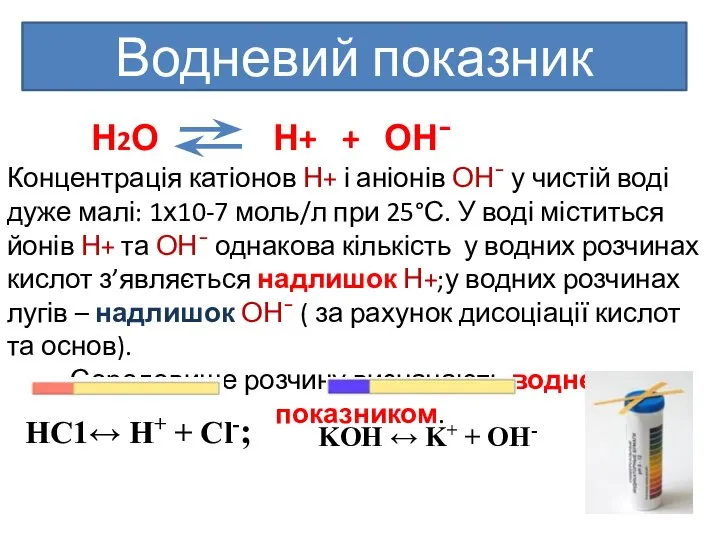
- 11. Водневий показник Н2О Н+ + ОН¯ Концентрація катіонов Н+ і аніонів ОН¯ у чистій воді дуже
- 13. Сіль утворена сильною основою та сильною кислотою Сіль утворена сильною основою та слабкою кислотою Сіль утворена
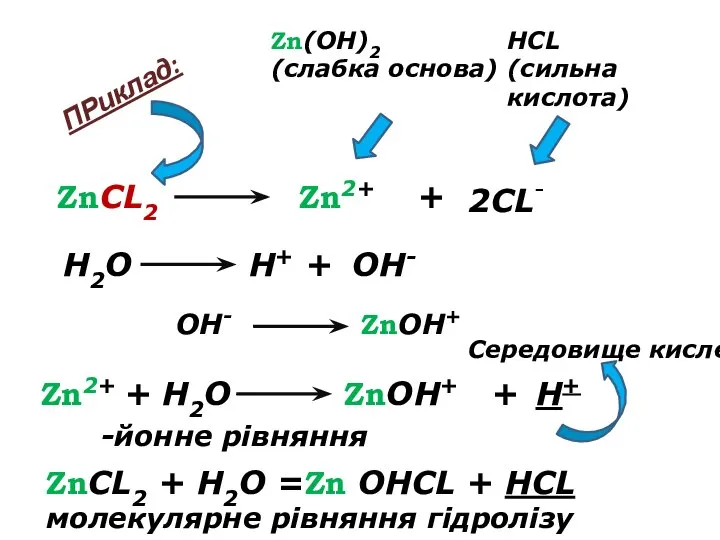
- 14. ZnCL2 Zn2+ + 2CL- Zn(OH)2 (слабка основа) HCL (сильна кислота) Zn2+ + H2O H+ OH- ZnOH+
- 15. Середовище визначає сильніший компонент (кислота). Розчин солі має надлишок іонів Н+ - кислотне середовище (рН Гідроліз
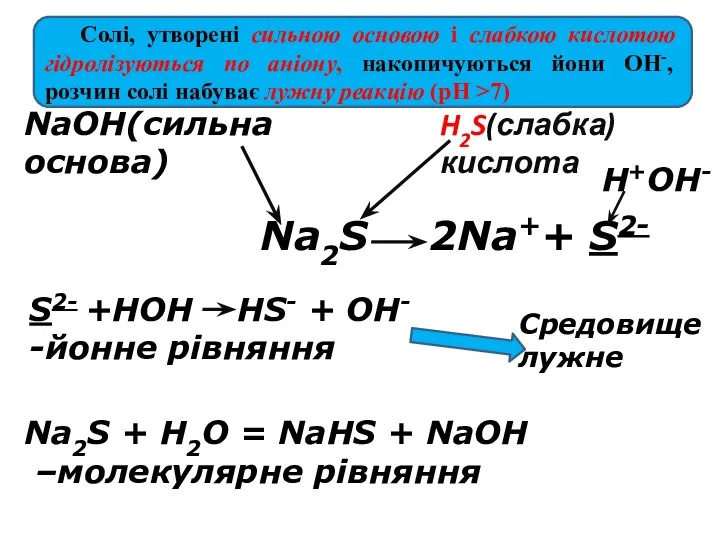
- 16. 2Na++ S2- NaOH(сильна основа) H2S(слабка) кислота S2- +HOH HS- + OH- -йонне рівняння Na2S + H2O
- 17. Середовище визначає сильніший компонент (основа). Розчин солі має надлишок іонів ОН- - лужне середовище (рН >7)
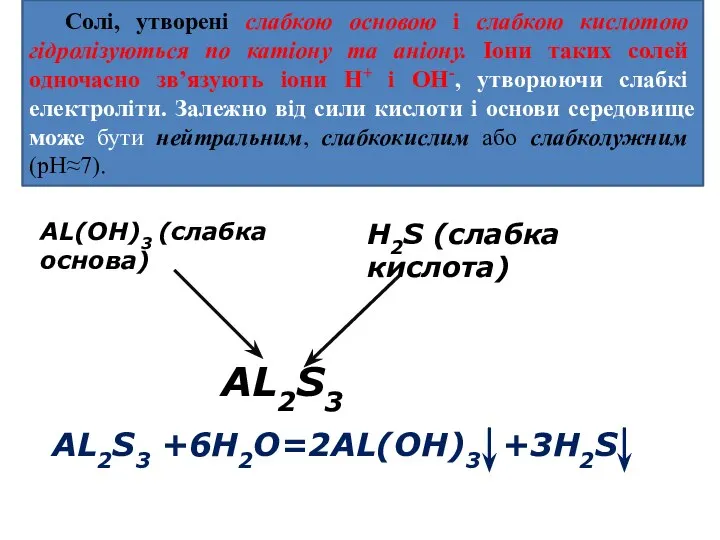
- 18. Солі, утворені слабкою основою і слабкою кислотою гідролізуються по катіону та аніону. Іони таких солей одночасно
- 19. Солі, утворені сильною основою і сильною кислотою не гідролізуються і реакцію середовища не змінюють (рН=7), тому
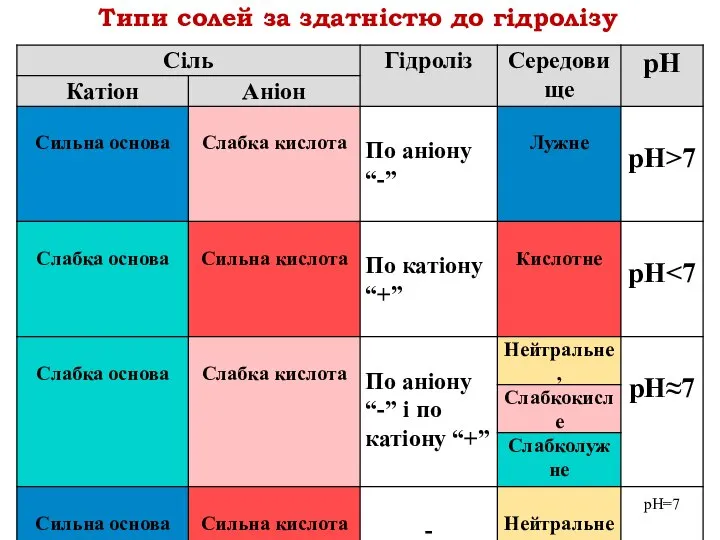
- 20. Типи солей за здатністю до гідролізу
- 21. Характер середовища водного розчину солі залежить від сили відповідних кислоти та основи
- 22. Із переліку речовин випишіть окремо формули солей, які: а) піддаються оборотному гідролізу; б) піддаються необоротному гідролізу;
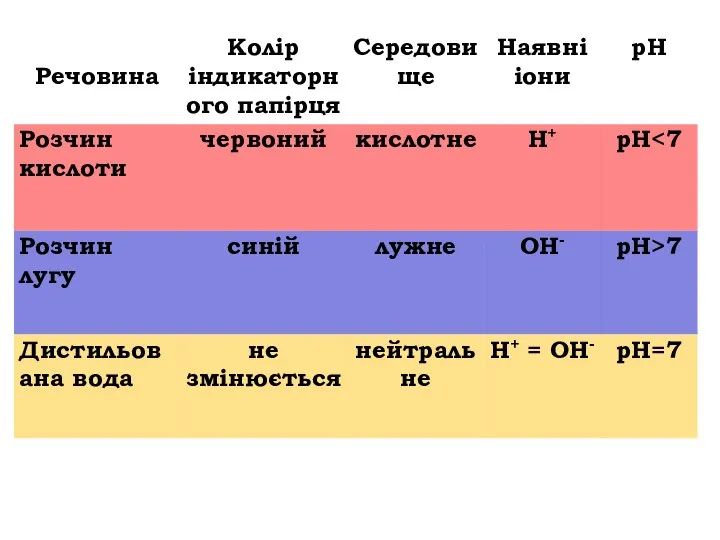
- 23. ЛАБОРАТОРНИЙ ДОСЛІД № 1 Визначення pH середовища водних розчинів солей за допомогою індикаторів Обладнання: штатив із
- 24. 1. Забарвлення універсального індикатора у водному розчині натрій карбонату 2. Забарвлення універсального індикатора у водному розчині
- 25. 1. Польові шпати, зокрема ортоклаз (KAlSi3O8), - найпоширеніші породотвірні мінерали, масова частка яких у земній корі
- 26. Якщо вирощувати гортензію на ділянці, де рівень pH ґрунту становить 6,0-6,2, то на рослині розцвітуть рожеві
- 27. Домашнє завдання Вивчити п.12, №1 с.68
- 29. Скачать презентацию















 Алканы. Строение. Изомерия и номенклатура
Алканы. Строение. Изомерия и номенклатура Транс-жиры
Транс-жиры Водород, его общая характеристика, нахождение в природе и его свойства
Водород, его общая характеристика, нахождение в природе и его свойства Порох: из грязи в князи
Порох: из грязи в князи Структура периодической системы химических элементов
Структура периодической системы химических элементов Исследовательская работа по химии на тему: Интегративные проблемные ситуации
Исследовательская работа по химии на тему: Интегративные проблемные ситуации Строение вещества. Химическая связь
Строение вещества. Химическая связь Материаловедение. Полимерные материалы
Материаловедение. Полимерные материалы Основания
Основания Ионные уравнения. Кислоты, их классификация. 8 класс
Ионные уравнения. Кислоты, их классификация. 8 класс Химическая связь
Химическая связь Производственно-торговая компания ООО СОЖ Синтез-Набережные Челны
Производственно-торговая компания ООО СОЖ Синтез-Набережные Челны Химическая география чудес
Химическая география чудес Презентация на тему Моющие и чистящие средства
Презентация на тему Моющие и чистящие средства  691614
691614 Соли. Химические свойства
Соли. Химические свойства Применение алканов
Применение алканов Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Презентация на тему Основные положения МКТ
Презентация на тему Основные положения МКТ  Растворы. Процесс растворения (1)
Растворы. Процесс растворения (1) Процессы минералообразования
Процессы минералообразования Электромагнитное облучение. Радиоактивное загрязнение
Электромагнитное облучение. Радиоактивное загрязнение Предмет химии. Вещества
Предмет химии. Вещества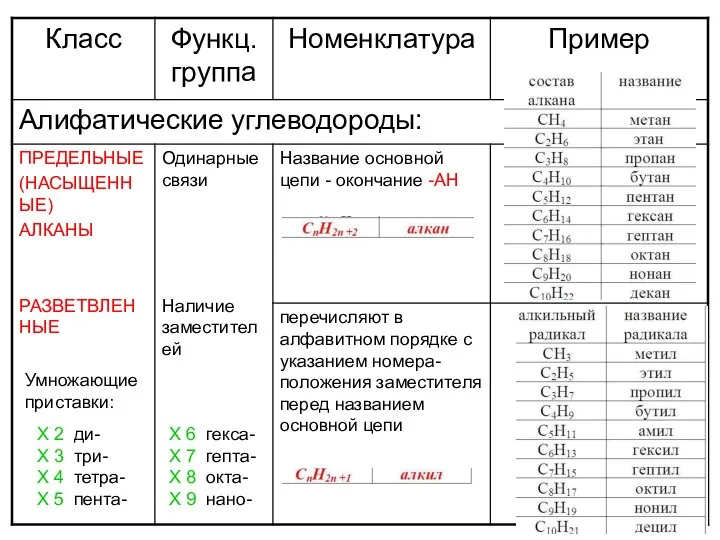 Алифатические углеводороды
Алифатические углеводороды Химия углеводов
Химия углеводов Основы молекулярно-кинетической теории
Основы молекулярно-кинетической теории Диссоциация кислот
Диссоциация кислот Соли. Классификация солей
Соли. Классификация солей