уксусной, примерно в Х веке. Честь ее открытия приписывается персидскому химику Абубекеру аль Рези. Но это установлено не совсем точно. По крайней мере серную кислоту человечество знает около 1000 лет.
ГЛАУБЕР, ИОГАНН РУДОЛЬФ (1604–1670), немецкий химик. Родился в Карлштадте в Нижней Франконии (Германия), в семье бедного цирюльника. Рано потерял отца. Не имея средств на обучение в университете, молодой Иоганн до всего доходил сам – с помощью книг и бесед с учеными людьми. Особенно его привлекали превращения одних веществ в другие.
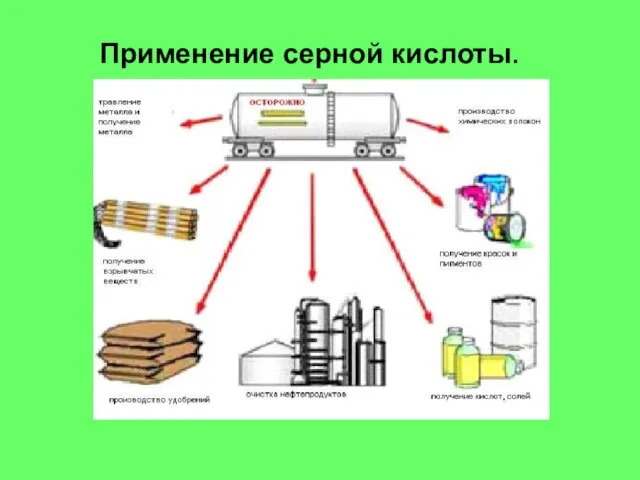
Концентрированную серную кислоту он получил прокаливанием «зеленого витриола» (железного купороса FeSO4 ·7H2O), квасцов (сульфата калия-алюминия KAl(SO4)2·12H2O) или «белого витриола» (цинкового купороса ZnSO4·7H2O); отсюда – другое старинное название серной кислоты – купоросное масло.












 Природные источники углеводородов
Природные источники углеводородов Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Скорость протекания химических реакций
Скорость протекания химических реакций Химия. Решение задач
Химия. Решение задач Карбонат калия K2CO3
Карбонат калия K2CO3 Пример выполнения проверочной работы по теме углеводороды
Пример выполнения проверочной работы по теме углеводороды Количество вещества. Моль
Количество вещества. Моль Тренажёр: знаки химических элементов
Тренажёр: знаки химических элементов Гликоген. Синтез гликогена
Гликоген. Синтез гликогена Применение алканов
Применение алканов Химия – наука о веществах. Вычисления по химическим формулам. Тема 1
Химия – наука о веществах. Вычисления по химическим формулам. Тема 1 Простые и сложные вещества
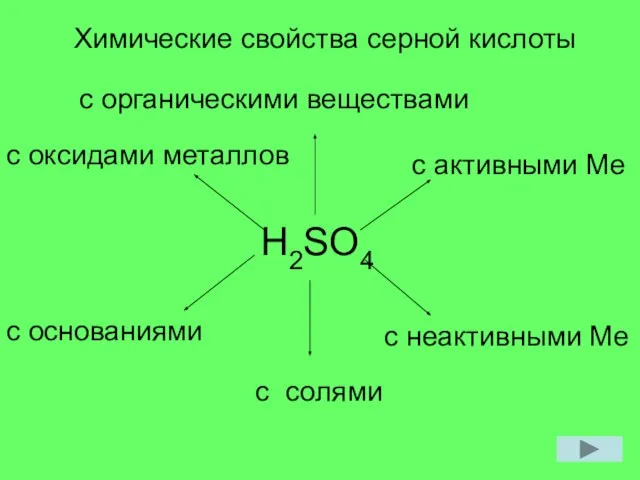
Простые и сложные вещества Химические свойства кислот
Химические свойства кислот Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений Классы неорганических соединений
Классы неорганических соединений Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Презентация на тему Амины
Презентация на тему Амины  НХ 3 Термохимия
НХ 3 Термохимия Дисперсные системы
Дисперсные системы Презентация на тему Сера
Презентация на тему Сера  Катаболизм пуриновых нуклеотидов
Катаболизм пуриновых нуклеотидов Готовимся к ЕГЭ по органической химии Ароматические углеводороды
Готовимся к ЕГЭ по органической химии Ароматические углеводороды Электрические явления на поверхности раздела фаз. Лекция 8
Электрические явления на поверхности раздела фаз. Лекция 8 Щелочные металлы
Щелочные металлы Общая характеристика неметаллов подгруппы кислород
Общая характеристика неметаллов подгруппы кислород Презентация на тему Вода – растворитель
Презентация на тему Вода – растворитель  Химия функциональных материалов. Адсорбция
Химия функциональных материалов. Адсорбция Основные виды сырья для промышленности органического и нефтехимического синтеза
Основные виды сырья для промышленности органического и нефтехимического синтеза