Содержание
- 2. С О Д Е Р Ж А Н И Е Положение В периодической системе НАХОЖДЕНИЕ В
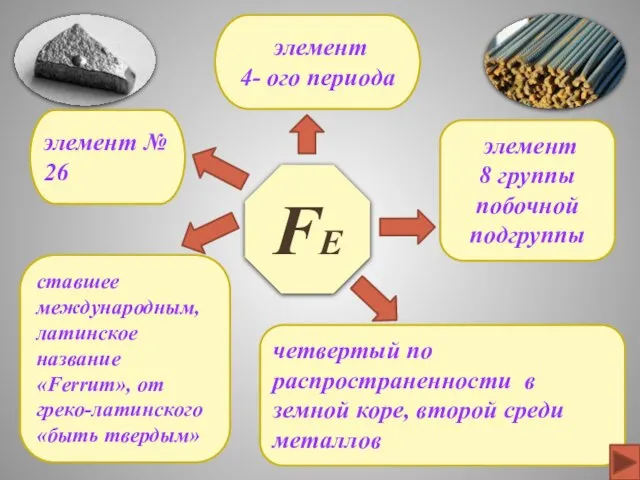
- 3. Fе элемент № 26 элемент 4- ого периода четвертый по распространенности в земной коре, второй среди
- 4. Электронное строение атома железа Fe +26 2е 8е 14е 2е 1S22S22P63S23P63D64S2 возможные степени окисления +2 и
- 5. Нахождение в природе В земной коре на долю железа приходится около 4,1% массы земной коры (4-е
- 6. Первое металлическое железо, попавшее в руки человека, имело, явно, метеоритное происхождение. Руды железа широко распространены и
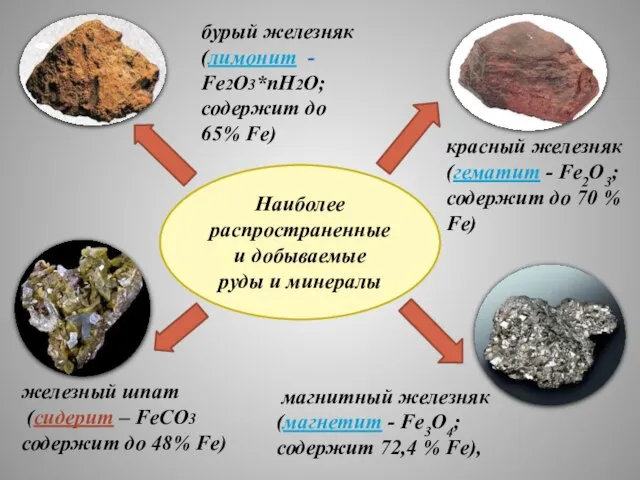
- 7. Наиболее распространенные и добываемые руды и минералы магнитный железняк (магнетит - Fe3O4; содержит 72,4 % Fe),
- 8. Люди впервые овладели железом в 4-3 тысячелетиях до н. э., подбирая упавшие с неба камни —
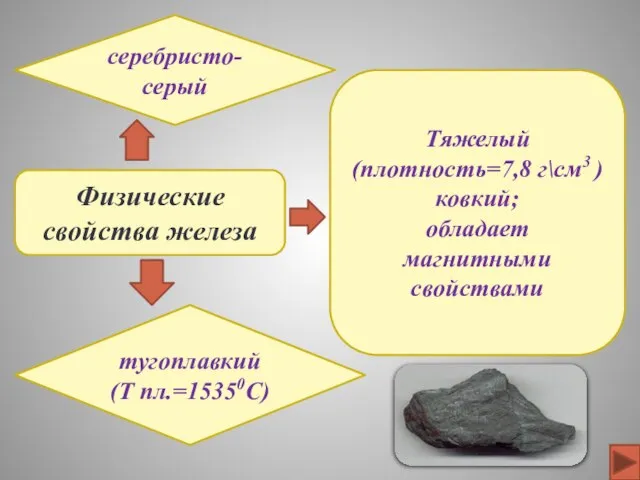
- 9. Физические свойства железа серебристо-серый тугоплавкий (Т пл.=15350C) Тяжелый (плотность=7,8 г\см3 ) ковкий; обладает магнитными свойствами
- 10. Химические свойства Реакции с простыми веществами Железо сгорает в чистом кислороде при нагревании:4Fe +3O2=2Fe2O3 Реагирует с
- 11. Химические свойства Реакции со сложными веществами С кислотами: А) с соляной кислотой 2HCL + Fe =
- 12. Железо разрушается под действием окружающей среды, т.е. подвергается коррозии – «ржавлению». При этом на поверхности образуется
- 13. СОЕДИНЕНИЯ ЖЕЛЕЗА
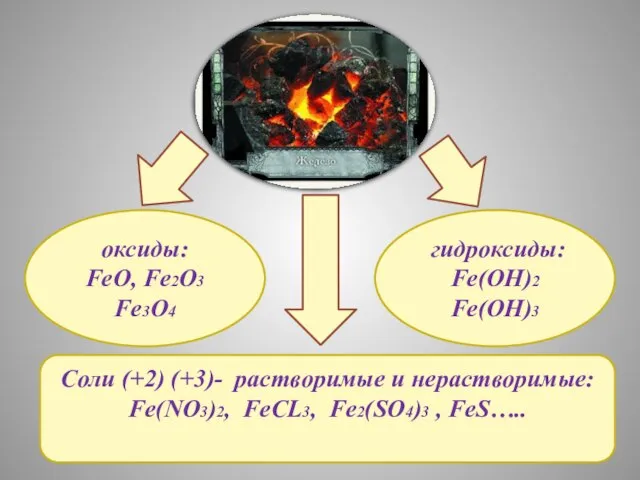
- 14. Соли (+2) (+3)- растворимые и нерастворимые: Fe(NO3)2, FeCL3, Fe2(SO4)3 , FeS….. оксиды: FeO, Fe2O3 Fe3O4 гидроксиды:
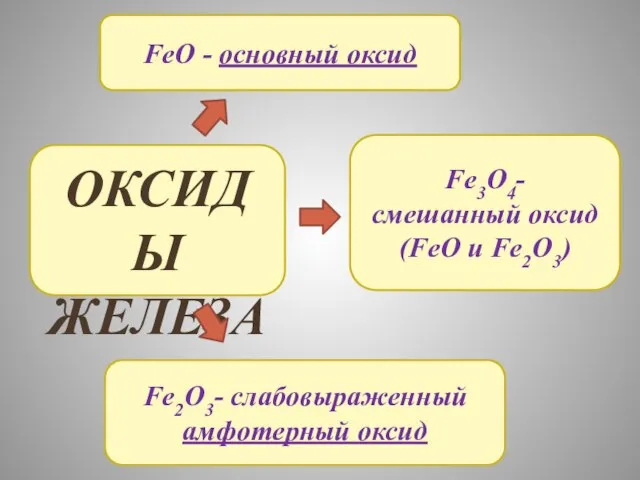
- 15. ОКСИДЫ ЖЕЛЕЗА FeO - основный оксид Fe2O3- слабовыраженный амфотерный оксид Fe3O4- смешанный оксид (FeO и Fe2O3)
- 16. Химические свойства FeO с кислотами: FeO + 2HCL=FeCL2 + H2O 2) с более активными металлами: 3FeO
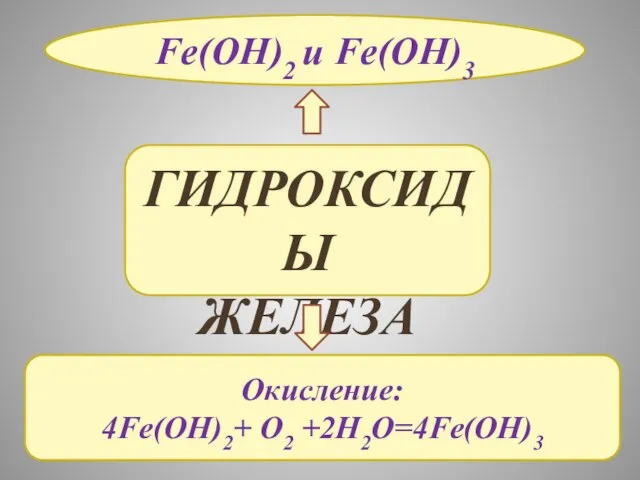
- 17. ГИДРОКСИДЫ ЖЕЛЕЗА Fe(OH)2 и Fe(OH)3 Окисление: 4Fe(OH)2+ O2 +2H2O=4Fe(OH)3
- 18. Fe(OH)2 и Fe(OH)3 Fe(OH)3 реагирует с конц. щелочами Fe(OH)3 + 3NaOH=Na3(Fe(OH)6) 1)Реагируют с кислотами: Fe(OH)2 +
- 19. Соли железа Реагируют с щелочами: FeCL2 + 2NaOH= Fe(OH)2 + 2 NaCL Реагируют с более активными
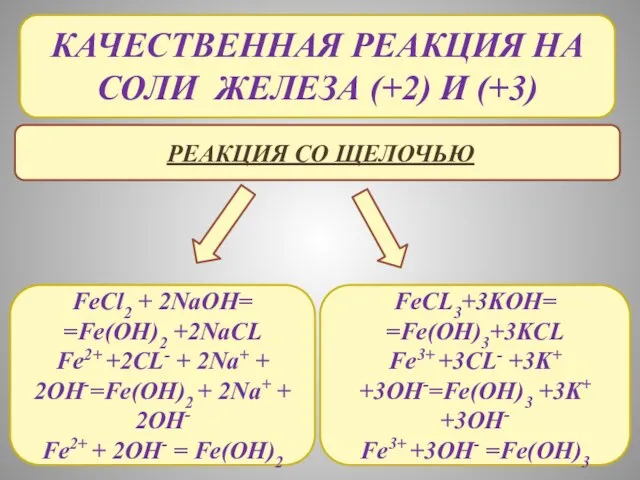
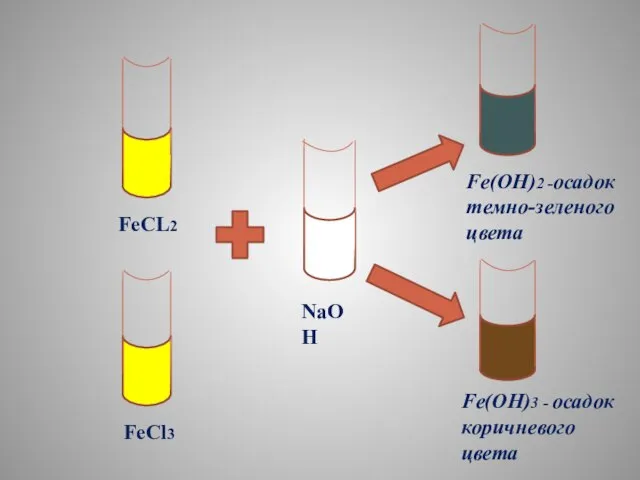
- 20. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА Соли железа (+2) и (+3) Реакция со щелочью FeCl2 + 2NaOH= =Fe(OH)2 +2NaCL
- 21. FeCL2 FeCl3 NaOH Fe(OH)2 -осадок темно-зеленого цвета Fe(OH)3 - осадок коричневого цвета
- 22. Железо в организме Железо в виде ионов присутствует в организмах всех растений и животных и, конечно
- 23. Основная роль железа в организме – участие в «рождении» красных (эритроцитов) и белых (лимфоцитов) кровяных клеток.
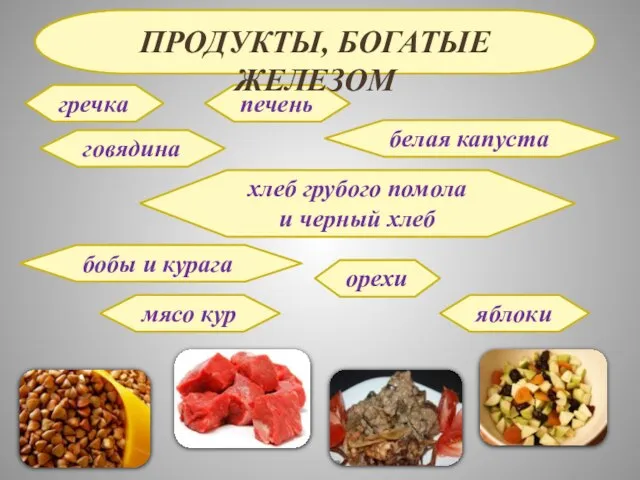
- 24. гречка говядина печень белая капуста хлеб грубого помола и черный хлеб бобы и курага орехи мясо
- 25. При анемии, для приготовления пищи, рекомендуется использовать чугунную посуду. Как показали эксперименты, приготовление и кипячение соуса
- 26. П Р И М Е Н Е Н И Е Ж Е Л Е З А
- 27. Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении сердечников электромагнитов, как катализатор химических процессов,
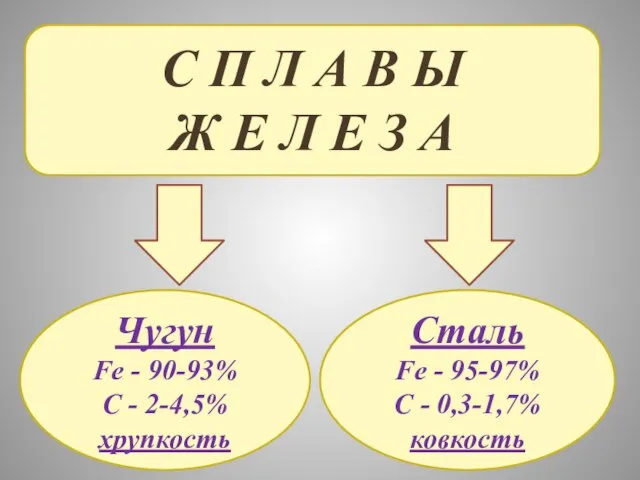
- 28. С П Л А В Ы Ж Е Л Е З А Чугун Fe - 90-93%
- 29. Железо сегодня Гидроэлектро- станции и опоры линий электропередач Трубопроводы для воды, нефти и газа Автомобили ,
- 30. Ф О Л Ь К Л О Р о Ж Е Л Е З Е
- 31. «Ржавое железо не блестит» (никчемность и бездеятельность человека портит!!!) Очень часто употребляемая пословица: «Куй железо, пока
- 32. Есть у железа страшный враг – «ржавчина». К чему она приводит, как с ней бороться и
- 33. А Т Е П Е Р Ь К Р О С С В О Р Д
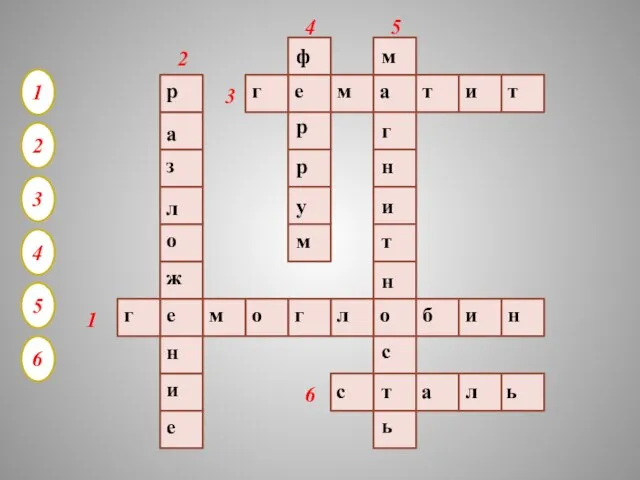
- 34. 1 2 3 4 5 6 г е м о г л о б и н
- 35. 1. Белок крови, переНосящий по организму кислород 2. Тип реакции, в которую вступают гидроксиды железа при
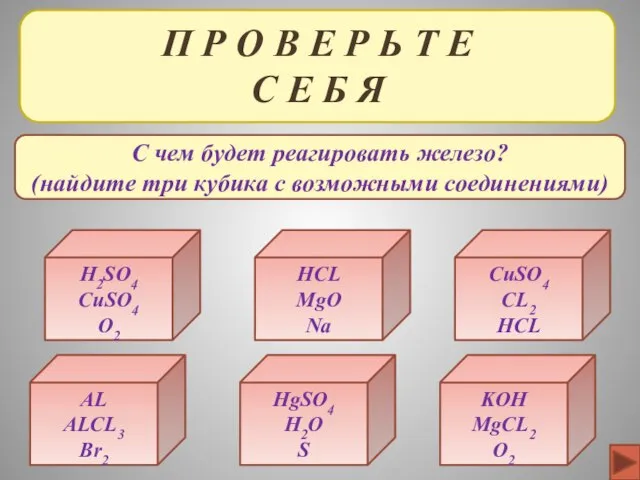
- 36. П Р О В Е Р Ь Т Е С Е Б Я H2SO4 CuSO4 O2
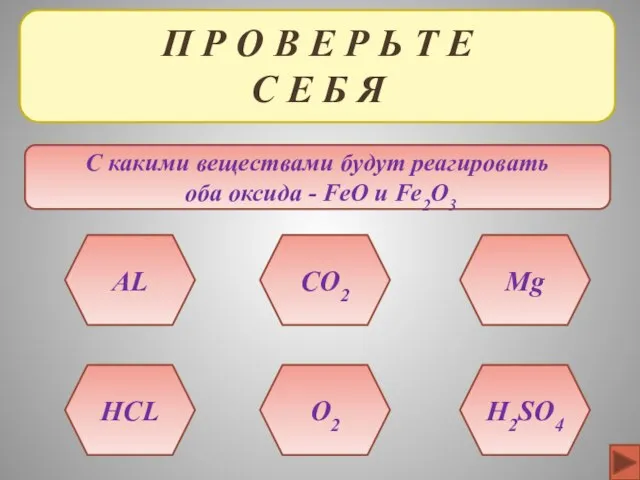
- 37. П Р О В Е Р Ь Т Е С Е Б Я С какими веществами
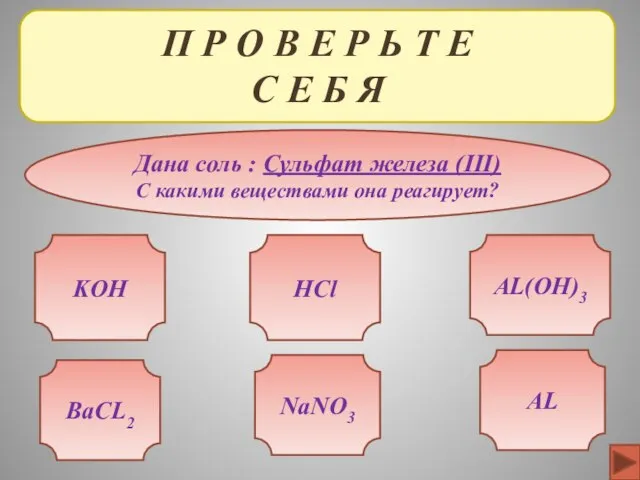
- 38. П Р О В Е Р Ь Т Е С Е Б Я Дана соль :
- 40. Скачать презентацию






















 Карбоновые кислоты (химические свойства)
Карбоновые кислоты (химические свойства) Металлургия
Металлургия Презентация на тему Интересные факты из жизни Д. И. Менделеева
Презентация на тему Интересные факты из жизни Д. И. Менделеева  Физические свойства металлов
Физические свойства металлов Своя игра. Химические элементы
Своя игра. Химические элементы Технология получения полиуретанов
Технология получения полиуретанов Степень окисления. Электроотрицательность. Формулы бинарных соединений
Степень окисления. Электроотрицательность. Формулы бинарных соединений Школа юных ученых. Соль
Школа юных ученых. Соль Химический состав продуктов питания
Химический состав продуктов питания Презентация на тему Радиация и её воздействие на человека
Презентация на тему Радиация и её воздействие на человека  Совершенствование железооксидного катализатора дегидрирования за счет стабилизации ферритных фаз
Совершенствование железооксидного катализатора дегидрирования за счет стабилизации ферритных фаз Вода… Химические названия
Вода… Химические названия Презентация на тему Бинарные соединения
Презентация на тему Бинарные соединения  Метаболизм триацилглицеринов
Метаболизм триацилглицеринов Оксид лития
Оксид лития Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"  Получение и применение алкенов
Получение и применение алкенов Кислород (Лекция 7)
Кислород (Лекция 7) Контрольна робота, хімія
Контрольна робота, хімія Основы химической кинетики
Основы химической кинетики Осуществление цепочки химических превращений. Практическая работа №1
Осуществление цепочки химических превращений. Практическая работа №1 Презентация на тему Химия в разных науках
Презентация на тему Химия в разных науках  Способы получения металлов
Способы получения металлов Получение и применение аренов
Получение и применение аренов Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В.
Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В. Искусственные и синтетические ткани
Искусственные и синтетические ткани Простые и сложные вещества (8 класс)
Простые и сложные вещества (8 класс) 7 Классиф неорг веществ презентация 2 (1)
7 Классиф неорг веществ презентация 2 (1)