Слайд 3Распределение электронов по энергетическим уровням
+
N=1
N=2
N=3
N=4
N=5
N=6
N=7
ЭНЕРГИЯ Е УВЕЛИЧИВАЕТСЯ

Слайд 4Количество электронов на энергетических уровнях
N=2n2 N – номер уровня
n –

макс.число е
+
+
…
2e
8e
18е
32е
32е
N=1
N=2
N=3
N=4
N=5
Слайд 5 Электрон в атоме может находиться в любой точке пространства вокруг ядра,

однако вероятность его пребывания в разных местах атомного пространства различна.
Атомная орбиталь –
область вокруг ядра атома,
в которой наиболее вероятно
нахождение электрона.
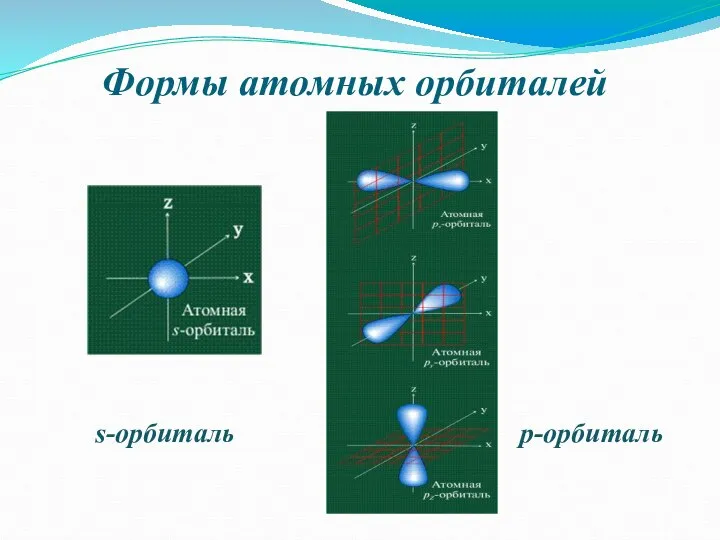
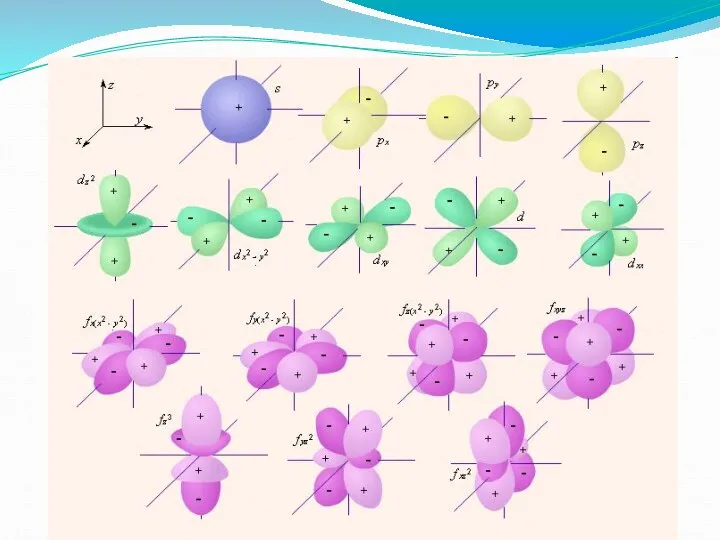
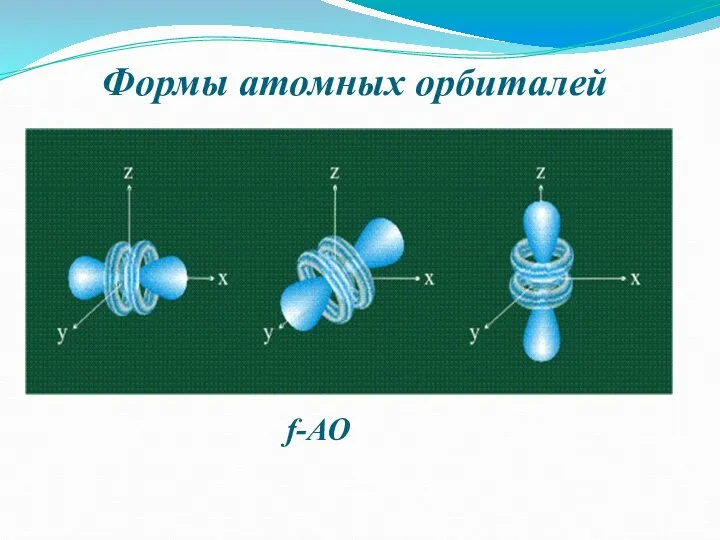
Слайд 7Формы атомных орбиталей
s-орбиталь
p-орбиталь
Слайд 10На одной орбитали могут находиться не более двух электронов, отличающихся друг от
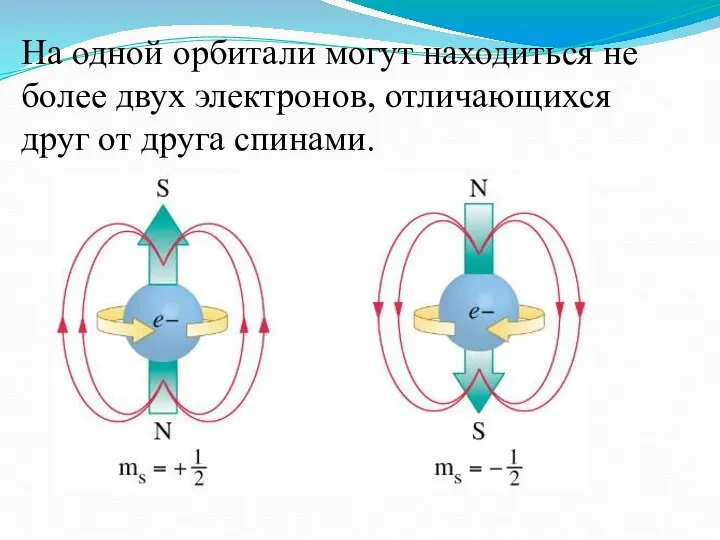
друга спинами.
Слайд 11 Принцип наименьшей энергии:
В атоме каждый электрон располагается так, чтобы его энергия была
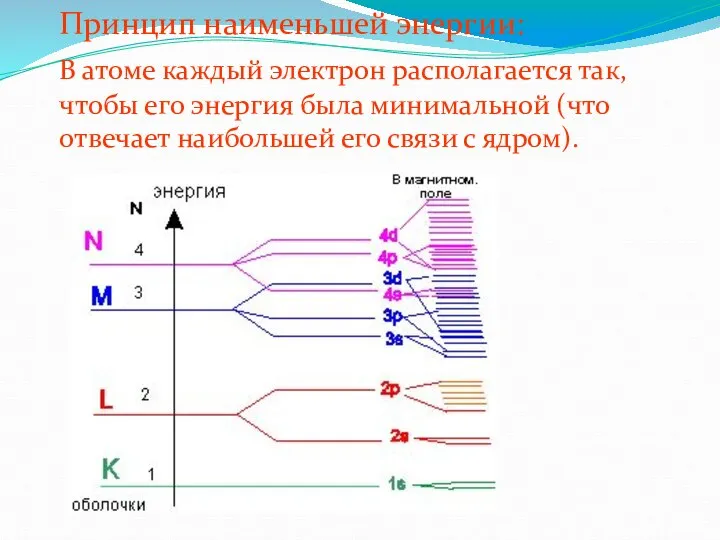
минимальной (что отвечает наибольшей его связи с ядром).
Слайд 12
+2 He )
2
1 S2
Пример движения электрона по
S-орбитали
+










 Геометрия молекул
Геометрия молекул Галогены. Их значение в жизни человека
Галогены. Их значение в жизни человека Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Карбоциклические соединения. Циклоалканы
Карбоциклические соединения. Циклоалканы Аммиак. Соли аммония
Аммиак. Соли аммония Явление аллотропии
Явление аллотропии Кислород
Кислород Cеминар 6 -Алканы-2
Cеминар 6 -Алканы-2 Типы кристаллических решеток
Типы кристаллических решеток Аллотропные модификации
Аллотропные модификации Соли. Химические свойства
Соли. Химические свойства Углерод. Положение в ПС и особенности строения атома
Углерод. Положение в ПС и особенности строения атома Презентация на тему по химии витамины
Презентация на тему по химии витамины  Неметаллы в ПСХЭ
Неметаллы в ПСХЭ Атом. Ядро и электронная оболочка
Атом. Ядро и электронная оболочка Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот
Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот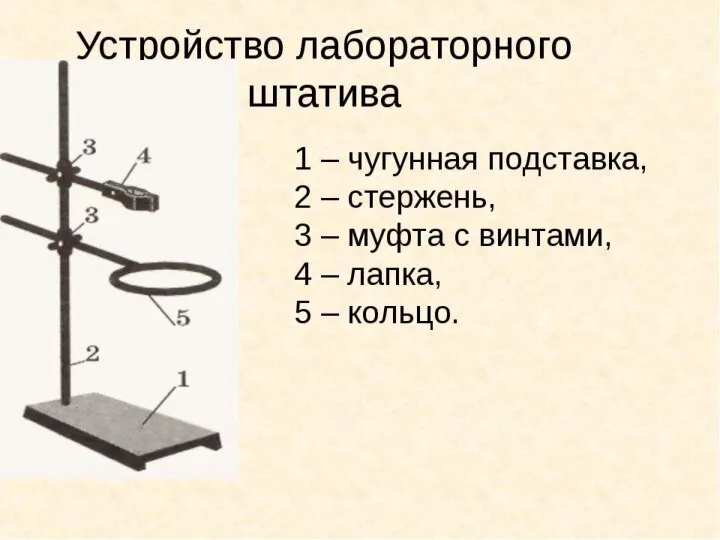 Устройство лабораторного штатива
Устройство лабораторного штатива Кристаллогидраты
Кристаллогидраты Теория электролитической диссоциации
Теория электролитической диссоциации Язык естествознания. Химия
Язык естествознания. Химия Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра Свободные атомы. Простые вещества. Сложные вещества
Свободные атомы. Простые вещества. Сложные вещества Химия окружающей среды
Химия окружающей среды Общие свойства растворов
Общие свойства растворов Основания Сложные вещества
Основания Сложные вещества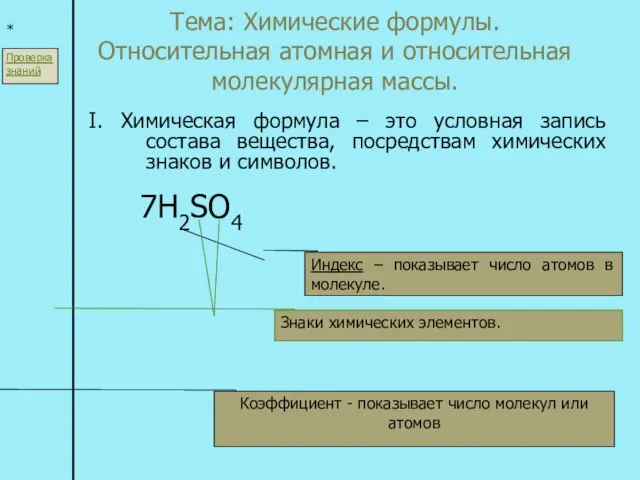 Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. I. Химическая формула – это условная запись с
Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. I. Химическая формула – это условная запись с Реакции ионного обмена
Реакции ионного обмена Амины. Номенклатура
Амины. Номенклатура