Содержание
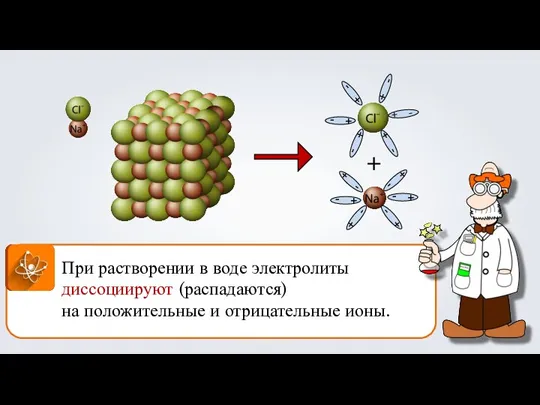
- 2. + При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
- 3. Р Катионы Анионы
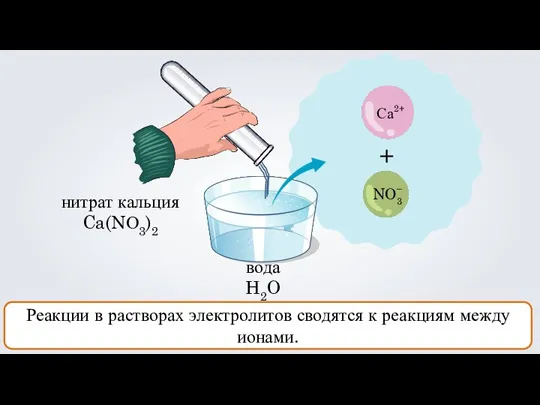
- 4. нитрат кальция Ca(NО3)2 + Са NO3 вода H2O 2+ – Реакции в растворах электролитов сводятся к
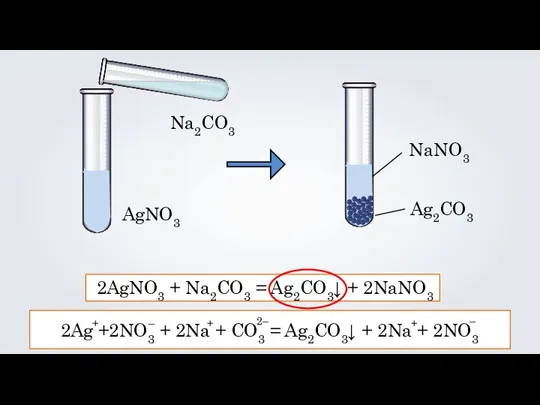
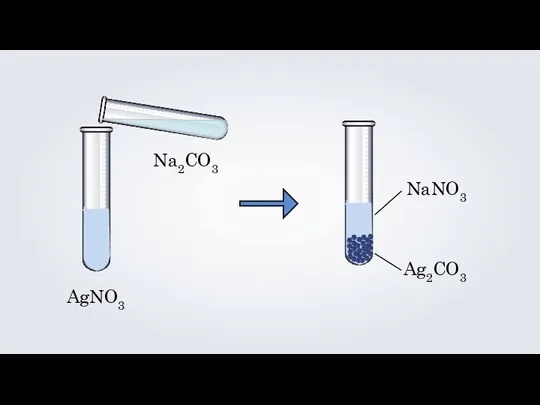
- 5. AgNO3 Na2CO3 NaNO3 Ag2CO3 2AgNO3 + Na2CO3 = Ag2CO3↓ + 2NaNO3 2Ag +2NO3 + 2Na +
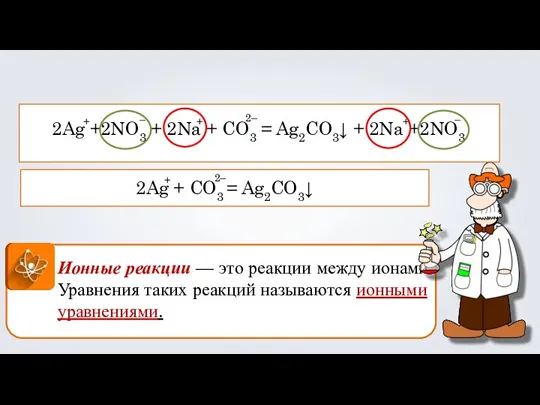
- 6. Ионные реакции — это реакции между ионами. Уравнения таких реакций называются ионными уравнениями. 2Ag +2NO3 +
- 7. AgNO3 Na2CO3 NaNO3 Ag2CO3
- 8. 2AgNO3 + Na2CO3 = Ag2CO3↓ + 2NaNO3 2Ag +2NO3 + 2Na + CO3 = Ag2CO3↓ +
- 9. Условия протекания реакций ионного обмена до конца Образование в результате реакции нерастворимого в воде вещества. 2.
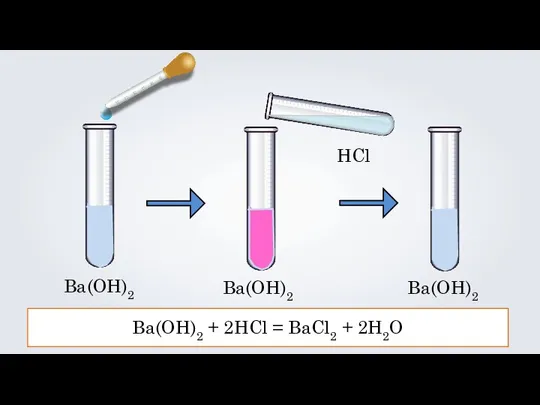
- 10. Ba(OH)2 Ba(OH)2 HCl Ba(OH)2 Ba(OH)2 + 2HCl = BaCl2 + 2H2O
- 11. Ba(OH)2 + 2HCl = BaCl2 + 2H2O Ba + 2OH + 2H + 2Cl = Ba
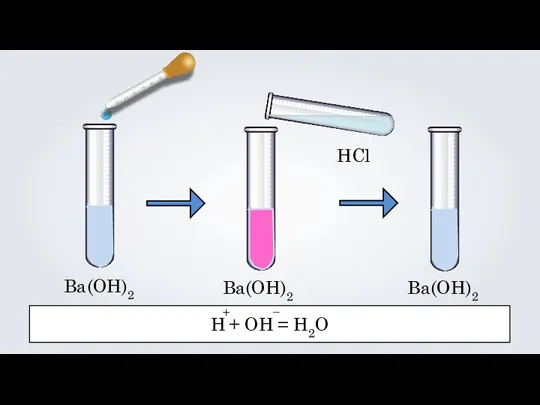
- 12. Ba(OH)2 Ba(OH)2 HCl Ba(OH)2 H + OH = H2O + –
- 13. Реакции нейтрализации — это реакции взаимодействия сильной кислоты со щёлочью, в результате которых образуется малодиссоциирующее вещество
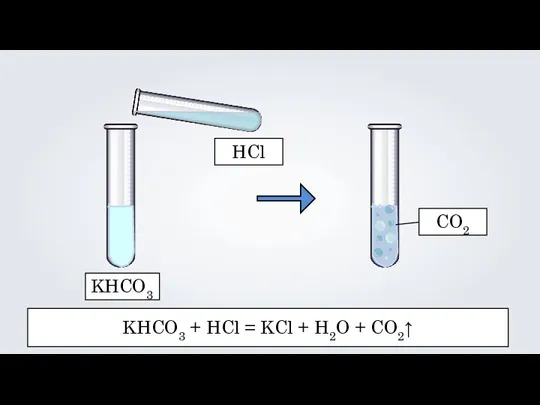
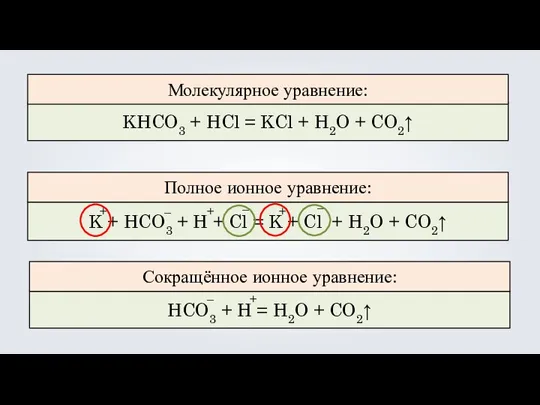
- 14. KHCO3 HCl CO2 KHCO3 + HCl = KCl + H2O + CO2↑
- 15. KHCO3 + HCl = KCl + H2O + CO2↑ K + HCO3 + H + Cl
- 17. Скачать презентацию





 Молекула воды, какая ты?
Молекула воды, какая ты? Ионные уравнения
Ионные уравнения Увлекательный мир химии
Увлекательный мир химии Понятие о сплавах и методах их получения
Понятие о сплавах и методах их получения Учёные-химики в годы Великой Отечественной войны
Учёные-химики в годы Великой Отечественной войны Эфиры. Жиры
Эфиры. Жиры Железо и его соединения
Железо и его соединения Презентация на тему Основные законы науки химии
Презентация на тему Основные законы науки химии  Натуральный каучук
Натуральный каучук Гравиметрический анализ. Лекция №11
Гравиметрический анализ. Лекция №11 Презентация на тему Пластмасса
Презентация на тему Пластмасса  Ароматические и ненасыщенные альдегиды и кетоны
Ароматические и ненасыщенные альдегиды и кетоны Аргументы к апелляции на ЕГЭ по химии 2021
Аргументы к апелляции на ЕГЭ по химии 2021 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алкены (CnH2n)
Алкены (CnH2n) Современные представления о строении атома
Современные представления о строении атома Изучение свойств азотной кислоты для учащихся 9 классов
Изучение свойств азотной кислоты для учащихся 9 классов Химическая связь
Химическая связь Презентация на тему Биологические действия радиации
Презентация на тему Биологические действия радиации  Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация
Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов
Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов Условия хранения и подготовка скоропортящихся грузов к перевозкам
Условия хранения и подготовка скоропортящихся грузов к перевозкам Презентация на тему Сплавы металлов
Презентация на тему Сплавы металлов  Амины
Амины Нефть. Состав и свойства
Нефть. Состав и свойства Электролитическая диссоциация
Электролитическая диссоциация 10 класс природные источники углеводородов
10 класс природные источники углеводородов Электролиз
Электролиз