Содержание
- 2. План лекции: Классификация неорганических веществ. Способы получения, номенклатура, физические и химические свойства основных, кислотных и амфотерных
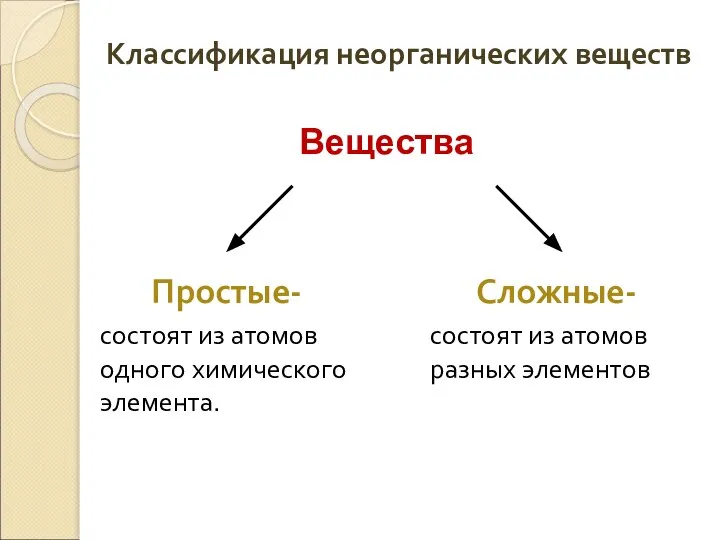
- 3. Классификация неорганических веществ Простые- состоят из атомов одного химического элемента. Сложные- состоят из атомов разных элементов
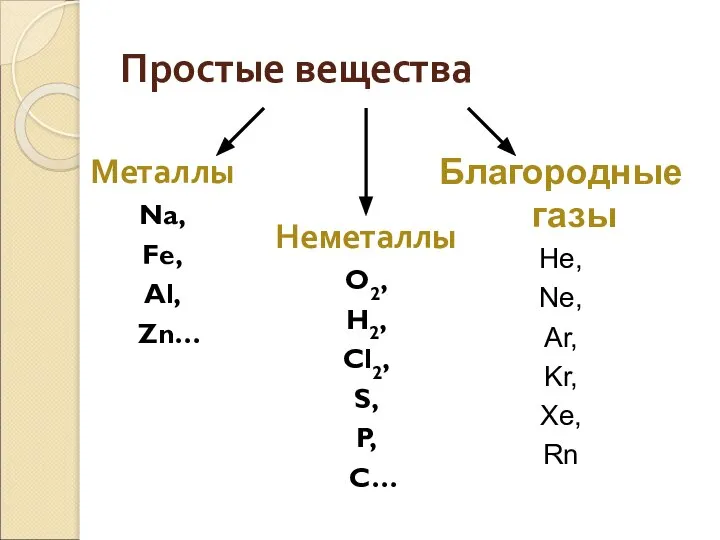
- 4. Благородные газы He, Ne, Ar, Kr, Xe, Rn Простые вещества Металлы Na, Fe, Al, Zn… Неметаллы
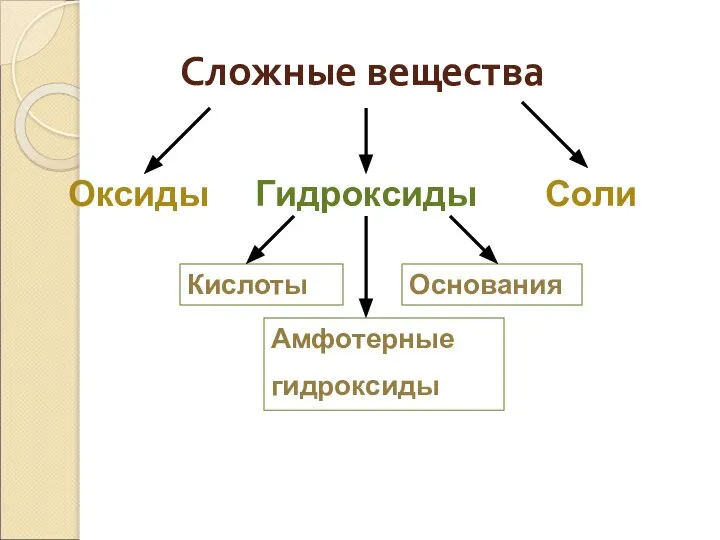
- 5. Сложные вещества Оксиды Гидроксиды Соли Кислоты Основания Амфотерные гидроксиды
- 6. Свойства оксидов и гидроксидов в периоде изменяются от основных через амфотерные к кислотным, т.к. увеличивается положительная
- 7. Оксиды Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород
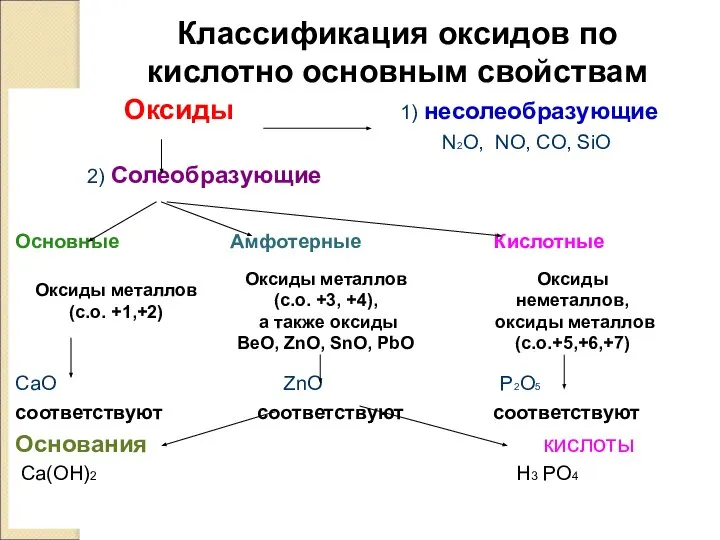
- 8. Классификация оксидов по кислотно основным свойствам Оксиды 1) несолеобразующие N2O, NO, CO, SiO 2) Солеобразующие Основные
- 9. Несолеобразующие оксиды — оксиды, не проявляющие ни кислотных, ни основных, ни амфотерных свойств и не образующие
- 10. Общая формула Ме2О, МеО Физические свойства При комнатной температуре основные оксиды твердые, кристаллические вещества чаще всего
- 11. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.) 1) О.О. + кислота =соль + вода (реакция обмена) CaO +
- 12. Агрегатное состояние различное: Р2О5 – твердый, SiO2 – твердый, СО2 – газообразный, SO3 – жидкий при
- 13. Химические свойства кислотных оксидов (К.О.) 1) К.О. + основание = соль + вода (реакция обмена) CO2
- 14. Амфотерные оксиды Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Примеры:
- 15. Al2O3 (оксид алюминия) очень твердые прозрачные кристаллы. Температура плавления – 2053 °C, температура кипения – 3000
- 16. Какие элементы периодической системы образуют амфотерные соединения? Металлы Неметаллы, исключая элементы побочных подгрупп Элементы, образующие амфотерные
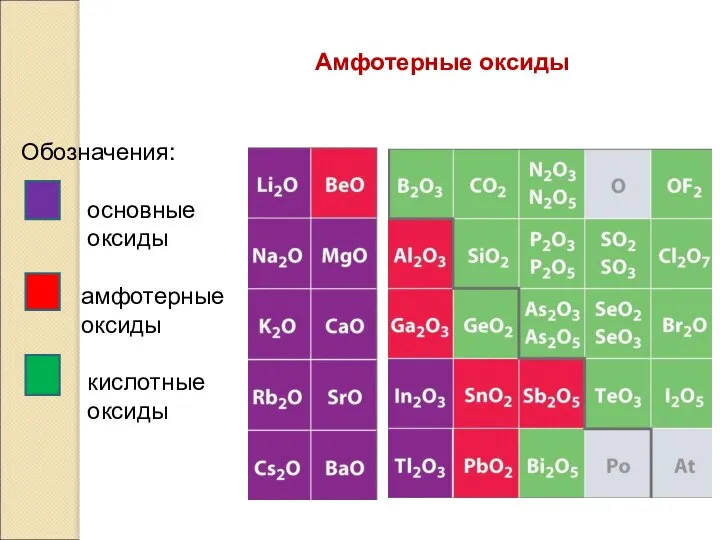
- 17. Амфотерные оксиды Обозначения: основные оксиды амфотерные оксиды кислотные оксиды
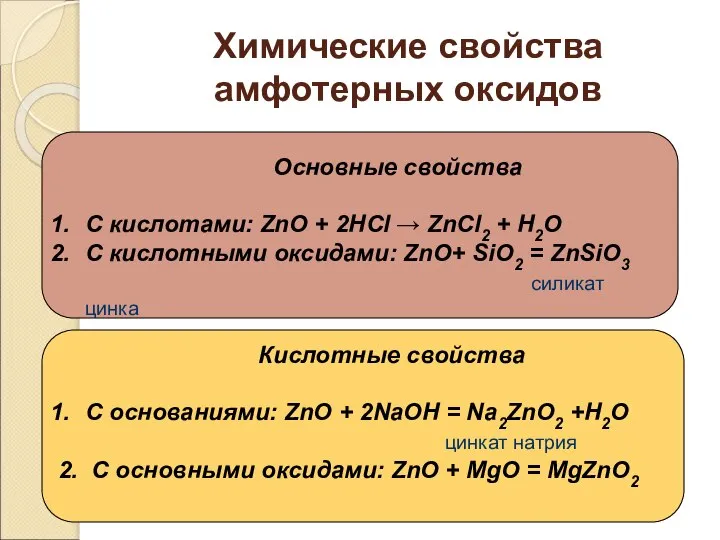
- 18. Химические свойства амфотерных оксидов Основные свойства С кислотами: ZnO + 2НСl → ZnСl2 + Н2О С
- 19. Способы получения оксидов 1) Взаимодействие простых веществ с кислородом. S + O2—› SO2 4Al + 3O2
- 20. Способы получения оксидов 4) Термическое разложение Нерастворимых оснований Cu(OН)2=CuО + H2O CaCO3 = CaO + CO2
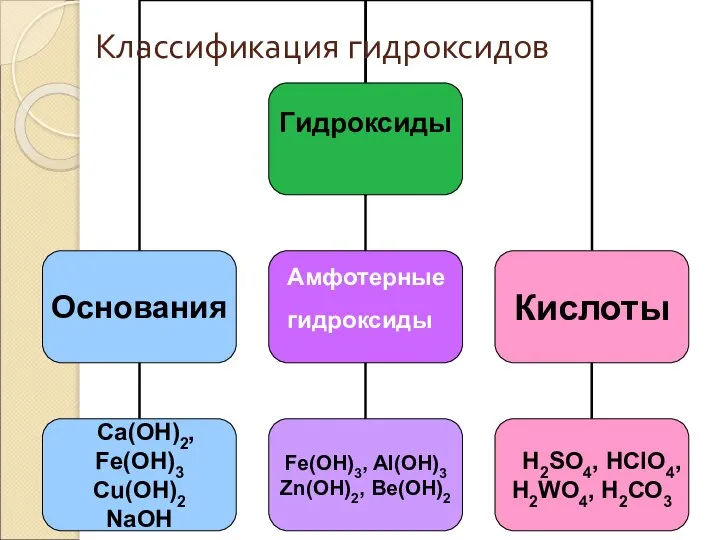
- 21. Гидроксиды Гидроксиды – это неорганические соединения, содержащие в составе гидроксильную группу (-ОН ) Общая формула: Э(ОН)n
- 22. Амфотерные гидроксиды Классификация гидроксидов
- 23. Основания Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или
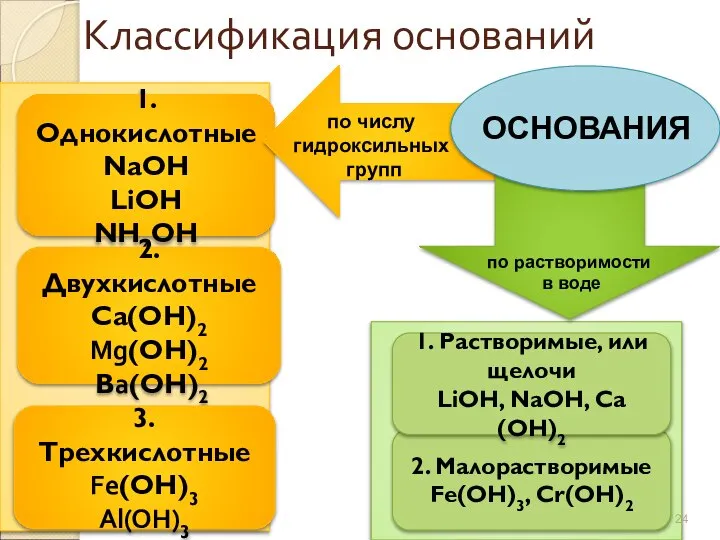
- 24. Классификация оснований 1. Однокислотные NaОН LiОН NН4ОН 2. Двухкислотные Са(ОН)2 Mg(ОН)2 Вa(ОН)2 3. Трехкислотные Fe(ОН)3 Al(OH)3
- 25. Основания. Гидроксиды щелочных металлов Общая формула – МеОН Щелочи. Белые кристаллические вещества, гигроскопичны, хорошо растворимы в
- 26. Гидроксиды металлов IIА группы Общая формула – Ме(ОН)2 Белые кристаллические вещества, в воде растворимы хуже, чем
- 27. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый Химические
- 28. 2. Взаимодействуют со всеми кислотами (реакция нейтрализации) NaOH + HCl → NaCl + H2O 3. Взаимодействуют
- 29. 5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H2O → Na2SiO3 +
- 30. Химические свойства нерастворимых оснований 1. Взаимодействуют с кислотами (реакция нейтрализации) Fe(OH) 2 + H2SO4 → FeSO4
- 31. Способы получения растворимых оснований (щелочей) 1. Взаимодействие щелочных и щелочно-земельных металлов их оксидов с водой 2Na
- 32. Способы получения нерастворимых оснований 2. Взаимодействие раствора щелочи с раствором соли 3NaOH + АlCl3 = Al(OH)3
- 33. Кислоты Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. При
- 34. Физические свойства кислот При обычных условиях кислоты могут быть жидкими и твердыми (борная, ортофосфорная, вольфрамовая) Кислоты
- 35. Классификация кислот
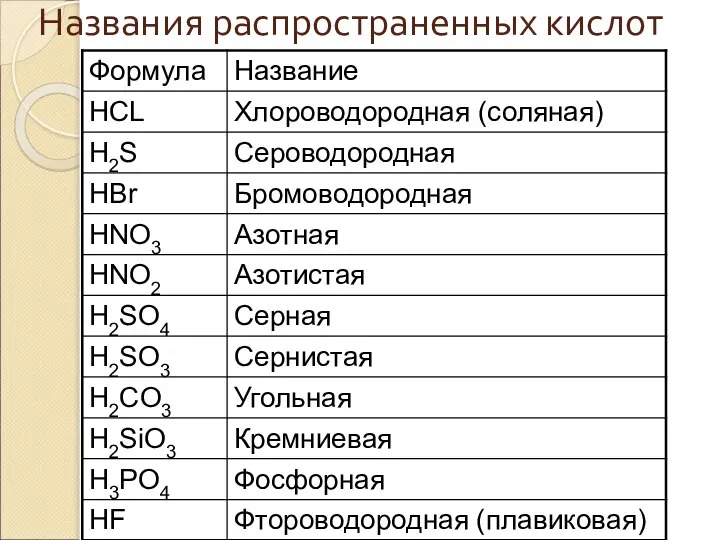
- 36. Названия распространенных кислот
- 37. Типичные реакции кислот 1. Кислота + основание = соль + вода H2SO4 +2 NaOH = Na2SO4
- 38. Типичные реакции кислот 3. Кислота + металл = водород + соль 2HCL +Zn = ZnCL2 +
- 39. Способы получения кислот 1. Взаимодействие кислотных оксидов с водой SO3 + H2O = H2SO4; CO2 +
- 40. Амфотерными называются гидроксиды , которые в зависимости от условий могут быть как донорами катионов водорода и
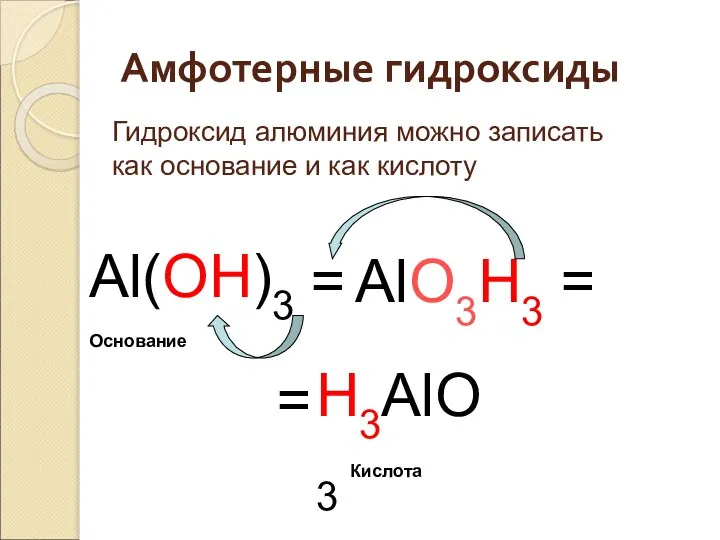
- 41. Амфотерные гидроксиды Al(OH)3 = H3AlO3 AlO3H3 = = Кислота Основание Гидроксид алюминия можно записать как основание
- 42. Некоторые гидроксиды с кислотно-основными свойствами:
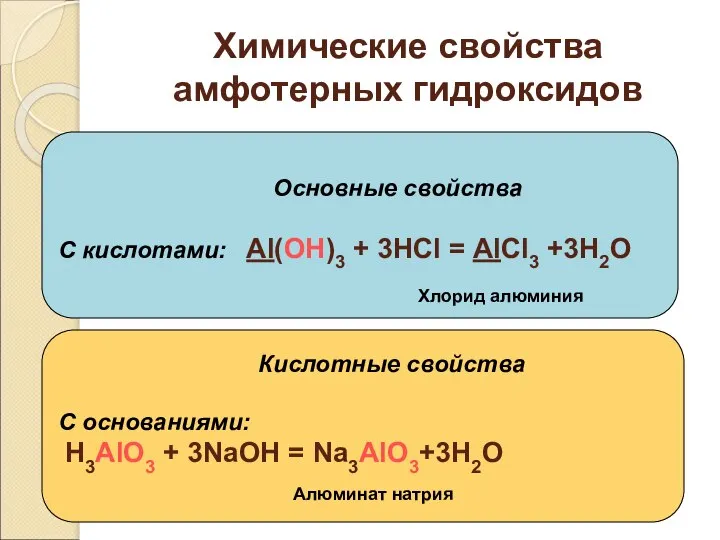
- 43. Химические свойства амфотерных гидроксидов Основные свойства С кислотами: Al(OH)3 + 3HCl = AlCl3 +3H2O Кислотные свойства
- 44. Способы получения амфотерных гидроксидов Осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента AlCl3 + NаOH
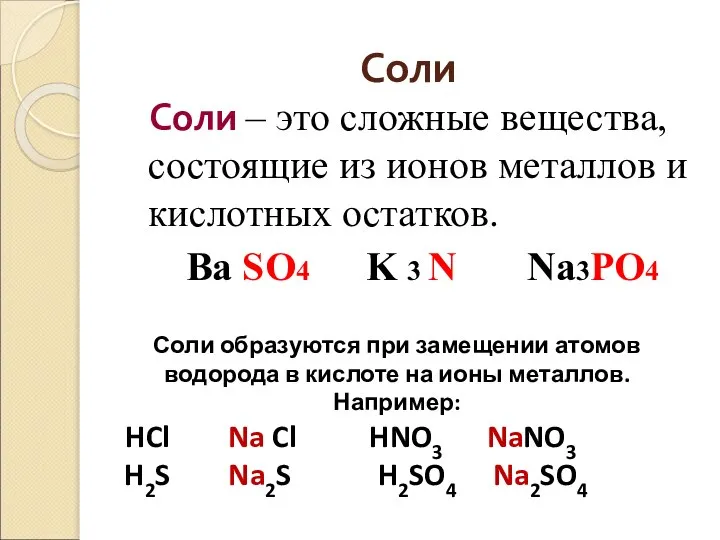
- 45. Соли Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков. Ba SO4 K
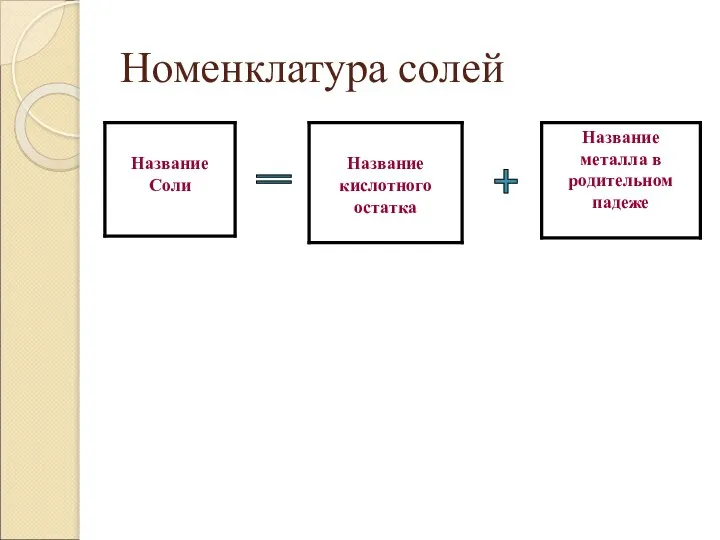
- 46. Номенклатура солей + =
- 47. Названия солей бескислородных кислот называем неметалл ( латинское название) с суффиксом – ид (в им. падеже);
- 48. Названия солей кислородсодержащих кислот Называем ион кислотного остатка (в именительном падеже); с суффиксами: -ат для высшей
- 49. Номенклатура солей F – Cl – Br – I – S 2- SO3 2- SO4 2-
- 50. Алгоритм составления формулы соли бескислородной кислоты Первое действие: записываем степени окисления элементов, находим наименьшее общее кратное
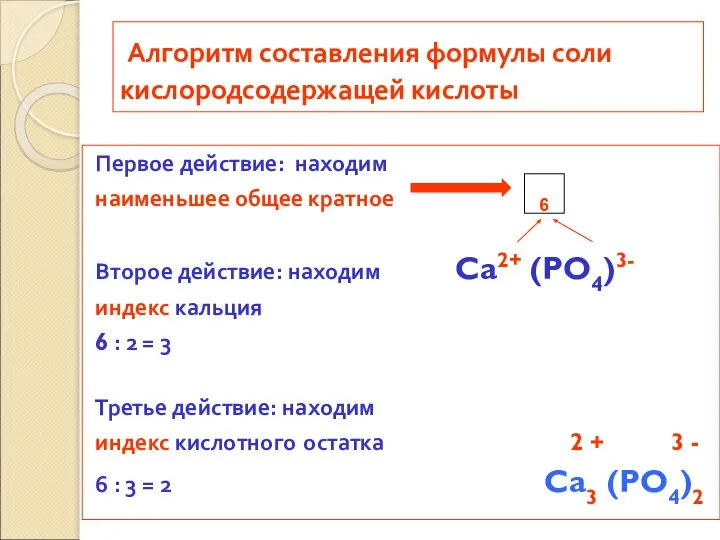
- 51. Алгоритм составления формулы соли кислородсодержащей кислоты Первое действие: находим наименьшее общее кратное Второе действие: находим Ca2+
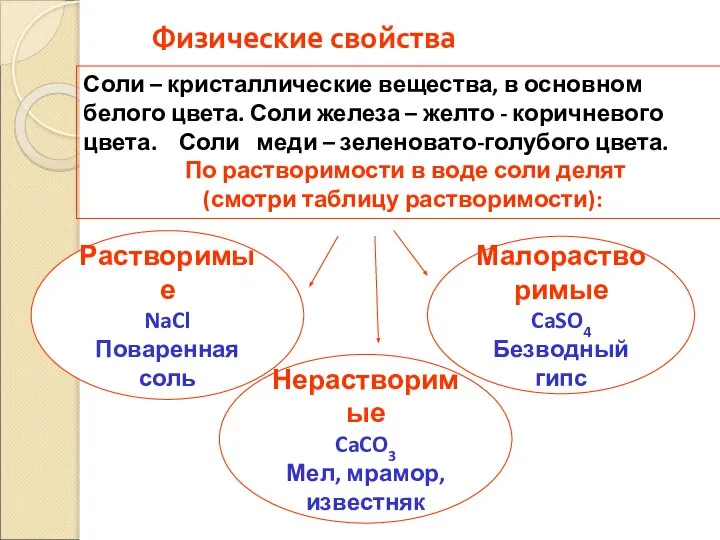
- 52. Физические свойства Растворимые NaCl Поваренная соль Соли – кристаллические вещества, в основном белого цвета. Соли железа
- 53. Типы солей Нормальные (средние) -это соли, в которых все атомы водорода соответствующей кислоты замещены на атомы
- 54. Соли реагируют с металлами( исключения активные металлы: Li, Na, K, Ca, Ba - которые при обычных
- 55. Соли реагируют с некоторыми кислотными оксидами: CaCO3 + SiO2 = CaSiO3 + CO2 Соли реагируют с
- 56. Взаимодействие металлов и неметаллов: 2Fe + 3Cl2 = 2FeCl3 Взаимодействие кислотных оксидов с основными и амфотерными
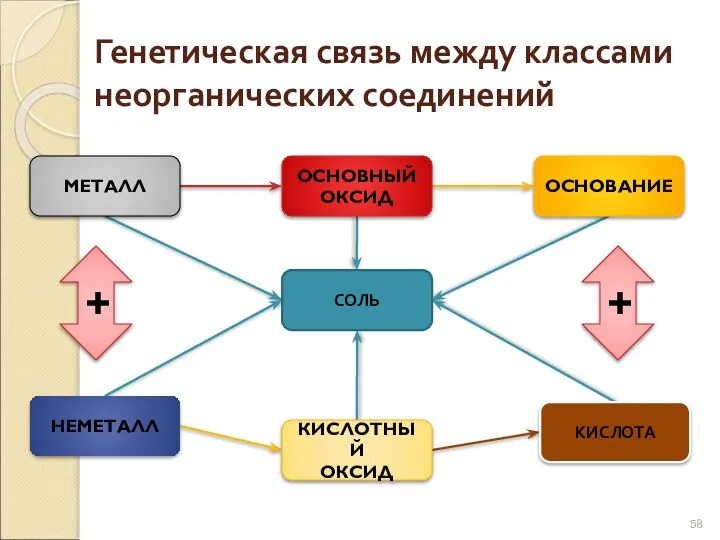
- 57. Генетическая связь Связь между классами неорганических соединений, основанная на получении веществ одного класса из веществ другого
- 58. Генетическая связь между классами неорганических соединений МЕТАЛЛ ОСНОВНЫЙ ОКСИД ОСНОВАНИЕ СОЛЬ НЕМЕТАЛЛ КИСЛОТНЫЙ ОКСИД КИСЛОТА +
- 59. Генетическая связь отражается в генетических рядах. В состав любого генетического ряда входят вещества различных классов неорганических
- 61. Скачать презентацию










































 Окислительно восстановительные свойства веществ
Окислительно восстановительные свойства веществ Железо в продуктах питания. Подготовила ученица 9 «б» класса Чиженькова Ольга. Учитель: Шарапова О. В.
Железо в продуктах питания. Подготовила ученица 9 «б» класса Чиженькова Ольга. Учитель: Шарапова О. В. Какой химический элемент алхимики обозначали таким символом? Интеллектуальная игра
Какой химический элемент алхимики обозначали таким символом? Интеллектуальная игра Физико-химические методы получения порошков металлов
Физико-химические методы получения порошков металлов Минералы. Определения, понятия
Минералы. Определения, понятия Коррозия металлов и ГЭ
Коррозия металлов и ГЭ Строение вещества. Химическая связь
Строение вещества. Химическая связь Химия и косметика
Химия и косметика Состав и строение атома. Изотопы
Состав и строение атома. Изотопы Игра по химии Классики
Игра по химии Классики pervonachalnye_svedenia_ob_org_v-kh
pervonachalnye_svedenia_ob_org_v-kh Презентация на тему Простые вещества - неметаллы
Презентация на тему Простые вещества - неметаллы  Презентация на тему Жизнь Д.И.Менделеева
Презентация на тему Жизнь Д.И.Менделеева  Закон сохранения массы веществ. Признаки химических реакций
Закон сохранения массы веществ. Признаки химических реакций Презентация на тему Полезная химия во фруктах и овощах
Презентация на тему Полезная химия во фруктах и овощах  Неорганический мозговой штурм
Неорганический мозговой штурм Карбид кальция. Назначение
Карбид кальция. Назначение Окислительно-восстановительные реакции. ОГЭ по химии, задание 15
Окислительно-восстановительные реакции. ОГЭ по химии, задание 15 Синтетические органические соединения
Синтетические органические соединения Альдегиды
Альдегиды Атом. Ядро и электронная оболочка
Атом. Ядро и электронная оболочка Алкены. Строение. Изомерия. Химические свойства. Получение
Алкены. Строение. Изомерия. Химические свойства. Получение Превращение веществ. История химии. Автор: Рассказова Н.Л., учитель химии и биологии МОУ «СОШ №8».
Превращение веществ. История химии. Автор: Рассказова Н.Л., учитель химии и биологии МОУ «СОШ №8». Презентация по Химии "Незнайка в стране химия"
Презентация по Химии "Незнайка в стране химия"  Ферменттер.Ферменттердің құрылымы.Биохимиялық маңызы
Ферменттер.Ферменттердің құрылымы.Биохимиялық маңызы Х 9 Урок 7 Электролитическая диссоциация
Х 9 Урок 7 Электролитическая диссоциация Биосинтез пиримидиновых нуклеотидов
Биосинтез пиримидиновых нуклеотидов Химическая кибернетика
Химическая кибернетика