Содержание
- 2. Химическая связь
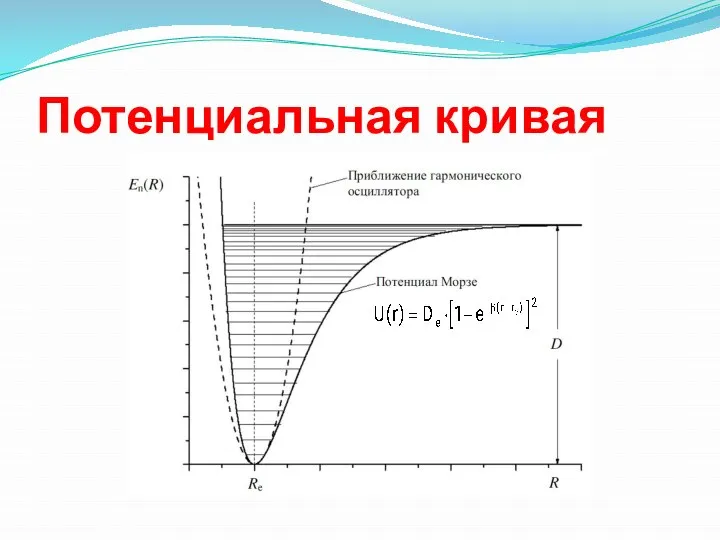
- 3. Потенциальная кривая
- 5. Атомная орбиталь Одноцентровая волновая функция описывающая состояние электрона в атоме и зависящая от трех квантовых чисел
- 6. Спин – орбиталь электрона. χI = ϕ(r, ϑ, ϕ)* σ (i)= f(n,l,m,ms) σ (↑) ms =
- 7. Полная волновая функция атома и молекулы. Состояние системы содержащей несколько электронов описывается полной волновой функцией, учитывающей
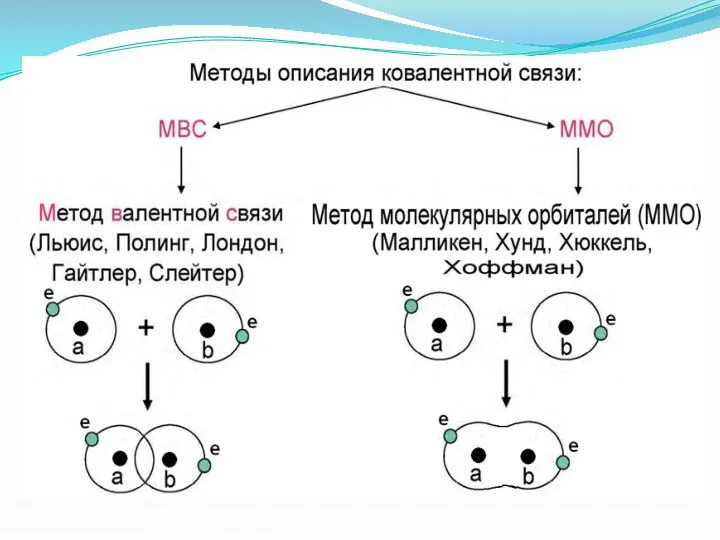
- 8. Метод валентных схем (МВС) Рассмотрим молекулу Н2, которую построим из двух АО атомов Н. AO для
- 9. Метод молекулярных орбиталей (ММО)
- 10. Метод молекулярных орбиталей
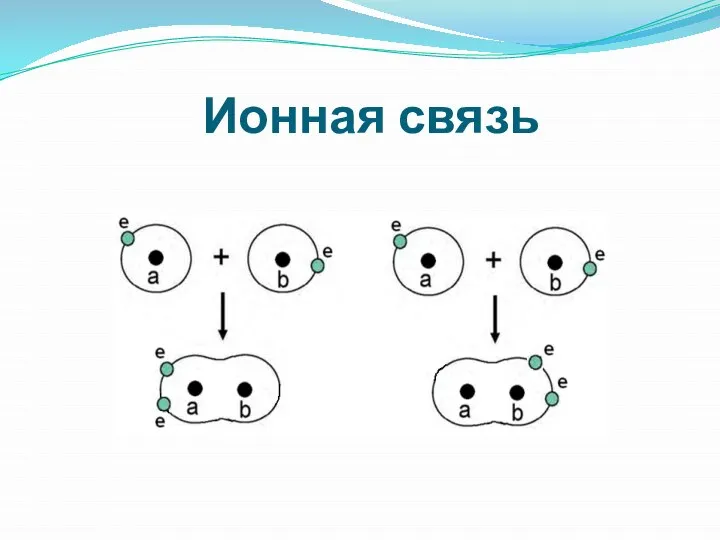
- 11. Ионная связь
- 12. МВС Связь образуется между атомами, имеющими неспаренные электроны с антипараллельными спинами. Образование химической связи обусловлено повышенной
- 13. Метод валентных схем (МВС)
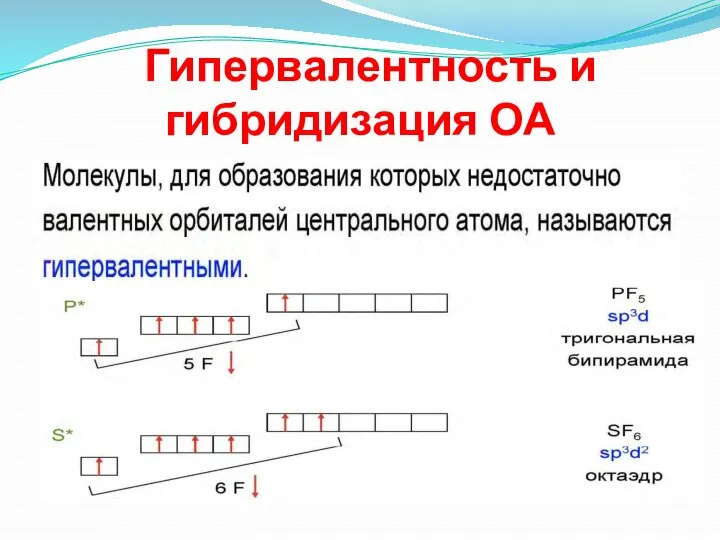
- 14. Гипервалентность и гибридизация ОА
- 15. Донорно-акцепторное взаимодействие
- 17. Метод молекулярных орбиталей H = Te1 +Te2 +ΣΣUaei + Ue1e2 + Uab H = -1/2∇2е1-1/2∇2е2 -
- 18. Точное решение уравнения Шредингера Точное решение уравнения Шредингера для многоэлектронной молекулы решить невозможно Причина: Потенциальная энергия
- 19. Решение для Н2+ H = -1/2∇2е1- (Za/r1 + Zb/r2 ) +Z2/R (в а.е.) Общий подход к
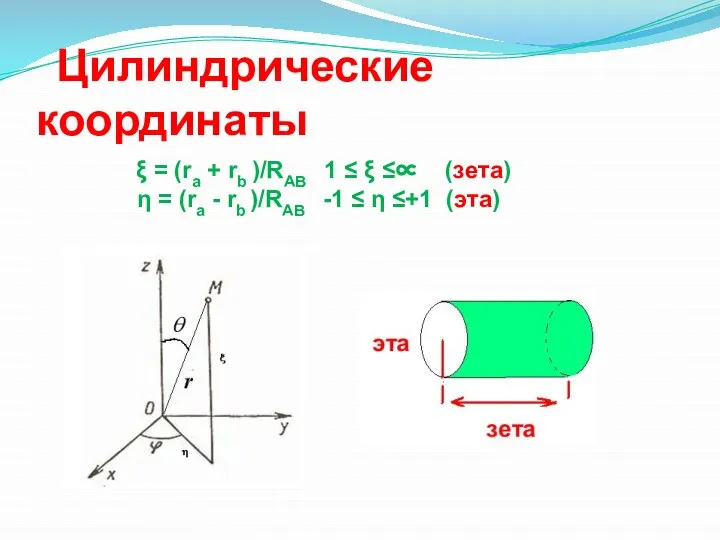
- 20. Цилиндрические координаты ξ = (ra + rb )/RAB 1 ≤ ξ ≤∝ (зета) η = (ra
- 21. Анализ решения Для молекулы квантовые числа n и l не имеют физического смысла и не постоянные.
- 22. Обозначение МО для двухатом-ных молекул |λ| 0 1 2 3 МО σ π δ ϕ МО
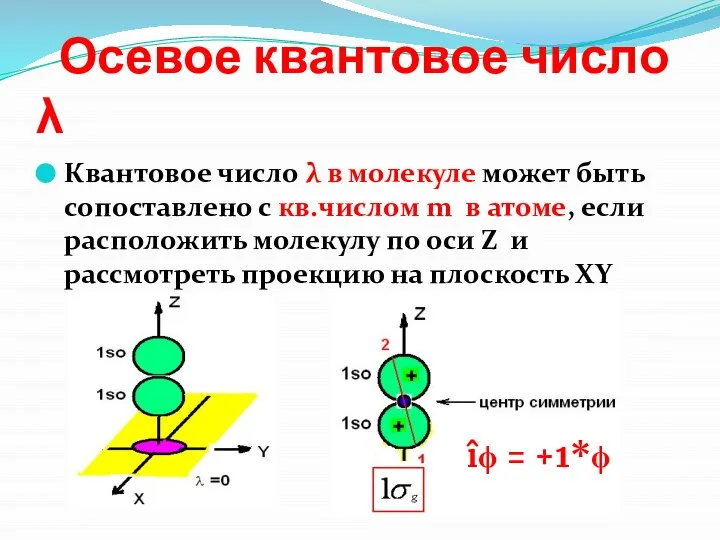
- 23. Осевое квантовое число λ Квантовое число λ в молекуле может быть сопоставлено с кв.числом m в
- 25. Скачать презентацию
















 Предмет органическая химия. Теория строения органических веществ
Предмет органическая химия. Теория строения органических веществ Презентация на тему Количество вещества. Молярная масса
Презентация на тему Количество вещества. Молярная масса  Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Металлы
Металлы ОВ. Структура и принцип работы параметры ОВ
ОВ. Структура и принцип работы параметры ОВ Химическое равновесие
Химическое равновесие Template biosynthesis
Template biosynthesis Bool-doser team
Bool-doser team Хромопротеиды (от. греч. chroma — цвет, окраска + протеиды)
Хромопротеиды (от. греч. chroma — цвет, окраска + протеиды) Введение в аналитическую химию
Введение в аналитическую химию Кислород. 8 класс
Кислород. 8 класс Соединения галогенов
Соединения галогенов Презентация на тему Лекарства
Презентация на тему Лекарства  Электролиз растворов и расплавов
Электролиз растворов и расплавов Опис технологічного процесу отримання смол бекелітових рідких марок
Опис технологічного процесу отримання смол бекелітових рідких марок Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Алкены
Алкены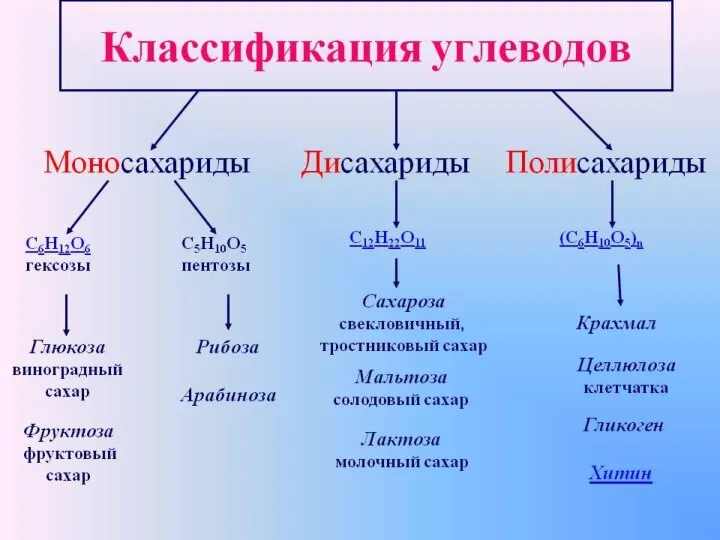 Классификация углеродов
Классификация углеродов Презентация по химии на тему _Высокомолекулярные Соединения_ (1)
Презентация по химии на тему _Высокомолекулярные Соединения_ (1) Хроматография. Особенности метода хроматографии
Хроматография. Особенности метода хроматографии Строение и свойства алканов
Строение и свойства алканов Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс Номенклатура органических соединений
Номенклатура органических соединений Карбонильные соединения. (Лекция 10)
Карбонильные соединения. (Лекция 10) Физические свойства полупроводников
Физические свойства полупроводников Анализ углеводов в пищевых продуктах
Анализ углеводов в пищевых продуктах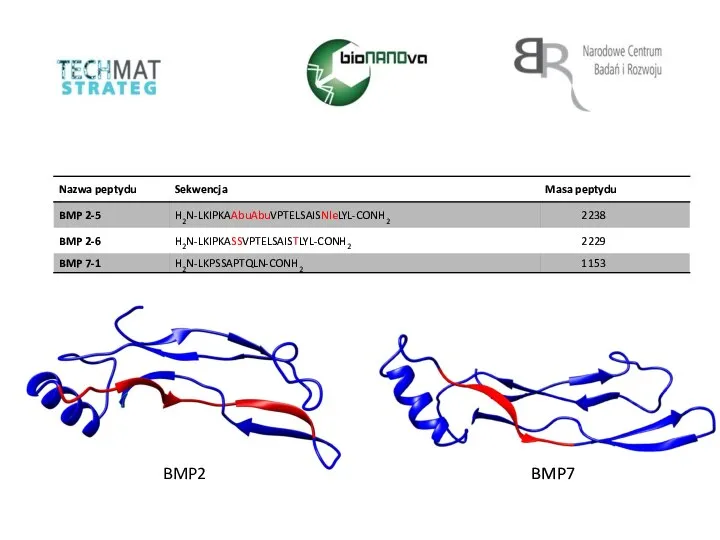 Nazwa peptydu. Sekwencja
Nazwa peptydu. Sekwencja Серная кислота
Серная кислота