Содержание
- 2. Общая характеристика растворов электролитов В технологической практике чаще имеют дело не с индивидуальными веществами, а с
- 3. Классификация растворов По степени дисперсности или по размеру распределенных частиц: истинные растворы (устойчивые дисперсные системы) коллоидные
- 4. По агрегатному состоянию: газовые (воздух) жидкие (морская вода) твердые (сплавы) Наибольшее распространение и применение имеют жидкие
- 5. По электрической проводимости растворы (истинные р-ры) делят на два вида: растворы неэлектролитов растворы электролитов Неэлектролиты –
- 6. Электролит проводит электрический ток в результате направленного перемещения его ионов, создающих поток электрических зарядов. Растворы (расплавы)
- 7. Электропроводность водных растворов электролитов объясняется теорией электролитической диссоциации. Основные положения теории электролитической диссоциации Растворение – сложный
- 8. При растворении неэлектролитов (растворы кислорода, сахара, глицерина в воде) происходит химическое взаимодействие между молекулами растворяемого вещества
- 9. При растворении электролитов процесс протекает в две стадии: АВ + (n+m)Н2О ⇄ АВ(n+m)Н2О (гидратация) АВ(n+m)Н2О ⇄
- 10. Электролитическая диссоциация – процесс распада молекул растворенного вещества под действием молекул растворителя на «+» и «–»
- 11. 2. Необходимые условия, определяющие возможность процесса электролитической диссоциации: наличие в растворяемом веществе ионных или полярных связей;
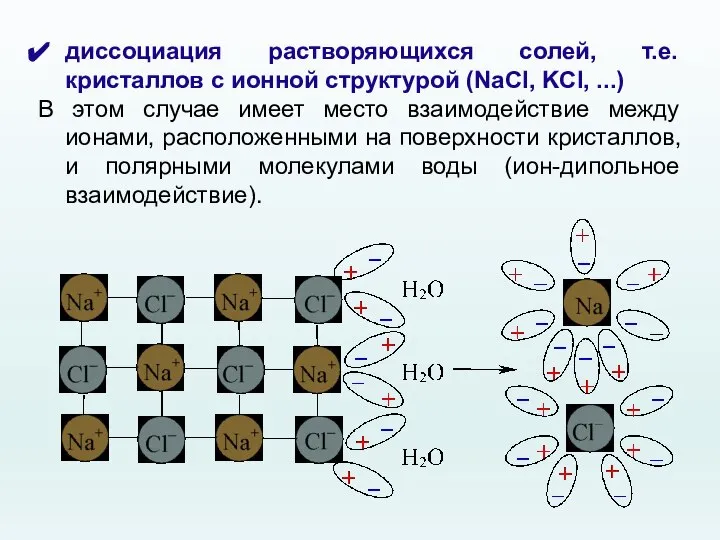
- 12. диссоциация растворяющихся солей, т.е. кристаллов с ионной структурой (NaCl, KCl, ...) В этом случае имеет место
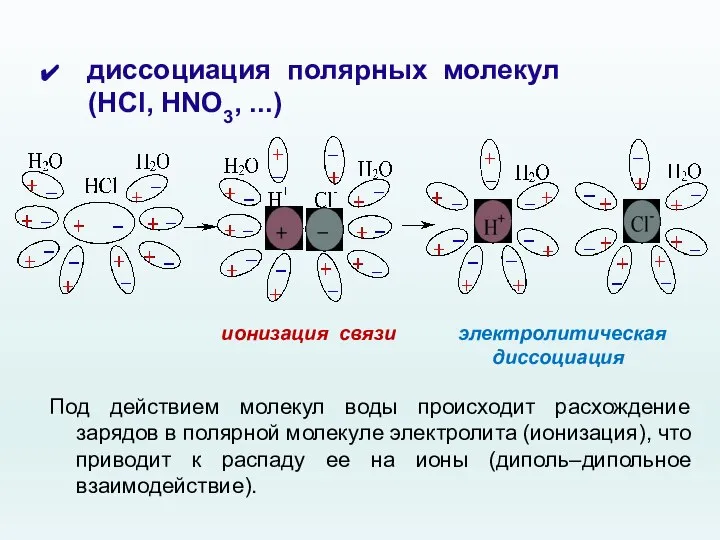
- 13. диссоциация полярных молекул (HCl, HNO3, ...) ионизация связи электролитическая диссоциация Под действием молекул воды происходит расхождение
- 14. 4. Ионы образуются в растворе электролита в таком количестве, что их суммарные заряды получаются одинаковыми, вследствие
- 15. Электролиты: кислоты основания соли
- 16. С точки зрения теории электролитической диссоциации: Кислоты – вещества, которые диссоциируют в воде на ионы водорода:
- 17. Способы выражения концентрации растворов Важной количественной харак-теристикой растворов является их концентрация. Концентрация – содержание растворенного вещества
- 18. Наиболее часто используют следующие способы выражения концентрации растворов: массовая доля (ω); молярная концентрация (СМ); молярная концентрация
- 19. Массовая доля (ω) – отношение массы растворенного вещества к общей массе раствора. Массовая доля растворенного вещества
- 20. !!! 1 л = 1000 мл 1 мл = 1 см3
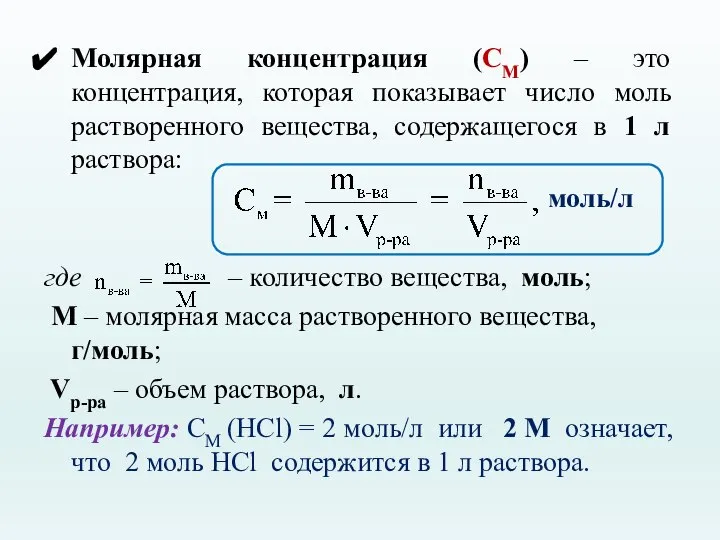
- 21. Молярная концентрация (CМ) – это концентрация, которая показывает число моль растворенного вещества, содержащегося в 1 л
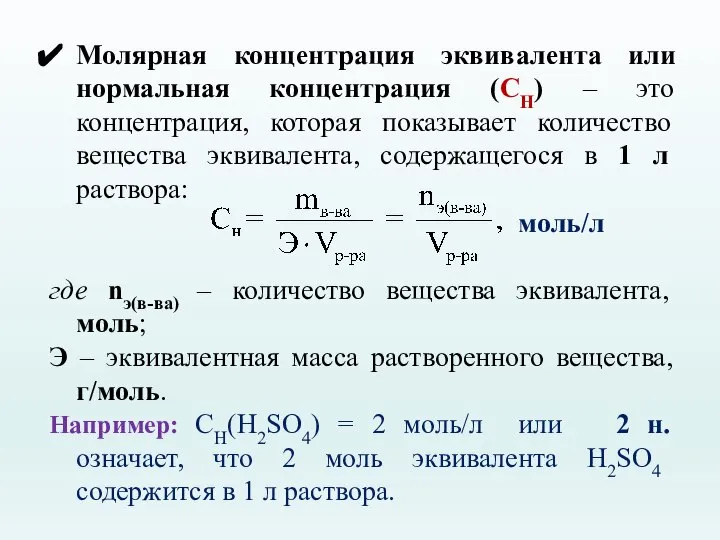
- 22. Молярная концентрация эквивалента или нормальная концентрация (СН) – это концентрация, которая показывает количество вещества эквивалента, содержащегося
- 23. Эквивалент элемента – такое его количество, которое соединяется с 1 молем атомов водорода или ½ моля
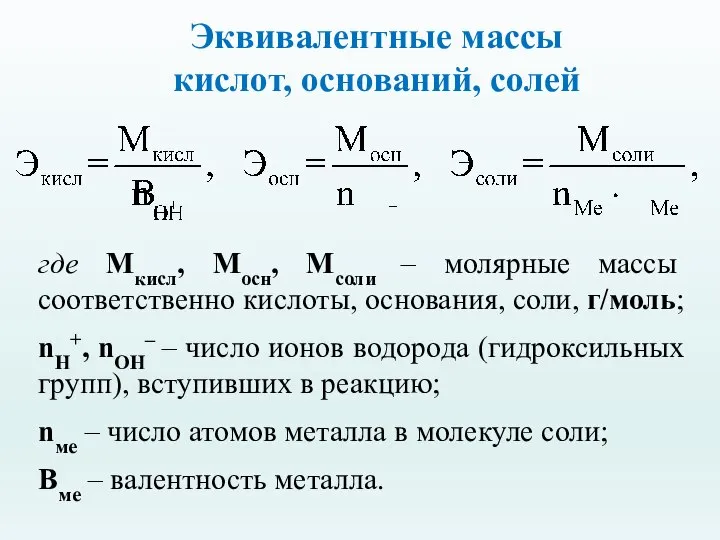
- 24. Эквивалентные массы кислот, оснований, солей где Мкисл, Мосн, Мсоли – молярные массы соответственно кислоты, основания, соли,
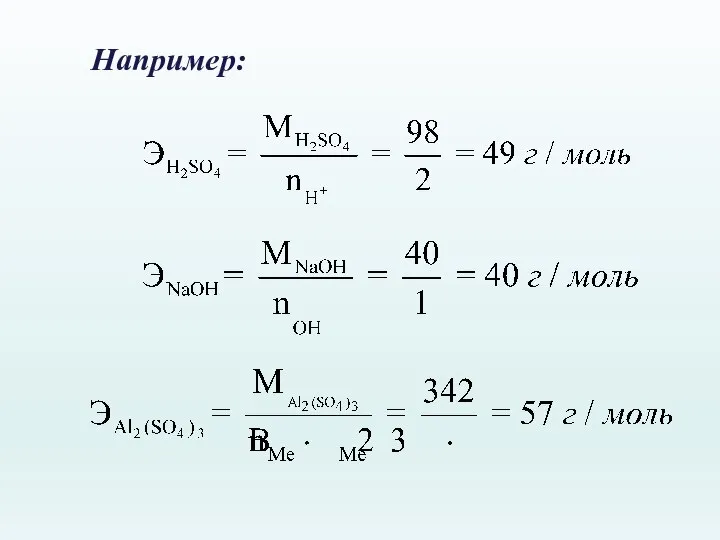
- 25. Например:
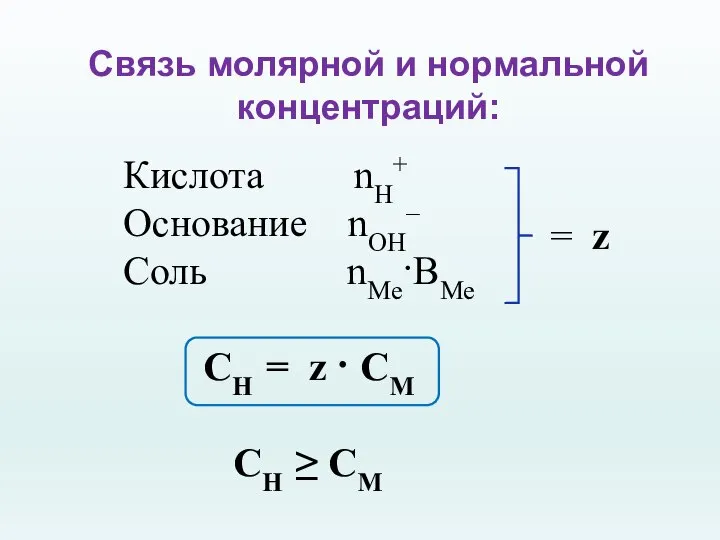
- 26. Связь молярной и нормальной концентраций: Кислота nH+ Основание nОH– Соль nМе·ВМе СН = z · CM
- 27. Для реагирующих веществ, находящихся в растворе, можно записать закон эквивалентов: V1, V2 – объемы растворов, л.
- 28. Примеры: 1. Тип «Все виды концентраций» В 282 мл воды растворили 18 г ортофосфорной кислоты. Плотность
- 29. Степень диссоциации. Сильные и слабые электролиты Количественно процесс диссоциации электролитов характеризуется степенью электролитической диссоциации. Степень диссоциации
- 30. !!! Степень диссоциации показывает долю молекул вещества, распавшихся на ионы и, таким образом, характеризует силу электролита.
- 31. Степень диссоциации α зависит от: природы растворенного вещества, температуры, концентрации раствора.
- 32. По значению α все электролиты условно делят на: сильные (α → 1) слабые (α
- 33. !!! Сильные электролиты α → 1 1. Хорошо растворимые соли: Na2SO4 … 2. Кислоты: HCl, HBr,
- 34. !!! Слабые электролиты α 1. Органические кислоты: HCOOH, CH3COOH ... 2. Кислоты, не относящиеся к сильным:
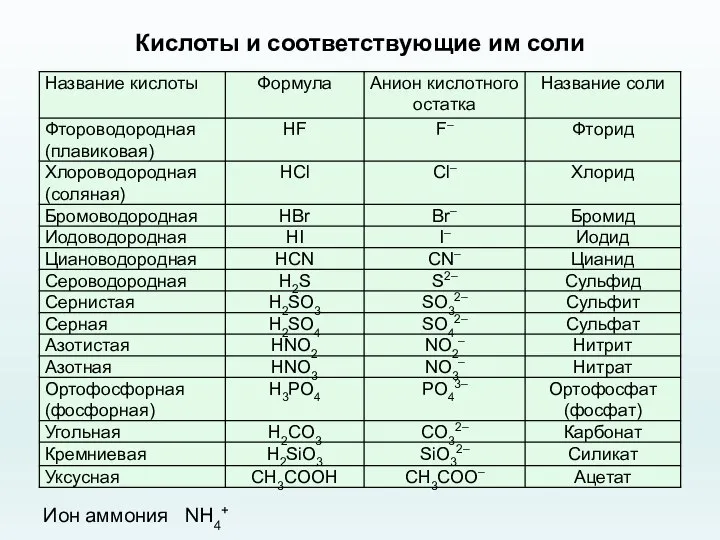
- 35. Кислоты и соответствующие им соли Ион аммония NH4+
- 36. Растворы сильных электролитов Сильные электролиты диссоциируют на ионы полностью, процесс диссоциации протекает необратимо (→): H2SO4 →
- 37. Концентрация ионов (катионов и анионов) в растворе сильного электролита Для разбавленных растворов сильных электролитов: , моль/л
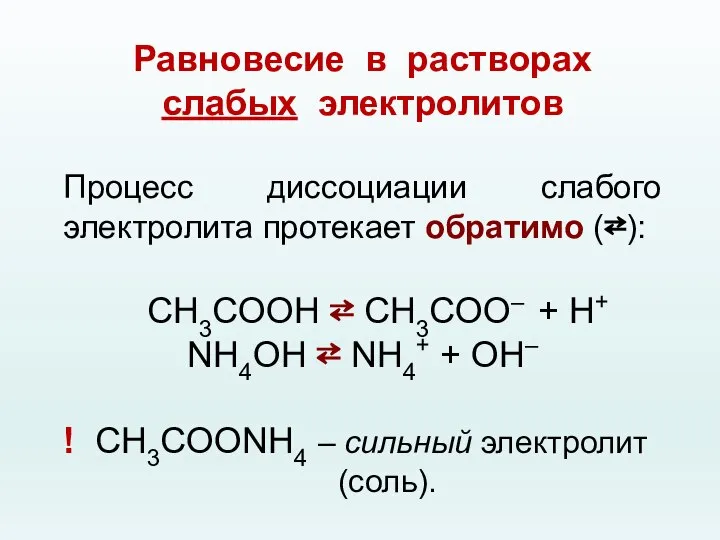
- 38. Равновесие в растворах слабых электролитов Процесс диссоциации слабого электролита протекает обратимо (⇄): CH3COOH ⇄ CH3COO– +
- 39. Для многоосновных кислот (H2S …) и многокислотных оснований (Mg(OH)2 …) характерна ступенчатая диссоциация: H2S ⇄ H+
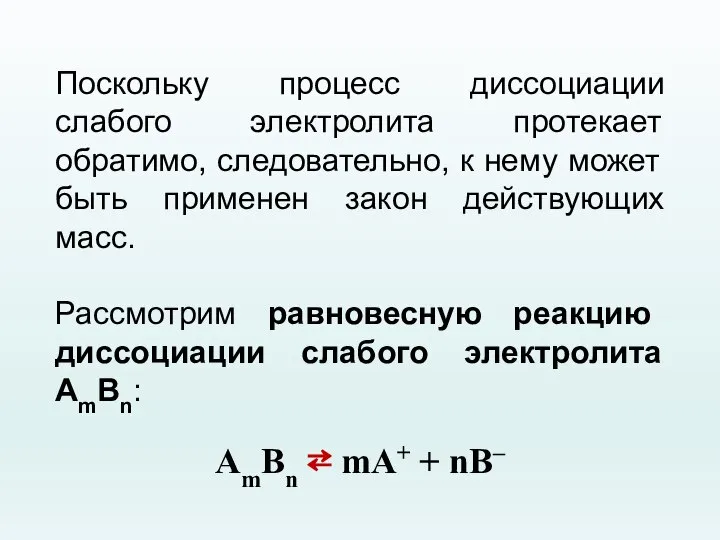
- 40. Поскольку процесс диссоциации слабого электролита протекает обратимо, следовательно, к нему может быть применен закон действующих масс.
- 41. Константа равновесия для процесса диссоциации слабого электролита называется константой диссоциации (KД): где CA+, CB– – равновесные
- 42. KД зависит от: природы диссоциирующего вещества, растворителя, температуры. KД не зависит от: концентрации раствора.
- 43. KД – справочная величина! Константа диссоциации характеризует способность электролита распадаться на ионы. Чем больше численное значение
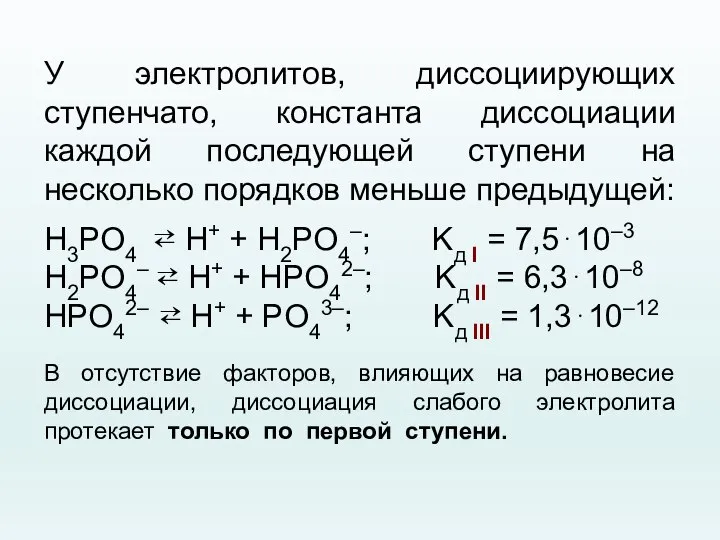
- 44. У электролитов, диссоциирующих ступенчато, константа диссоциации каждой последующей ступени на несколько порядков меньше предыдущей: H3PO4 ⇄
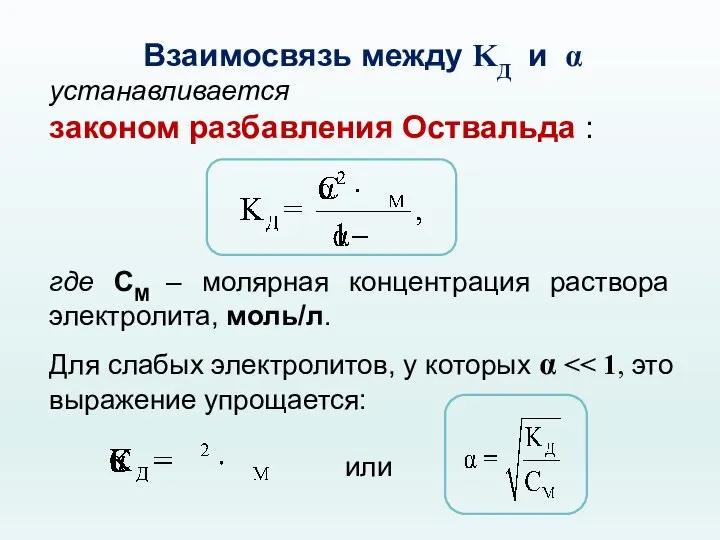
- 45. Взаимосвязь между KД и α устанавливается законом разбавления Оствальда : где CМ – молярная концентрация раствора
- 46. !!! Закон разбавления Оствальда выражает зависимость степени диссоциации слабого электролита от концентрации раствора: при разбавлении раствора
- 47. 1. Чем объясняется усиление свечения лампочки при разбавлении раствора? В какую сторону сместилось равновесие диссоциации уксусной
- 48. При разбавлении раствора в соответствии с законом разбавления Оствальда увеличивается степень диссоциации слабого электролита, соответственно, увеличивается
- 49. 2. Сделайте вывод о зависимости степени диссоциации слабого электролита от разбавления раствора. Запишите, исходя из закона
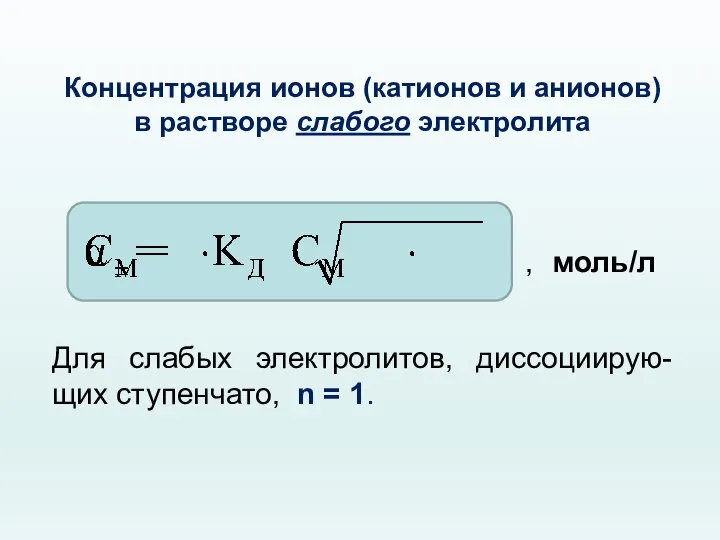
- 50. Концентрация ионов (катионов и анионов) в растворе слабого электролита , моль/л Для слабых электролитов, диссоциирую-щих ступенчато,
- 51. Cмещение равновесия диссоциации слабого электролита Основным фактором, позволяющим смещать положение равновесия (⇄) в растворах слабых электролитов,
- 52. Пример: HClO ⇄ H+ + ClO– NaClO → Na+ + ClO– СClО_ ↑ (Cпрод.↑) по принципу
- 53. Ионное произведение воды. Водородный показатель Вода является слабым электролитом, поэтому в любом водном растворе существует равновесие:
- 54. Процесс электролитической диссоциа-ции воды количественно характеризу-ется константой диссоциации: Численное значение KД H2O при Т=298К определено экспериментально
- 55. Равновесная концентрация недиссоции-рованных молекул воды CH2O практически равна ее молярной концентрации, которая для воды объемом 1
- 56. Величина ионного произведения воды остается постоянной при неизменной температуре (298 К) не только в чистой воде,
- 57. Для практической оценки характера водной среды растворов используется водородный показатель. Водородный показатель рН – отрицательный десятичный
- 58. Гидроксильный показатель рОН – отрицательный десятичный логарифм молярной концентрации гидроксид-ионов в растворе
- 59. !!! Характер водной среды растворов: нейтральная рН = 7 CН+ = СОН_ = 10–7 моль/л кислая
- 60. Для приблизительного практического определения рН растворов используются индикаторы – вещества, изменяющие свою окраску в зависимости от
- 61. Примеры: Вычислите pH раствора: 1. H2SO4 0,1 н.; 2. HNO2 0,1 М; 3. NaOH ω =
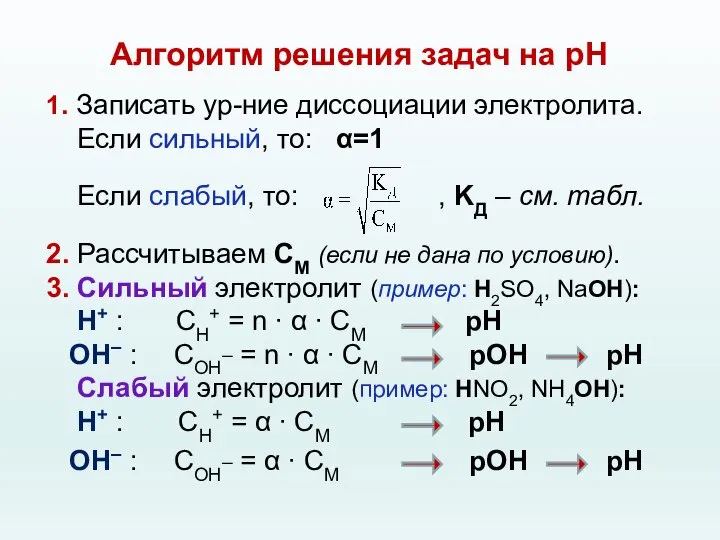
- 62. Алгоритм решения задач на рН 1. Записать ур-ние диссоциации электролита. Если сильный, то: α=1 Если слабый,
- 63. Алгоритм решения задач на рН
- 65. Скачать презентацию
















































 Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР
Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР Соединения галогенов
Соединения галогенов Художественная обработка металла
Художественная обработка металла Углеводороды. Предельные (насыщенные) углеводороды
Углеводороды. Предельные (насыщенные) углеводороды Презентация на тему Обобщение: предельные и непредельные углеводороды
Презентация на тему Обобщение: предельные и непредельные углеводороды  Металлы и их соединения
Металлы и их соединения Стехиометрические законы химии
Стехиометрические законы химии Химическое равновесие
Химическое равновесие Презентация на тему Органическая химия "Жиры"
Презентация на тему Органическая химия "Жиры"  Физические свойства минералов
Физические свойства минералов Растворы
Растворы География. Уральские самоцветы
География. Уральские самоцветы Химия жиров (липидов)
Химия жиров (липидов) Сплавы металлов (познавательная презентация)
Сплавы металлов (познавательная презентация) Презентация на тему Химия и сельское хозяйство
Презентация на тему Химия и сельское хозяйство  Сложные эфиры. Жиры
Сложные эфиры. Жиры Разминка для болельщиков
Разминка для болельщиков Нуклеиновые кислоты
Нуклеиновые кислоты Классификация органических веществ
Классификация органических веществ Карбид кальция. Назначение
Карбид кальция. Назначение Cкорость химических реакций
Cкорость химических реакций Формирование универсальных учебных действий на уроках химии средствами интерактивного обучения
Формирование универсальных учебных действий на уроках химии средствами интерактивного обучения Презентация на тему Строение атома Химическая связь
Презентация на тему Строение атома Химическая связь  Обобщение и повторение за курс основной школы по химии. 9 класс
Обобщение и повторение за курс основной школы по химии. 9 класс Строение атома. Планетарная модель атома Резерфорда
Строение атома. Планетарная модель атома Резерфорда Ковалентная неполярная химическая связь
Ковалентная неполярная химическая связь Химические уравнения
Химические уравнения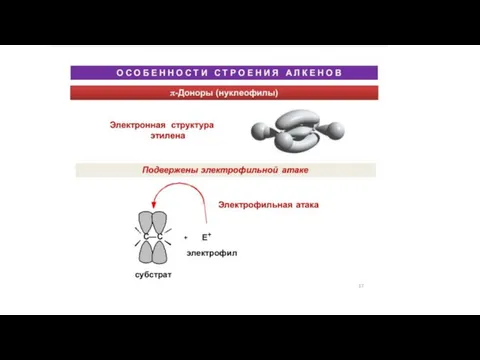 Особенности строения алкенов
Особенности строения алкенов