Содержание
- 2. Цели урока: Обобщить и закрепить знания о классификации, номенклатуре, свойствах органических и неорганических кислот Научить объяснять
- 3. Определение кислот Кислоты в природе Классификация кислот Химические свойства кислот Получение кислот Применение кислот План урока:
- 4. Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только гидратированные ионы водорода (H3O+). 1.
- 5. В 1923г. была предложена протолитическая теория Бернстедом-Лаури. Кислоты – это молекулы или ионы, которые являются донорами
- 6. 2. Кислоты в природе Кислотные дожди (азотная, серная кислоты) Кислоты в пище (яблочная, щавелевая, лимонная, молочная,
- 7. Паук педипальпида стреляет в своих врагов струйкой, состоящей из уксусной кислоты. Плоские тысяченожки используют яд пострашнее
- 8. Витамины: аскорбиновая, фолиевая, оротовая, пангамовая, никотиновая и другие. Гиалуроновая кислота – основной компонент смазки суставов. Аминокислоты
- 9. По составу: Кислородосодержащие: НNO3, H2SO3; Бескислородные: HCl, H2S. По основности: (основность кислоты определяется числом катионов, которые
- 10. Взаимодействие с металлами, расположенными в электрохимическом ряду напряжений металлов до водорода. 4. Химические свойства кислот:
- 11. Взаимодействие с основными и амфотерными оксидами.
- 12. Взаимодействие с растворимыми и нерастворимыми основаниями. Могут образовывать средние и кислые соли. Это реакции нейтрализации.
- 13. Взаимодействие с солями Сильная кислота способна вытеснить слабую кислоту даже из нерастворимой соли.
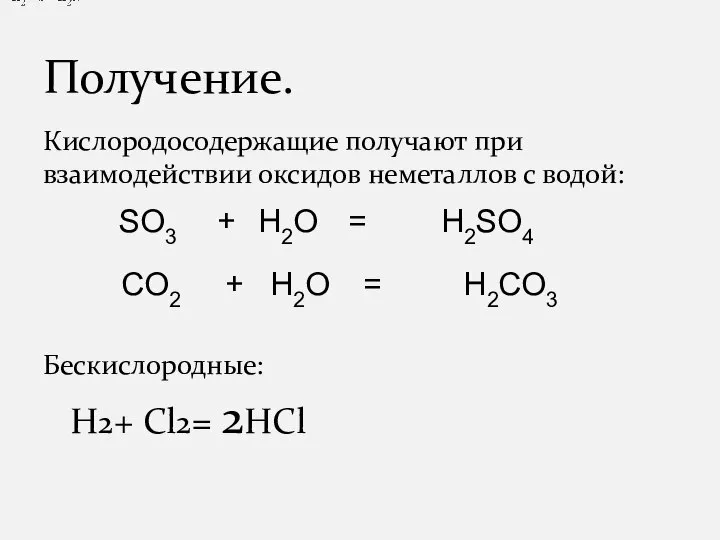
- 14. Кислородосодержащие получают при взаимодействии оксидов неметаллов с водой: Бескислородные: H2+ Cl2= 2HCl Получение.
- 15. Соляная кислота Для растворения окалины и ржавчины при никелировании, хромировании, цинковании и т.п. стальных и чугунных
- 16. Серная кислота Для производства фосфорных и азотных удобрений В производстве взрывчатых веществ Искусственных волокон Красителей Пластмасс
- 17. Азотная кислота Производство азотных удобрений Взрывчатых веществ Лекарственных веществ Красители Пластмассы Искусственные волокна
- 18. Задание 1. Напишите формулы и дайте характеристику кислотам на основе их классификации: кремниевая кислота, плавиковая кислота.
- 20. Скачать презентацию















 Совершенствование железооксидного катализатора дегидрирования за счет стабилизации ферритных фаз
Совершенствование железооксидного катализатора дегидрирования за счет стабилизации ферритных фаз Соли. Свойства. Получение
Соли. Свойства. Получение Кислотные оксиды
Кислотные оксиды Metals Properties and compounds
Metals Properties and compounds 1-методы количественного анализа
1-методы количественного анализа Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны
Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны Практическая работа №1. Определение содержания нитратов в овощах и фруктах
Практическая работа №1. Определение содержания нитратов в овощах и фруктах Тефлон
Тефлон ZhK_Prezentatsia_1
ZhK_Prezentatsia_1 Сложные реакции
Сложные реакции День химии
День химии Химия и автомобиль
Химия и автомобиль Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Химия, химия, химия!
Химия, химия, химия! Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты
Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты Презентация на тему Атомы и молекулы
Презентация на тему Атомы и молекулы  Диены. Понятие о диенах
Диены. Понятие о диенах Натуральный каучук
Натуральный каучук Уравнения химических реакций
Уравнения химических реакций Рений. Содержание рения в земной коре
Рений. Содержание рения в земной коре Презентация на тему Дисперсные системы и растворы
Презентация на тему Дисперсные системы и растворы  Вспомогательные средства для стирки
Вспомогательные средства для стирки Классификация неорганический веществ
Классификация неорганический веществ Физическая химия растворов электролитов
Физическая химия растворов электролитов Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Химический процесс: энергетика и равновесие
Химический процесс: энергетика и равновесие Презентация 3. Теория ЕГЭ
Презентация 3. Теория ЕГЭ