соединений в составе минералов: галита NaCI,
сильвина KCl,
сильвинита KCl · NaCl,
бишофита MgCl2 · 6H2O,
карналлита KCl · MgCl2 · 6Н2O,
каинита KCl · MgSO4 · 3Н2О.
Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
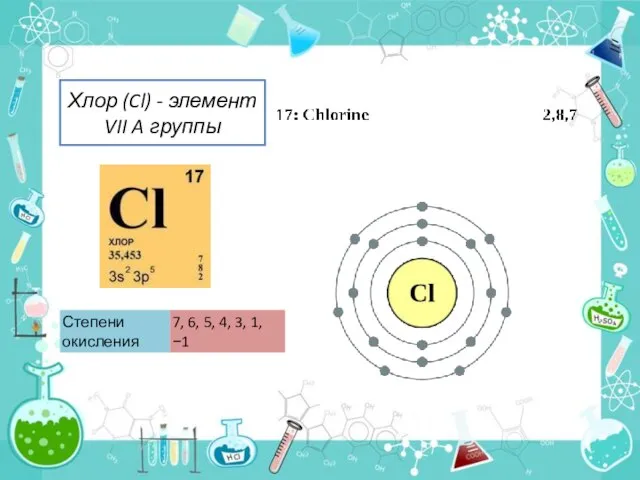
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37.







 Оксиды
Оксиды Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Нефть и газ
Нефть и газ Коррозия металлов
Коррозия металлов Химия. Вопросы. Практическая работа
Химия. Вопросы. Практическая работа Презентация на тему Халькогены
Презентация на тему Халькогены  Общая характеристика галогенов на основе положения химических элементов в периодической системе
Общая характеристика галогенов на основе положения химических элементов в периодической системе Lektsia_3_Alkaloidy_morfinana
Lektsia_3_Alkaloidy_morfinana Массовые доли растворенного вещества
Массовые доли растворенного вещества Добыча золота в России По теме «Внешние эффекты и права собственности»
Добыча золота в России По теме «Внешние эффекты и права собственности» Строение вещества
Строение вещества Презентация на тему Карбоновые кислоты
Презентация на тему Карбоновые кислоты  Получение металлов
Получение металлов Металлы
Металлы Общая характеристика металлов
Общая характеристика металлов Предельные одноатомные спирты
Предельные одноатомные спирты Голубое золото
Голубое золото Пересчет данных анализа, выраженных в ионной форме
Пересчет данных анализа, выраженных в ионной форме Скорость химической реакции. 9 класс
Скорость химической реакции. 9 класс Введение в дисциплину Процессы и аппараты химической технологии
Введение в дисциплину Процессы и аппараты химической технологии Общие свойства неметаллов
Общие свойства неметаллов Химический состав клетки
Химический состав клетки Реакции обмена
Реакции обмена KNO3 ; Ba(OH)2 ; Na2SO4 ; Al2(SO4)3 ;
KNO3 ; Ba(OH)2 ; Na2SO4 ; Al2(SO4)3 ; Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C
Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C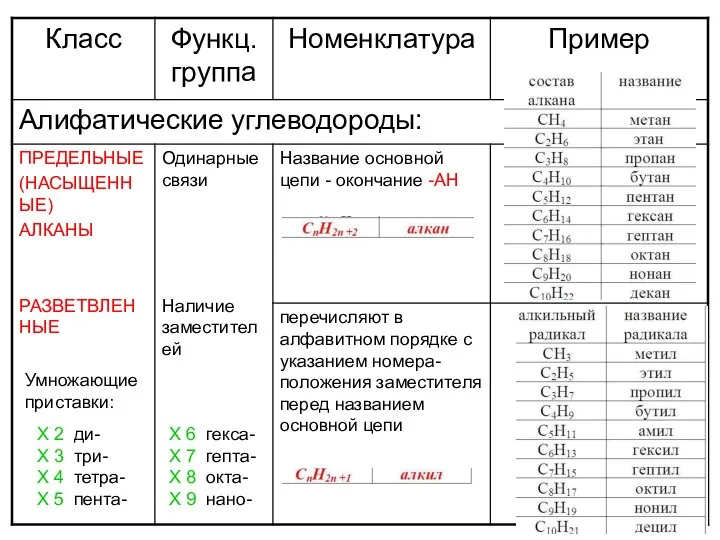 Алифатические углеводороды
Алифатические углеводороды Донорно-акцепторный механизм образование связи
Донорно-акцепторный механизм образование связи Потенциометрический анализ, титрование
Потенциометрический анализ, титрование