Слайд 2Химические реакции проходят с различными скоростями. Коррозия металлов протекает медленно, осаждение малорастворимой

соли – быстро, а взаимодействие водорода и кислорода со скоростью взрыва.
4Fe + 3O2 + 6H2O= 4Fe(OH)3 ; 2Н2 + О2 = 2Н2О
AgNO3 + NaCl = AgCl + NaNO3
Химическая кинетика изучает факторы, влияющие на скорость химических реакций и механизмы химических реакций
Слайд 3Для того, чтобы произошла химическая реакция, необходимо:
Столкновение частиц,
Достаточный запас энергии у
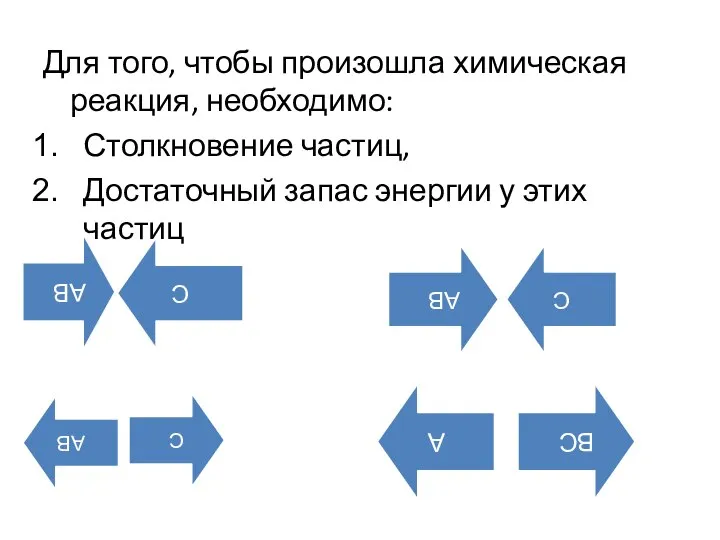
этих частиц
Слайд 4Скорость химической реакции – это число соударений , приведших к химическому превращению

в единице объема в единицу времени.
На практике скорость химической реакции определяется как изменение концентрации реагирующих веществ в единицу времени.
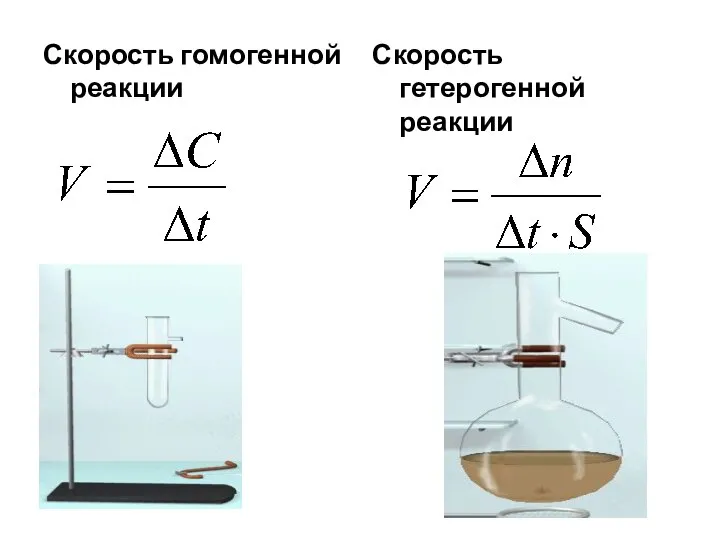
Слайд 5Скорость гомогенной реакции
Скорость гетерогенной реакции
Слайд 6Факторы влияющие на скорость химической реакции
Природа реагирующих веществ
Еа < 40 кДж/моль -

скорость реакции большая.
CuSO4 + NaOH = Na2SO4 + Cu(OH)2
Еа >120 кДж/моль - скорость реакции мала.
N2 + H2 = NH3 +Q
Еа 40-120 кДж/моль - скорость реакции средняя.
Zn + 2HCl = ZnCl2 + H2
Слайд 7Температура
Правило Я.Х.Вант-Гоффа
При повышении температуры на каждые 10°С скорость химической реакции увеличивается

в 2-4 раза.
Слайд 8Задачи
Во сколько раз возрастет скорость реакции при повышении температуры на 30°С,

если температурный коэффициент равен 3.
ответ: 27
Слайд 9 На сколько необходимо повысить температуру, чтобы скорость возросла в 8 раз

(γ =2)?
Отв. на 30°
Во сколько раз возрастет скорость при повышении температуры на 50°С? (γ =2)
Ответ: 32
Слайд 10 1. Вычислите скорость химической реакции, если γ =2. Скорость начальная реакции

0,04моль/л·ч при t=20°. Какая скорость будет при t=0°, t=40°, t=10°.
2.Чему будет равен температурный коэффициент, если реакция при 60°С протекает полностью за 270с, а при 80°С – за 30 с.
3.Во сколько раз изменится скорость реакции при
Δt=20°, Δt=40°.( γ =4)
Слайд 11Коэффициент Вант-Гоффа для реакции гидролиза сахарозы приблизительно равен 4 ( точно 4,2

). Во сколько раз возрастет скорость этой реакции при повышении температуры на 10°С? 20°С?
C12H22O11 + H2O = 2 C6H12O6
2.Во сколько раз увеличится скорость гидролиза сахарозы в организме заболевшего человека, если у больного температура 42°С?
3.При снижении температуры реакционной смеси с 50 до 30°С скорость некоторой реакции уменьшается в 7,3 раза. Как изменится скорость этой реакции при повышении температуры от 20 до 60°С?
4.При охлаждении реакционной смеси со 170 до 150°С скорость реакции уменьшилась в 250 раз. Вычислите температурный коэффициент.
Слайд 13Концентрация реагирующих веществ
В 1867г. норвежцами К. Гульдбергом и П.Вааге и независимо от

них 1865г. Русским ученым Н.И. Бекетовым был сформулирован закон:
Закон действующих масс
Скорость химической реакции прямо пропорциональна произведению мольных концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
Слайд 14А + В = D
V =k CA CB
2A + B

= D
V =k C2A CB
CA CB - концентрация веществ А и В (моль/л)
k - коэффициент пропорциональности










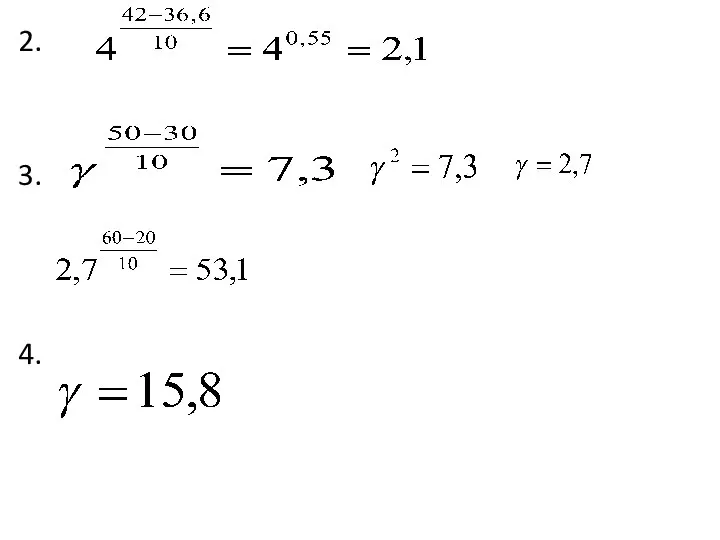


 Тип кристаллической решетки у белого фосфора…. Тест
Тип кристаллической решетки у белого фосфора…. Тест Презентация на тему Наука о стекле в творчестве М.В. Ломоносова и в наши дни
Презентация на тему Наука о стекле в творчестве М.В. Ломоносова и в наши дни  Наблюдения в сходящемся свете. Коноскопия
Наблюдения в сходящемся свете. Коноскопия Современные способы защиты ОТТ
Современные способы защиты ОТТ Кремний – химический элемент или природный дар
Кремний – химический элемент или природный дар Калийные удобрения
Калийные удобрения Лиофобные дисперсные системы. Конденсация. Растворение. Флокуляция. Лекция 13
Лиофобные дисперсные системы. Конденсация. Растворение. Флокуляция. Лекция 13 Соли. Состав и классификация
Соли. Состав и классификация Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Альдегиды и кетоны. (Лекция 6.2)
Альдегиды и кетоны. (Лекция 6.2) Химия элементов IVA группы
Химия элементов IVA группы получение Ме презентация
получение Ме презентация Особенности решения практикоориентированного задания №26 ГИА-11
Особенности решения практикоориентированного задания №26 ГИА-11 Основания. Классификация, состав и номенклатура оснований
Основания. Классификация, состав и номенклатура оснований Химические структуры
Химические структуры Контрольная работа
Контрольная работа Химическое равновесие
Химическое равновесие Презентация на тему Алканолы - Предельные одноатомные спирты
Презентация на тему Алканолы - Предельные одноатомные спирты  Химия. Вещества. 8 класс
Химия. Вещества. 8 класс Химическая связь
Химическая связь Презентация на тему: Подгруппа азота
Презентация на тему: Подгруппа азота Непредельные углеводороды: алкены и алкины
Непредельные углеводороды: алкены и алкины Магний (Mg, Magnesium). Общая характеристика магния
Магний (Mg, Magnesium). Общая характеристика магния Презентация на тему Состав, строение и свойства стекла и хрусталя
Презентация на тему Состав, строение и свойства стекла и хрусталя  Хлороводород и соляная кислота
Хлороводород и соляная кислота Относительная молекулярная масса вещества
Относительная молекулярная масса вещества lektsia_5
lektsia_5 Мыло. Интересно об известном
Мыло. Интересно об известном