Содержание
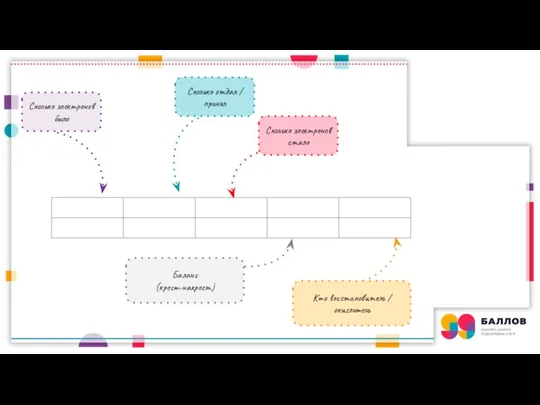
- 2. Cколько электронов было Сколько отдал / принял Cколько электронов стало Кто восстановитель / окислитель Баланс (крест-накрест)
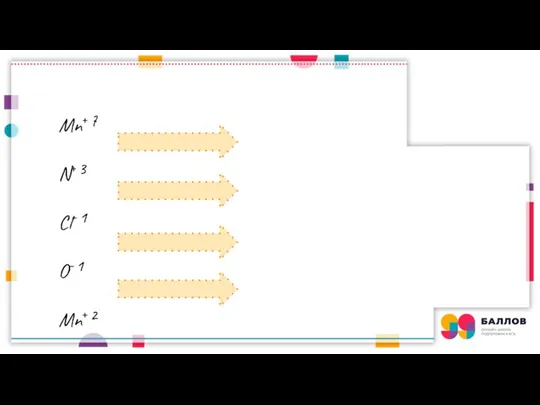
- 3. Mn⁺⁷ N⁺³ Cl⁻¹ O⁻¹ Mn⁺² N⁺⁵ Cl2⁰ O2⁰
- 4. NaMnO4 + KNO2 + H2SO4 = MnSO4 + KNO3 + Na2SO4 + H2O
- 5. HNO3 !!!!!!!! Au и Pt с азотной кислотой __________________________ Ca и Mg с азотной кислотой любой
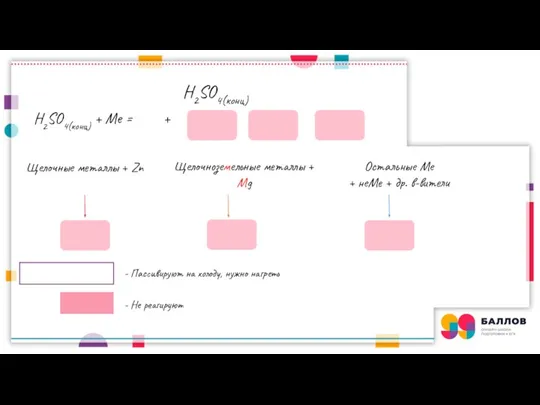
- 6. H2SO4(конц) + Me = + + - Пассивируют на холоду, нужно нагреть - Не реагируют Щелочные
- 8. Скачать презентацию


 Бензилиденкетоны в синтезе замещённых бензимидазолопиримидинов
Бензилиденкетоны в синтезе замещённых бензимидазолопиримидинов Амины. Способы получения
Амины. Способы получения Металлы. Контрольная работа
Металлы. Контрольная работа Решение задач на нахождение молекулярной формулы газообразного алкана
Решение задач на нахождение молекулярной формулы газообразного алкана Презентация по Химии "Фосфор - элемент жизни и мысли"
Презентация по Химии "Фосфор - элемент жизни и мысли"  Строение вещества. Химическая связь
Строение вещества. Химическая связь Селективность (реакторы)
Селективность (реакторы) Алкены
Алкены Циклоалканы (полиметиленовые, циклопарафины, ациклические)
Циклоалканы (полиметиленовые, циклопарафины, ациклические) Строение вещества
Строение вещества Мыла и синтетические
Мыла и синтетические Сeквенирование нуклеиновых кислот
Сeквенирование нуклеиновых кислот Многообразие веществ
Многообразие веществ Алкены. Роль алкенов в жизни человека
Алкены. Роль алкенов в жизни человека Типичные окислители. 9 класс
Типичные окислители. 9 класс Презентация на тему Химические реакции 11 класс
Презентация на тему Химические реакции 11 класс  Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Опыт Пилатра де Розьера
Опыт Пилатра де Розьера Очистка различных поверхностей от нефтяных загрязнений
Очистка различных поверхностей от нефтяных загрязнений Алмаз. Свойства алмазов
Алмаз. Свойства алмазов Ковалентная неполярная связь
Ковалентная неполярная связь Валентность химических элементов
Валентность химических элементов минералы_4_блеск
минералы_4_блеск Электролиз растворов и расплавов неорганических и органических электролитов
Электролиз растворов и расплавов неорганических и органических электролитов Перекрывающиеся гены
Перекрывающиеся гены Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4
Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4 Структурный тип
Структурный тип Кислородсодержащие органические соединения
Кислородсодержащие органические соединения